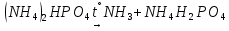- •Неорганическая химия наука о природе
- •Природные явления
- •Чистые вещества и смеси
- •Химический элемент
- •Химический символ обозначает
- •Химический состав
- •Химическая формула и расчет по формулам
- •Схемы строения атомов химических элементов побочных подгрупп
- •Периодичность изменения химических и физических свойств элементов главных подгрупп
- •Валентность
- •Составление химических формул по валентности
- •Электроотрицательность
- •Относительная электроотрицательность химических элементов
- •Степень окисления
- •Химическая связь
- •Типы кристаллических решеток
- •Взаимосвязь основных химических понятий
- •Свойства и применение кислорода
- •Классификация сложных неорганических веществ
- •Генетические связи между классами неорганических веществ
- •Классификация кислот
- •Номенклатура кислот и средних солей
- •Химические свойства сложных неорганичеких веществ
- •Примеры уравнений химических реакций
- •Химические свойства воды ()
- •Очистка воды
- •Растворы
- •Растворимость веществ
- •Количество растворенного вещества
- •Концентрации растворов
- •Химические реакции классификация химических реакций
- •Окислительно-восстановительные реакции
- •Составление уравнений окислительно-восстановительных реакций методом электронного баланса
- •Форма записи о.В.Р.
- •Гидролиз солей количественные соотношения при химических реакциях
- •2. Кислоты, основания, амфотерные
- •3. Реакции ионного обмена
- •Металлы
- •1. Ме — химический элемент
- •2. Ме — простое вещество
- •3. Химические свойства металлов
- •Промышленные способы получения металлов
- •Электрохимический ряд напряжений металлов
- •Электролиз
- •Применение электролиза
- •Металлы I группы главной подгруппы (щелочные) Сравнительная характеристика химических элементов
- •Сравнительная характеристика физических свойств простых веществ
- •Металлы II группы главной подгруппы (щелочно-земельные) Сравнительная характеристика химических элементов
- •Сравнительная характеристика физических свойств простых веществ
- •Характер соединений оксидов ме
- •II группы главной подгруппы
- •Жесткость воды
- •Элементы III группы главной подгруппы Сравнительная характеристика химических элементов
- •Сравнительная характеристика физических свойств простых веществ
- •Неметаллы
- •1. НеМе—химический элемент
- •2. НеМе — простое вещество
- •Углерод (с). Аллотропия углерода (с)
- •Угольная кислота
- •Соли угольной кислоты
- •Аллотропия кремния
- •Соединения кремния (si)
- •Силикатная промышленность
- •Простые вещества, образованные элементами
- •V группы главной подгруппы
- •Азот — простое вещество
- •Получение азота (n2)
- •Синтез аммиака в промышленности
- •Получение аммиака в лаборатории
- •Химические свойства
- •Оксиды азота (n)
- •Азотная кислота
- •Нитраты
- •Аллотропия форфора (р)
- •Химические свойства фосфора (р)
- •Соединения фосфора (р)
- •Фосфорная кислота
- •Элементы VI группы главной подгруппы
- •Простые вещества элементов VI группы главной подгруппы
- •Аллотропия кислорода ("о")
- •Аллотропия серы (s)
- •Соединения серы (s)
- •Кислоты серы (s)
- •Производство
- •Элементы VII группы главной подгруппы (галогены) Сравнительная характеристика химических элементов
- •Простые вещества элементов VII группы главной подгруппы
- •Химические свойства простых веществ на примере
- •Соляная кислота (hCl)
- •Химические свойства соляной кислоты
- •Медь (Cu) — представитель химических элементов побочных подгрупп
- •Железо (Fe) — представитель химических элементов побочных подгрупп
- •Железо (Fe) — простое вещество
- •Химические свойтсва () — восстановитель
- •Соединения железа в степени окисления
- •Производство чугуна
- •Производство стали
- •Способы получения стали
- •Реакции, лежащие в основе производства стали кислородно-конвертерным и мартеновским способами
- •Хром (Cr) — представитель химических элементов побочных подгрупп
- •Хром (Cr) — простое вещество
- •Химические свойства Cro
- •Соединения хрома (Cr)
Простые вещества, образованные элементами
V группы главной подгруппы
|
Молекула простого вещества |
Принадлежность к классу |
Цвет |
Свойства |
Связь |
Химическая активность |
Тпл., |
Ткип., |
| |||||||||
|
N2 |
неметаллы |
бесцветный |
газ, без запаха, без вкуса, малорастворим в воде |
ковалентная |
увеличиваются неметаллические свойства |
|
–210 |
-195,8 |
0,808 (жидк.) | ||||||||
|
Px |
белый, красный, черный |
твердое, хрупкое в-во, неэлектропроводен |
44,1 (бел.) |
275 (бел.) |
1,82 (желт.) | ||||||||||||
|
As |
серибристо-серый с метал. блеском |
кристаллическое в-во, электропроводен |
увеличиваются металлические свойства |
|
817 |
612 (возг.) |
5,727 | ||||||||||
|
Sb |
металлы |
серебристо-белый |
твердые, электро-проводны, ковки, пластичны |
|
630,5 |
1625 |
6,68 | ||||||||||
|
Bi |
серебристый с красным оттенком |
271,3 |
1430 |
9,80 | |||||||||||||
Азот — простое вещество
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Получение азота (n2)
|
В промышленности |
Фракционной перегонкой жидкого воздуха (так как N2 и O2 не образуют азеотропной смеси)
tкип.
(N2)
= –195,8
tкип.
(О2)
= –183 Сначала испаряется азот |
|
В лаборатории |
(улавливают
CaC (азид Na) |
 —АММИАК
—АММИАК
|
электронная
|
Н Н
Н
графическая N
— H = 10
формула Молекула
|
H→N←H ↑ H структурная |
Молекула | |
1V(
при
t = 0
|
Физические свойства | |||
Синтез аммиака в промышленности
|
Сырье: |
|
фракционная перегонка жидкого воздуха t
кипения ( t
кипения ( Сначала испаряется азот
|
Стадии производства:
Сжатие (
 )
смеси
)
смесиНагревание смеси
Синтез

Охлаждение газовой смеси
Отделение
 от газовой смеси
от газовой смеси
10–12%
Получение аммиака в лаборатории

Химические свойства
|
Реакции присоединения |
Реакции замещения |
Окислительно-восстановительные реакции |
|
По донорно-акцепторному механизму
донор акцептор ион аммония
хлорид аммония |
–3 + о +3 –3 о
нитрид твердые кристаллические вещества, разрушаются в воде
(исключая О2, F2)
нитрид
летучие |
–3 o
–3 o
–3 o
|
|
+ o +2 -3 o
|
Продолжение
|
Реакции присоединения |
Реакции замещения |
|
Соли
Гидролиз:
|
t
плавления (Ti)
= 1668
t
плавления (TiN)
= 3220
t
плавления (Zr)
= 1852
t
плавления (ZrN)
= 2950
Не разлагаются водой, не окисляются кислородом. Высокопрочный материал. |
|
Неполное замещение
| |
|
Качественная
реакция на
резкий запах |



 ,
г/см3
,
г/см3









 )
)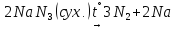











 —
полярна
—
полярна ):1200V(
):1200V( )
) при
t = 0
при
t = 0
 ):700V(
):700V( )
)
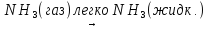 tкипения
= –33,35
tкипения
= –33,35
 tплавления
= –77, 75
tплавления
= –77, 75

 )
= 195,8
)
= 195,8
 )
= –183
)
= –183








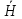 +
+




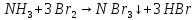
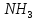 —восстановитель
—восстановитель

 )
)
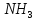 —окислитель
—окислитель