
- •Неорганическая химия наука о природе
- •Природные явления
- •Чистые вещества и смеси
- •Химический элемент
- •Химический символ обозначает
- •Химический состав
- •Химическая формула и расчет по формулам
- •Схемы строения атомов химических элементов побочных подгрупп
- •Периодичность изменения химических и физических свойств элементов главных подгрупп
- •Валентность
- •Составление химических формул по валентности
- •Электроотрицательность
- •Относительная электроотрицательность химических элементов
- •Степень окисления
- •Химическая связь
- •Типы кристаллических решеток
- •Взаимосвязь основных химических понятий
- •Свойства и применение кислорода
- •Классификация сложных неорганических веществ
- •Генетические связи между классами неорганических веществ
- •Классификация кислот
- •Номенклатура кислот и средних солей
- •Химические свойства сложных неорганичеких веществ
- •Примеры уравнений химических реакций
- •Химические свойства воды ()
- •Очистка воды
- •Растворы
- •Растворимость веществ
- •Количество растворенного вещества
- •Концентрации растворов
- •Химические реакции классификация химических реакций
- •Окислительно-восстановительные реакции
- •Составление уравнений окислительно-восстановительных реакций методом электронного баланса
- •Форма записи о.В.Р.
- •Гидролиз солей количественные соотношения при химических реакциях
- •2. Кислоты, основания, амфотерные
- •3. Реакции ионного обмена
- •Металлы
- •1. Ме — химический элемент
- •2. Ме — простое вещество
- •3. Химические свойства металлов
- •Промышленные способы получения металлов
- •Электрохимический ряд напряжений металлов
- •Электролиз
- •Применение электролиза
- •Металлы I группы главной подгруппы (щелочные) Сравнительная характеристика химических элементов
- •Сравнительная характеристика физических свойств простых веществ
- •Металлы II группы главной подгруппы (щелочно-земельные) Сравнительная характеристика химических элементов
- •Сравнительная характеристика физических свойств простых веществ
- •Характер соединений оксидов ме
- •II группы главной подгруппы
- •Жесткость воды
- •Элементы III группы главной подгруппы Сравнительная характеристика химических элементов
- •Сравнительная характеристика физических свойств простых веществ
- •Неметаллы
- •1. НеМе—химический элемент
- •2. НеМе — простое вещество
- •Углерод (с). Аллотропия углерода (с)
- •Угольная кислота
- •Соли угольной кислоты
- •Аллотропия кремния
- •Соединения кремния (si)
- •Силикатная промышленность
- •Простые вещества, образованные элементами
- •V группы главной подгруппы
- •Азот — простое вещество
- •Получение азота (n2)
- •Синтез аммиака в промышленности
- •Получение аммиака в лаборатории
- •Химические свойства
- •Оксиды азота (n)
- •Азотная кислота
- •Нитраты
- •Аллотропия форфора (р)
- •Химические свойства фосфора (р)
- •Соединения фосфора (р)
- •Фосфорная кислота
- •Элементы VI группы главной подгруппы
- •Простые вещества элементов VI группы главной подгруппы
- •Аллотропия кислорода ("о")
- •Аллотропия серы (s)
- •Соединения серы (s)
- •Кислоты серы (s)
- •Производство
- •Элементы VII группы главной подгруппы (галогены) Сравнительная характеристика химических элементов
- •Простые вещества элементов VII группы главной подгруппы
- •Химические свойства простых веществ на примере
- •Соляная кислота (hCl)
- •Химические свойства соляной кислоты
- •Медь (Cu) — представитель химических элементов побочных подгрупп
- •Железо (Fe) — представитель химических элементов побочных подгрупп
- •Железо (Fe) — простое вещество
- •Химические свойтсва () — восстановитель
- •Соединения железа в степени окисления
- •Производство чугуна
- •Производство стали
- •Способы получения стали
- •Реакции, лежащие в основе производства стали кислородно-конвертерным и мартеновским способами
- •Хром (Cr) — представитель химических элементов побочных подгрупп
- •Хром (Cr) — простое вещество
- •Химические свойства Cro
- •Соединения хрома (Cr)
Форма записи о.В.Р.
o o +3 –2
4Al
+ 3
|
4
3 |
o 4Al
– 3
|
ОБРАТИМЫЕ РЕАКЦИИ
|
|
прямая реакция |
|
|
|
|
|
|
|
обратная реакция |
|


ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Это особое состояние химической системы, находящейся в замкнутом
объеме при определенных условиях, при этом



 константа
равновесия, число постоянное при
определенных условиях
константа
равновесия, число постоянное при
определенных условиях
ПРИНЦИП ЛЕ ШАТЕЛЬЕ
|
Изменение условий реакций |
Смещение химического равновесия | ||
|
Температура |
повышение |
Увеличивается скорость эндотермической реакции | |
|
понижение |
Увеличивается скорость экзотермической реакции | ||
|
Давление |
повышение |
Увеличивается скорость химической реакции, протекающей с уменьшением объема | |
|
понижение |
Увеличивается скорость химической реакции, протекающей с увеличением объема | ||
|
Концентрация |
повышение |
Увеличивается скорость химической реакции, использующей вводимое вещество | |
|
понижение |
Увеличивается скорость химической реакции, протекающей с образованием вещества, концентрация которого понижается | ||
Гидролиз солей количественные соотношения при химических реакциях
2. Кислоты, основания, амфотерные
гидроксиды, соли как электролиты
а. Индикаторы
|
|
|
10–1 |
10–2 |
10–3 |
10–4 |
10–5 |
10–6 |
10–7 |
10–8 |
10–9 |
10–10 | ||
|
УИ— |
Цветная шкала |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 | ||
|
|
|
10–13 |
10–12 |
10–11 |
10–10 |
10–9 |
10–8 |
10–7 |
10–6 |
10–5 |
10–4 | ||
|
|
Среда |
кислая |
ней траль ная |
щелочная | |||||||||
|
|
Фенолфталеин |
Лакмус |
Метиловый, оранжевый |
|
Кислая |
бесцветный |
красный |
розовый |
|
Нейтральная |
бесцветный |
фиолетовый |
оранжевый |
|
Щелочная |
малиновый |
синий |
желтый |
е. Соли
|
средние |
|
кислые |
|
основные |
| ||
|
| |||||||
|
|
| ||||||
|
|
|
| |||||
3. Реакции ионного обмена
а. Условия
в. Уравнения
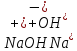 сильное
сильное
 слабая
слабая


р. среды — щелочная
рН > 7
 слабое
слабое
 сильная
сильная


р. среды — кислая
рН < 7
 слабое
слабое
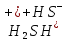 слабая
слабая


р. среды — нейтральная
рН ≈ 7
 сильное
сильное
 сильная
сильная
 нет
связывания ионов
нет
связывания ионов


р. среды — нейтральная
рН ≈7
Металлы
1. Ме — химический элемент
а.
I
II III
группа (исключая H, B)


IV
V VI
VII 
побочные
подгруппы
б. Ме +? ...)
от
1 до 3
до 3 (исключая Ме IV–VII
групп главной подгруппы)
(исключая Ме IV–VII
групп главной подгруппы)
Ra Me>Ra неМе
в. (окисление)
(окисление)
восстановитель
г.
0, +1, +2, +3
низшая
Степень
окисления Ме
+4,
+5, +6, +7, +8 высшая
д. Изменение восстановительных свойств атомов Ме в П.С.
|
в периоде
уменьшается
в главной подгруппе увеличивается
|
Причина (период): >заряд ядра >N <Ra
Причина (группа): >Ra |

 Al3+
окисление
Al3+
окисление



 ,
моль/л рН
,
моль/л рН ,
моль/л
,
моль/л













 на внешнем слое
на внешнем слое