
- •Неорганическая химия наука о природе
- •Природные явления
- •Чистые вещества и смеси
- •Химический элемент
- •Химический символ обозначает
- •Химический состав
- •Химическая формула и расчет по формулам
- •Схемы строения атомов химических элементов побочных подгрупп
- •Периодичность изменения химических и физических свойств элементов главных подгрупп
- •Валентность
- •Составление химических формул по валентности
- •Электроотрицательность
- •Относительная электроотрицательность химических элементов
- •Степень окисления
- •Химическая связь
- •Типы кристаллических решеток
- •Взаимосвязь основных химических понятий
- •Свойства и применение кислорода
- •Классификация сложных неорганических веществ
- •Генетические связи между классами неорганических веществ
- •Классификация кислот
- •Номенклатура кислот и средних солей
- •Химические свойства сложных неорганичеких веществ
- •Примеры уравнений химических реакций
- •Химические свойства воды ()
- •Очистка воды
- •Растворы
- •Растворимость веществ
- •Количество растворенного вещества
- •Концентрации растворов
- •Химические реакции классификация химических реакций
- •Окислительно-восстановительные реакции
- •Составление уравнений окислительно-восстановительных реакций методом электронного баланса
- •Форма записи о.В.Р.
- •Гидролиз солей количественные соотношения при химических реакциях
- •2. Кислоты, основания, амфотерные
- •3. Реакции ионного обмена
- •Металлы
- •1. Ме — химический элемент
- •2. Ме — простое вещество
- •3. Химические свойства металлов
- •Промышленные способы получения металлов
- •Электрохимический ряд напряжений металлов
- •Электролиз
- •Применение электролиза
- •Металлы I группы главной подгруппы (щелочные) Сравнительная характеристика химических элементов
- •Сравнительная характеристика физических свойств простых веществ
- •Металлы II группы главной подгруппы (щелочно-земельные) Сравнительная характеристика химических элементов
- •Сравнительная характеристика физических свойств простых веществ
- •Характер соединений оксидов ме
- •II группы главной подгруппы
- •Жесткость воды
- •Элементы III группы главной подгруппы Сравнительная характеристика химических элементов
- •Сравнительная характеристика физических свойств простых веществ
- •Неметаллы
- •1. НеМе—химический элемент
- •2. НеМе — простое вещество
- •Углерод (с). Аллотропия углерода (с)
- •Угольная кислота
- •Соли угольной кислоты
- •Аллотропия кремния
- •Соединения кремния (si)
- •Силикатная промышленность
- •Простые вещества, образованные элементами
- •V группы главной подгруппы
- •Азот — простое вещество
- •Получение азота (n2)
- •Синтез аммиака в промышленности
- •Получение аммиака в лаборатории
- •Химические свойства
- •Оксиды азота (n)
- •Азотная кислота
- •Нитраты
- •Аллотропия форфора (р)
- •Химические свойства фосфора (р)
- •Соединения фосфора (р)
- •Фосфорная кислота
- •Элементы VI группы главной подгруппы
- •Простые вещества элементов VI группы главной подгруппы
- •Аллотропия кислорода ("о")
- •Аллотропия серы (s)
- •Соединения серы (s)
- •Кислоты серы (s)
- •Производство
- •Элементы VII группы главной подгруппы (галогены) Сравнительная характеристика химических элементов
- •Простые вещества элементов VII группы главной подгруппы
- •Химические свойства простых веществ на примере
- •Соляная кислота (hCl)
- •Химические свойства соляной кислоты
- •Медь (Cu) — представитель химических элементов побочных подгрупп
- •Железо (Fe) — представитель химических элементов побочных подгрупп
- •Железо (Fe) — простое вещество
- •Химические свойтсва () — восстановитель
- •Соединения железа в степени окисления
- •Производство чугуна
- •Производство стали
- •Способы получения стали
- •Реакции, лежащие в основе производства стали кислородно-конвертерным и мартеновским способами
- •Хром (Cr) — представитель химических элементов побочных подгрупп
- •Хром (Cr) — простое вещество
- •Химические свойства Cro
- •Соединения хрома (Cr)
Нитраты
нитрат
аммония
|
Формула | |
|
кристаллические хорошо растворимы в воде |
Физические свойства | |
|
Характерные свойства
до
Mg
→ MeO
+
после
Cu → Me +
|
Химические свойства | |
|
Качественная реакция
на
O
—O—N O
4Na
2 бурый
|
Аллотропия форфора (р)
|
Белый |
Красный |
Черный |
|
|
|
|
|
Молекулярная |
Атомная |
Атомная |
|
кристаллическая решетка | ||
|
летуч |
нелетуч |
нелетуч |
|
Окисляется на воздухе и светится в темноте 4Р
+ 5 |
Ртв. 4Р
+ 5 не светится в темноте |
4Р
+ 5 не светится в темноте |
|
Мягкое кристаллическое вещество, не растворяется в воде, растворяется в СS2 (сероуглерод) |
Порошок, не растворяется в воде и сероуглероде |
По внешнему виду похож на графит, жирный на ощупь, полупроводник |
|
tпл.=44,2 tкип.=275 |
|
|
|
яд |
неядовит |
неядовит |
|
Рбелый
| ||
|
Круговорот Р в природе
Растения
Животные
Почва | ||
Химические свойства фосфора (р)
|
Р — восстановитель |
Р — окислитель |
|
+3
+5
+3
+5
бертолетова соль
воспламенение |
350
500
фосфин
|
|
Получение Р
белый
t=1500 |
Соединения фосфора (р)
|
+3 |
+5 |
|
оксид фосфора (III) |
оксид фосфора (IV) |
|
белый, кристаллический, ядовитый кислотный оксид |
белый, кристаллический, хорошо впитывает воду, пар — хороший осушитель; кислотный оксид |
|
фосфористая кислота
соли (фосфиты)
|
метафосфорная к-та 2ст.
ортофосфорная кислота ——————————————
соли (фосфаты) |
|
|
|
Фосфорная кислота
ортофосфорная кислота (фосфорная) |
H—O
H—O—P=O H—O | |||||||
|
твердое вещество, хорошо растворима в воде, нелетуча В растворе:
Соли | ||||||||
|
Кислые |
Средние | |||||||
|
|
|
| ||||||
|
хорошо растворяются в воде |
растворимость увеличивается |
хорошо
растворяются в воде соли щелочных
и щелочно-земельных металлов и | ||||||
Продолжение
|
Соли | |||
|
Кислые |
Средние | ||
|
|
|
| |
|
Ca
|
Ca
|
| |
|
2
|
2
Ca
|
| |
|
Качественная
реакция на
| |||
|
| |||


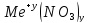


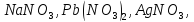

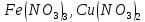 и
т. д.
и
т. д.


 —от
Mg
до Cu
→ MeO
+
—от
Mg
до Cu
→ MeO
+







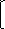




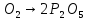



 =1,82
г/см3
=1,82
г/см3

 =2,2
г/см3
=2,2
г/см3 =2,7
г/см3
=2,7
г/см3









 –3
–3 очень трудно
очень трудно

 +
6
+
6
 —газ,
без цвета, с запахом гнилой рыбы.
Ядовит
—газ,
без цвета, с запахом гнилой рыбы.
Ядовит
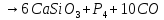




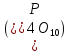


 ,
,





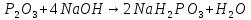

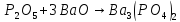




 дигидрофосфат
ион
дигидрофосфат
ион гидрофосфат
ион
гидрофосфат
ион фосфат
ион
фосфат
ион —кислота
средней силы
—кислота
средней силы











 N
N





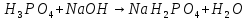




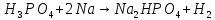
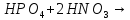
 Ca
Ca

 +
+





 желтый
желтый