
- •Неорганическая химия наука о природе
- •Природные явления
- •Чистые вещества и смеси
- •Химический элемент
- •Химический символ обозначает
- •Химический состав
- •Химическая формула и расчет по формулам
- •Схемы строения атомов химических элементов побочных подгрупп
- •Периодичность изменения химических и физических свойств элементов главных подгрупп
- •Валентность
- •Составление химических формул по валентности
- •Электроотрицательность
- •Относительная электроотрицательность химических элементов
- •Степень окисления
- •Химическая связь
- •Типы кристаллических решеток
- •Взаимосвязь основных химических понятий
- •Свойства и применение кислорода
- •Классификация сложных неорганических веществ
- •Генетические связи между классами неорганических веществ
- •Классификация кислот
- •Номенклатура кислот и средних солей
- •Химические свойства сложных неорганичеких веществ
- •Примеры уравнений химических реакций
- •Химические свойства воды ()
- •Очистка воды
- •Растворы
- •Растворимость веществ
- •Количество растворенного вещества
- •Концентрации растворов
- •Химические реакции классификация химических реакций
- •Окислительно-восстановительные реакции
- •Составление уравнений окислительно-восстановительных реакций методом электронного баланса
- •Форма записи о.В.Р.
- •Гидролиз солей количественные соотношения при химических реакциях
- •2. Кислоты, основания, амфотерные
- •3. Реакции ионного обмена
- •Металлы
- •1. Ме — химический элемент
- •2. Ме — простое вещество
- •3. Химические свойства металлов
- •Промышленные способы получения металлов
- •Электрохимический ряд напряжений металлов
- •Электролиз
- •Применение электролиза
- •Металлы I группы главной подгруппы (щелочные) Сравнительная характеристика химических элементов
- •Сравнительная характеристика физических свойств простых веществ
- •Металлы II группы главной подгруппы (щелочно-земельные) Сравнительная характеристика химических элементов
- •Сравнительная характеристика физических свойств простых веществ
- •Характер соединений оксидов ме
- •II группы главной подгруппы
- •Жесткость воды
- •Элементы III группы главной подгруппы Сравнительная характеристика химических элементов
- •Сравнительная характеристика физических свойств простых веществ
- •Неметаллы
- •1. НеМе—химический элемент
- •2. НеМе — простое вещество
- •Углерод (с). Аллотропия углерода (с)
- •Угольная кислота
- •Соли угольной кислоты
- •Аллотропия кремния
- •Соединения кремния (si)
- •Силикатная промышленность
- •Простые вещества, образованные элементами
- •V группы главной подгруппы
- •Азот — простое вещество
- •Получение азота (n2)
- •Синтез аммиака в промышленности
- •Получение аммиака в лаборатории
- •Химические свойства
- •Оксиды азота (n)
- •Азотная кислота
- •Нитраты
- •Аллотропия форфора (р)
- •Химические свойства фосфора (р)
- •Соединения фосфора (р)
- •Фосфорная кислота
- •Элементы VI группы главной подгруппы
- •Простые вещества элементов VI группы главной подгруппы
- •Аллотропия кислорода ("о")
- •Аллотропия серы (s)
- •Соединения серы (s)
- •Кислоты серы (s)
- •Производство
- •Элементы VII группы главной подгруппы (галогены) Сравнительная характеристика химических элементов
- •Простые вещества элементов VII группы главной подгруппы
- •Химические свойства простых веществ на примере
- •Соляная кислота (hCl)
- •Химические свойства соляной кислоты
- •Медь (Cu) — представитель химических элементов побочных подгрупп
- •Железо (Fe) — представитель химических элементов побочных подгрупп
- •Железо (Fe) — простое вещество
- •Химические свойтсва () — восстановитель
- •Соединения железа в степени окисления
- •Производство чугуна
- •Производство стали
- •Способы получения стали
- •Реакции, лежащие в основе производства стали кислородно-конвертерным и мартеновским способами
- •Хром (Cr) — представитель химических элементов побочных подгрупп
- •Хром (Cr) — простое вещество
- •Химические свойства Cro
- •Соединения хрома (Cr)
Элементы VI группы главной подгруппы
Сравнительная характеристика химических элементов
|
Символ химического элемента |
Принадлежность к классу |
Распространение в природе, % |
Основные соединения |
Валентные
|
R ат. |
Хим. активность |
Образование хим. связей |
Степень окисления |
Дата открытия, получения | ||||||
|
O |
неметаллы |
52,3 |
входит
в состав
оксидов, гидроксидов, солей |
2s22p4 |
увеличивается |
← |
увеличиваются неметаллические свойства, электроотрицательнось |
→ |
ковалентная |
–2,
–1 0, +2 |
1772 г. | ||||
|
S |
0,03 |
HgS — киноварь FeS2 — пирит FeCuS2 — халькопирит |
3s23p4 |
–2,
–1 0,
+2, +4,
+6 |
известен в древности | ||||||||||
|
Se |
|
рассеянные
элементы примеси к природным
соединениям Ag,
Cu,
Pb,
S
и др. |
4s24p4 |
–2, 0, +2, +4, +6 |
1817 г. | ||||||||||
|
Te |
|
5s25p4 |
–2, 0, +2, +4, +6 |
1798 г. | |||||||||||
|
Po |
продукт радиоактивного распада |
|
—— |
6s26p4 |
–2, +2, +4 |
1898 г. | |||||||||
Простые вещества элементов VI группы главной подгруппы
|
Формула простого вещества |
Связь |
Кристаллическая решетка |
Свойства |
Химическая активность |
Тпл., |
Ткип., |
г/см3
| |
|
|
ковалентная |
молекулярная |
газ, тяжелее воздуха, без цвета, без запаха, мало растворим в воде. В жидком состоянии — голубой |
увеличиваются неметаллические свойства, сродство к электрону |
→ |
–218,8 |
–183 |
жидк. 1,429 |
|
S |
несколько модификаций, желтое хрупкое вещество, плохо проводит тепло и электричество
|
112,8 |
444,6 |
2,07 (ромб.) | ||||
|
Se |
серое твердое вещество |
220,5 |
657,0 |
4,82 | ||||
|
Te |
серебристо-белое твердое вещество |
452,5 |
1012,0 |
6,24 | ||||
|
Po |
серебристо-белое твердое вещество |
254,0 |
962,0 |
9,3 | ||||
Аллотропия кислорода ("о")
|
|
|
|
|
Молекула |
|
|
|
В природе |
В воздухе — 21% по V 23% по m в воде — 88,89% по m в
Si в человеческом организме — 65% по m |
В стратосфере — озоновый экран |
|
Физические свойства |
жидкий и твердый, голубого цвета, обладает магнитными свойствами, плохо растворяется в воде |
газ — бесцветный жидкий — синий твердый — черный хорошо
растворяется в
|
|
100V
| ||
|
|
| |
|
Получение |
В лаборатории:
(получен в 1774 г. Пристли)
Mn
2KMn
В промышленности:
|
Получен в 1840 г.
разрядах
в озонаторах ————————————
3
3Ba (перекись (конц.) Ва)
|
Продолжение
|
Химические свойства |
|
сильный,
чем |
|
С
+
S
+
4P
+ 5 2Mg
+
2Na
+
C 2 2Fe |
(искл. Au, Pt)
N | |
|
| ||
|
+2 –
|


 ,
,












 ,
,
 —кислород
—кислород —озон
—озон
 — 53% по m
— 53% по m
 : 5V
: 5V
 ← при 0
← при 0 → 100V
→ 100V
 : 45V
: 45V





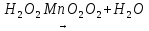



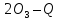


 —окислитель
—окислитель —окислитель
(более
—окислитель
(более 


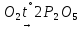











 —восстановитель
—восстановитель —фторид
О
—фторид
О