
- •Неорганическая химия наука о природе
- •Природные явления
- •Чистые вещества и смеси
- •Химический элемент
- •Химический символ обозначает
- •Химический состав
- •Химическая формула и расчет по формулам
- •Схемы строения атомов химических элементов побочных подгрупп
- •Периодичность изменения химических и физических свойств элементов главных подгрупп
- •Валентность
- •Составление химических формул по валентности
- •Электроотрицательность
- •Относительная электроотрицательность химических элементов
- •Степень окисления
- •Химическая связь
- •Типы кристаллических решеток
- •Взаимосвязь основных химических понятий
- •Свойства и применение кислорода
- •Классификация сложных неорганических веществ
- •Генетические связи между классами неорганических веществ
- •Классификация кислот
- •Номенклатура кислот и средних солей
- •Химические свойства сложных неорганичеких веществ
- •Примеры уравнений химических реакций
- •Химические свойства воды ()
- •Очистка воды
- •Растворы
- •Растворимость веществ
- •Количество растворенного вещества
- •Концентрации растворов
- •Химические реакции классификация химических реакций
- •Окислительно-восстановительные реакции
- •Составление уравнений окислительно-восстановительных реакций методом электронного баланса
- •Форма записи о.В.Р.
- •Гидролиз солей количественные соотношения при химических реакциях
- •2. Кислоты, основания, амфотерные
- •3. Реакции ионного обмена
- •Металлы
- •1. Ме — химический элемент
- •2. Ме — простое вещество
- •3. Химические свойства металлов
- •Промышленные способы получения металлов
- •Электрохимический ряд напряжений металлов
- •Электролиз
- •Применение электролиза
- •Металлы I группы главной подгруппы (щелочные) Сравнительная характеристика химических элементов
- •Сравнительная характеристика физических свойств простых веществ
- •Металлы II группы главной подгруппы (щелочно-земельные) Сравнительная характеристика химических элементов
- •Сравнительная характеристика физических свойств простых веществ
- •Характер соединений оксидов ме
- •II группы главной подгруппы
- •Жесткость воды
- •Элементы III группы главной подгруппы Сравнительная характеристика химических элементов
- •Сравнительная характеристика физических свойств простых веществ
- •Неметаллы
- •1. НеМе—химический элемент
- •2. НеМе — простое вещество
- •Углерод (с). Аллотропия углерода (с)
- •Угольная кислота
- •Соли угольной кислоты
- •Аллотропия кремния
- •Соединения кремния (si)
- •Силикатная промышленность
- •Простые вещества, образованные элементами
- •V группы главной подгруппы
- •Азот — простое вещество
- •Получение азота (n2)
- •Синтез аммиака в промышленности
- •Получение аммиака в лаборатории
- •Химические свойства
- •Оксиды азота (n)
- •Азотная кислота
- •Нитраты
- •Аллотропия форфора (р)
- •Химические свойства фосфора (р)
- •Соединения фосфора (р)
- •Фосфорная кислота
- •Элементы VI группы главной подгруппы
- •Простые вещества элементов VI группы главной подгруппы
- •Аллотропия кислорода ("о")
- •Аллотропия серы (s)
- •Соединения серы (s)
- •Кислоты серы (s)
- •Производство
- •Элементы VII группы главной подгруппы (галогены) Сравнительная характеристика химических элементов
- •Простые вещества элементов VII группы главной подгруппы
- •Химические свойства простых веществ на примере
- •Соляная кислота (hCl)
- •Химические свойства соляной кислоты
- •Медь (Cu) — представитель химических элементов побочных подгрупп
- •Железо (Fe) — представитель химических элементов побочных подгрупп
- •Железо (Fe) — простое вещество
- •Химические свойтсва () — восстановитель
- •Соединения железа в степени окисления
- •Производство чугуна
- •Производство стали
- •Способы получения стали
- •Реакции, лежащие в основе производства стали кислородно-конвертерным и мартеновским способами
- •Хром (Cr) — представитель химических элементов побочных подгрупп
- •Хром (Cr) — простое вещество
- •Химические свойства Cro
- •Соединения хрома (Cr)
Простые вещества элементов VII группы главной подгруппы
|
Формула простого вещества |
Связь |
Кристаллическая решетка |
Агрегатное состояние |
Цвет |
Свойства |
Химическая активность |
Тпл., |
Ткип., |
г/см3
| |
|
F2 |
ковалентная |
молекулярная |
газ |
светло-зеленый |
разлагает воду |
увеличивается |
→ |
–219,6 |
–188,1 |
|
|
Cl2 |
газ |
желто-зеленый |
растворяются
в
резкий запах, ядовитв |
–101,0 |
–34,1 |
| ||||
|
Br2 |
жидкость |
красно-бурый |
–7,25 |
–59,2 |
3,102 | |||||
|
J2 |
кристаллы |
темно-фиолетовый |
113,6 |
185,5 |
4,940 | |||||
Химические свойства простых веществ на примере
|
Формула |
Cl—Cl
структурная |
формула |
электронная |
|
Химические свойства
|
С простыми веществами 2Na+
+4 – +2 –
| ||
|
Со сложными веществами
3
Br
+ 2KЭ | |||
Соляная кислота (hCl)
|
40%–ная
HCl —
Концентрированная HCl — бесцветный раствор, с резким запахом, во влажном воздух — "дымит".
В
растворе: HCl
Получение | |
|
В промышленности |
В лаборатории |
|
|
|
Химические свойства соляной кислоты
|
Свойства, общие с другими кислотами |
Особые свойства |
лакмус — краснеет метиловый-оранжевый — розовеет +y
(до
2HCl
+ Zn → Zn хлорид
основной
2HCl
+ ZnO → Zn
|
– +5
окислитель
(Mn – o
белый, не растворяется в воде, не
растворяется в
|
|
Соли | |
|
хлориды, гидролизу по аниону кислотного остатка не подвергаются |
Медь (Cu) — представитель химических элементов побочных подгрупп
|
Содержание в земной коре, % |
Основные природные соединения |
№ химического элемента |
Z ядра |
Ar |
Электронная формула |
Схема распределения
|
Степень окисления |
|
0,01 |
(медный колчедан)
CuS — ковеллин
|
29 |
+29 |
63,546 |
1s22s22p63s23p63d104s1 |
|
+2 более уст. +1 0 |
Медь (Cu) — простое вещество
|
Цвет |
Связь |
Кристал. решетка |
Свойства |
г/см3 |
Тпл., |
Ткип., | ||||
|
розоватый |
металлическая |
электро-, теплопроводна, мягкая, пластичная, ковкая |
8,96 |
1084,5 |
2880 | |||||
ХИМИЧЕСКИЕ
СВОЙТСВА

Медь
( )
— малоактивный металл, восстановитель
)
— малоактивный металл, восстановитель
|
Взаимодействие с простыми веществами |
+ |
2Cu
+
2Cu
+
на воздухе серо-зеленая пленка | ||
|
+не Ме |
+ |
Сu
+ | ||
|
+S |
2Cu
+ S
| |||
|
Взаимодействие со сложными веществами |
+ |
————— | ||
|
+ разб. |
+HN |
3Cu
+ 8HN | ||
|
+ конц. |
+ |
Cu
+ 2 | ||
СОЕДИНЕНИЯ МЕДИ В СТЕПЕНИ ОКИСЛЕНИЯ
|
+1 |
+2 | |||
|
Оксиды |
формула |
|
CuO
— черный | |
|
получение |
2
|
2Cu
+
| ||
|
характер |
основной |
амфотерный с преобладанием основных свойств | ||
|
+ |
не растворяется
присоединение |
——————— | ||
|
+ |
|
CuO
+ 2 | ||
|
+ |
|
CuO
+ 2NaOH +
| ||
|
Гидроксиды |
формула |
CuOH
↓ |
| |
|
получение |
|
| ||
|
характер |
основной |
амфотерный, но основные свойства выражены сильнее | ||
|
+ |
CuOH
+ HCl → CuCl +
|
| ||
|
+ |
————— |
очень конц. купрат Na (не уст.) | ||
Продолжение
|
Соли |
+ |
|
|
|
окислительно-восстановительные процессы |
восстановительные свойства
+ о CuCl
+
+2 –2
|
окислительные свойтва
+2 – 2CuS о +
| |
|
|
неустойчивые 2CuJ
→ Cu + Cu |
устойчивые CuS белый голубой | |
|
+соль |
|
| |
|
+Ме |
|
| |
|
+ |
|
CuS
+ 2 | |
|
качественная реакция |
CuOH
→
желтый осадок красный |
| |









 —сильные
окислители
—сильные
окислители хлорид Na
хлорид Na хлороводород
хлороводород
 —исключения
—исключения хлорноватистая
кислота
хлорноватистая
кислота —исключение
—исключение

 —Э=Cl,
Br, J
—Э=Cl,
Br, J —Э=Br,
J
—Э=Br,
J —Э=J
—Э=J =1,19
г/см3
=1,19
г/см3 сильная кислота
сильная кислота
 )
)







 ,
KMn
,
KMn )
)



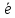
 —халькопирит
—халькопирит
 —халькозин
—халькозин —куприт
—куприт —малахит
—малахит ,
,
















 —красный
—красный


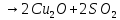











 ↓голубой
↓голубой

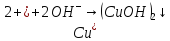




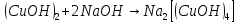








 б/водный CuS
б/водный CuS





 голубой
осадок
голубой
осадок