
- •2. Производные моносахаридов, образующиеся в организме (фосфорные эфиры, уроновые кислоты, аминосахара), их биологическое значение.
- •3. Биосинтез хс. Схема процесса. Атеросклероз и связь нарушений метаболизма хс и липопротеинов.
- •4.Минеральные вещества крови (Са, р, Na, k, Fe). Участие в обмене.
- •1. Основные этапы биосинтеза белка. Роль нуклеиновых кислот, активация амк, рабочий цикл рибосомы.
- •2. Гетерополисахариды (классы гликозаминокликанов). Строение, распространение в организме. Биологическая роль.
- •3.Структура ферментов. Активный центр. Механизм обр-ия фермент-субстратного комплекса. Аллостерические участки, их биороль.
- •4. Состав молока и роль в питании растущего ор-ма. Сравнительная оценка состава коровьего и женского молока. Преимущества естественного вскармливания.
- •1. Свойства и биолоическая роль белков. Белки как гидрофильные коллоиды. Реакция осаждения белков, использование реакций осаждения в мед.Практике. Методы очистки и разделения белков.
- •2. Переваривание и всасывание у в жкт. Возрастные особенности. Судьба всосавшихся моносахаридов.
- •3. Понятие об энергии активации. Образование фs-комплекса. Принципы количественного определения активности ф. Единицы активности.
- •4.Содержание и формы билирубина в крови. Диагностическое значение форм билирубина.
- •1. Белки как амфотерные электролиты. Механизм образования заряда. Изоэлектрическая точка белка. Св-ва б в ит.
- •2. Биосинтез и мобилизация гликогена, последовательность реакций. Биол.Роль. Регуляция активности фосфорилазы и гликогенсинтетазы.
- •3.Основные сведения о кинетике ферментативных реакций. Факторы влияющие на скорость р-ий.
- •4. Содержание глюкозы в крови. Возрастные особенности.
- •1.Гидролиз белков. Методы, условия, продукты гидролиза. Определение степени гидролиза. Использование гидролизатов в медицине.
- •2. Анаэробный распад глюкозы. Последовательность р-ий, локализация. Биологическая роль.
- •3. Стероидные гормоны, представители. Механизм действия. Особенности биосинтеза стероидных гормонов.
- •4. Содержание белков в плазме крови, возрастные особенности.
- •2. Роль анаэробного и аэробного распада глюкозы в мышцах. Судьба молочной кислоты.
- •3. Кофакторы и их связь с витаминами. Типичные примеры.
- •4. Содержание остаточного азота в крови. Компоненты остаточного азота.
- •1. Белки. Классификация б. Характеристика сложных б. Хромопотеины, классификация, строение, распространение.
- •2. Аэробное окисление у, схема процесса. Образование пвк из глю, последовательность р-ий. Челночный механизм транспорта водорода.
- •3. Регуляция активности ф. Аллостерические механизмы, ограниченный протеолиз, хим.Модифиация ферментов. Биологическая роль регуляции активности ф.
- •4. Возврастные особенности состава крови (белки, остаточный азот, глюкоза).
- •1. Нуклеопротеины. Современные представления о структуре и функциях нуклеиновых кислот. Продукты их гидролиза.
- •2. Окислительное декарбоксилирование пвк. Последовательность реакций, связь с дыхательной цепью.
- •3. Активаторы и ингибиторы ферментов. Типы ингибирования. Применение ингибиторов в качестве лекарственных средств.
- •4. Минеральные вещества крови. Распределение между плазмой и эритроцитами.
- •1. Днк. Первичная, вторичная и третичная структуры. Биологическая роль днк.
- •2. Цикл трикарбоновых кислот, последовательность реакций, связь с дыхательной цепью. Биологическое значение.
- •3. Классификация ферментов. Важнейшие представители основных классов.
- •4. Содержание Са и р в плазме крови.
- •1. Рнк. Первичная и вторичная структура. Типы рнк, особенности строения, локализация в клетке. Биологическая роль.
- •2. Строение коэнзима а, участие в обмене веществ.
- •3. Энергетический обмен. Стадии катаболизма б, л, у. Источники восстановительных эквивалентов для электрон-транспортной цепи. Роль митохондрий в окислении водорода.
- •4. Изменение содержания белков, остаточного азота, глюкозы при заболеваниях.
- •1. Гликопротеины. Их строение, классификация, представители. Биологическая роль.
- •2. Пентозофосфатный путь окисления глюкозы, основные этапы процесса. Биологическое значение цикла. Наследственные нарушения.
- •3. Митохондриальная цепь окисления кислорода. Образование электрохимического трансмембранного потенциала, его использование.
- •4. Анализ желудочного сока.
- •1. Липопротеины. Их строение, классификация. Состав и функции липопротеинов крови.
- •2. Роль печени в обмене углеводов. Глюконеогенез, субстраты для синтеза, схема реакций.
- •3. Тканевое дыхание, последовательность реакций. Продукция энергии в дыхательной цепи.
- •4. Формы кислотности желудочного сока.
- •1. Хромопротеины, их строение, биологическая роль. Основные представители хромопротеинов.
- •2. Поддержание постоянства глюкозы в крови. Источники и пути расходования глюкозы в крови. Гипо- и гипергликемия, причины их возникновения.
- •3. Надн-оксидазная система: надн-зависимые дегидрогеназы, флавиновые дг, железосеоцентры. Строение, их роль в транспорте электронов.
- •4. Возрастные особенности желуд сока.
- •1. Заменимые и незаменимые амк. Потребность ор-ма в б в зависимости от возраста. Белковый минимум. Формы баланса азота в организме. Возрастные особенности.
- •2. Биосинтез глюкозы (глюконеогенез). Возможные предшественники, последовательность реакций. Глюкозолактатный цикл (цикл Кори). Физиологическое значение.
- •3. Цикл кислорода дыхательной цепи. Цитохромоксидаза, строение, биологическая роль.
- •4.Физико-химические показатели мочи. Возрастные особенности.
- •1. Переваривание белков в жкт. Промежуточные и конечные продукты гидролиза белков. Использование амк в тканях.
- •2. Сахарный диабет. Характер нарушений обменных процессов при сах.Диабете. Нарушение уранатного пути использования глюкозы как основа нарушений структуры гликозаминогликанов.
- •3. Образование макроэргических соединений в цепи тканевого дыхания. Характеристика процесса с помощью коэффициента р/о. Разобщение окисления и фосфорилирования в дых.Цепи.
- •4. РН мочи в норме и при патологии.
- •1. Процессы превращения аминокислот в толстом кишечнике под влиянием гнилостных бактерий. Обзвреживание проуктов гниения.
- •2. Наследственные нарушения обмена моносахаридов и дисахаридов: галактоземия, фруктоземия, непереносимость дисахаридов. Гликоген- и агликогенозы
- •3. Окислительное и субстратное фосфорилирование в процессе биологического окисления.
- •4. Пигменты мочи и их происхождение.
- •2. Современные данные об активных формах углеводов, жирных кислот и аминокислот.
- •3. Надн – оксидазная система: убихинон, цитохромы. Строение, их роль в транспорте электронов
- •4.Органические вещества мочи, их происхождение.
- •1. Роль нуклеиновых кислот в биосинтезе белка. Характеристика генетического кода. Строение и роль т-рнк.
- •2.Взаимосвязь белкового, углеводного и липидного обменов. Роль ключевых метаболитов глюкозо-6-фосфатов, пировинограной кислоты и ацетил-КоА.
- •3. Образование со2 в процессах биологического окисления. Типы декарбоксилирования в цтк.
- •4. Азотсодержащие вещества мочи. Возрастные особенности.
- •1.Основные этапы биосинтеза белков (активация амк, фазы трансляции, участие рибосом).
- •2. Липиды, классификация и распространение. Химическая природа, свойства и биол.Роль триацилглицеридов.
- •3. Микросомальное и митохондриальное окисление. Сходства и различия. Пути использования кислорода. Токсичность кислорода. Механизмы защиты.
- •4. Содержание мочевой кислоты в крови. Причины гиперурикемии.
- •1.Современные представления о регуляции биосинтеза белка. Регуляция действия генов. Строение и функционирование лактозного оперона. Индукция и репрессия синтеза белков в организме человека.
- •2.Классификация глицеролипидов, хим строение и биологическая роль в организме
- •3. Витамины и их значение в жизнедеятельности человека. Классификация. Участие в обмене веществ.
- •4. Индикан мочи,значение исследования.
- •1.Процессы образования конечных продуктов обмена простых белков. Основные источники аммиака. Роль глутамина в оезвреживании аммиака и синтезе ряда соединений(как донор амидной группы).
- •2.Депонирование и мобилизация жиров в жировой ткани, физиологическое значение. Транспорт и использование жрных кислот, образующихся при мобилизации жиров. Биосинтез и использование кетоновых тел.
- •3.Витамин рр. Химическая природа. Растпространение, участие в обменных процессах.
- •4.Способы определения белка в моче.
- •1. Распад пуриновых и пиримидиновых азотистых оснований. Конечные продукты. Пути выведения.
- •2. Желчные кислоты, строение. Свойства. Участие в переваривании и всасывании липидов. Конъюгация желчных кислот, биологическая роль.
- •Транспорт
3.Основные сведения о кинетике ферментативных реакций. Факторы влияющие на скорость р-ий.
Кинетика – раздел энзимологии, кот занимается изучением различных факторов на активность Ф.
1 ФАКТОР. Влияние концентр S на скорость р-ии.
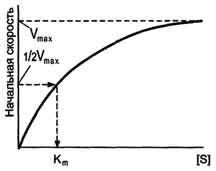 V
= Vmax[S] / Km + [S] – уравнение
Михаэлиса-Ментена-з.действ.масс
V
= Vmax[S] / Km + [S] – уравнение
Михаэлиса-Ментена-з.действ.масс
Km – константа Михаэлиса – величина, численно равная конц.S, при кот скорость реакции равна половине скорости мах, она показывает на сколько велико сродство между Ф и S. Чем бол Km, тем меньше сродство. Km=10-2-10-5моль
А)если S >> Km, то V = Vmax
Б)если S << Km, то V = Vmax[S]/Km, т.е. в данном случае скорость реакции прямо пропорциональна
В)если равны, то скорость равна половине скорости мах.
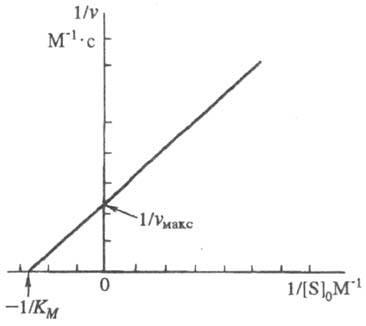
Для точного определения Vmax и Km было предложено уравнение Лайнуивера- Берка:
1/V= (Km/Vmax * 1/S) + 1/ Vmax
2 ФАКТОР. Зависимость от концентрации Ф. Чем больше конц.Ф, тем выше скорость – прямопропорциональная зависимость
3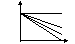 ФАКТОР. Влияние температуры на скорость
хим.р-ии
ФАКТОР. Влияние температуры на скорость
хим.р-ии
С
К
О
Р
30 –опримум, 40,50, 60- денатурация
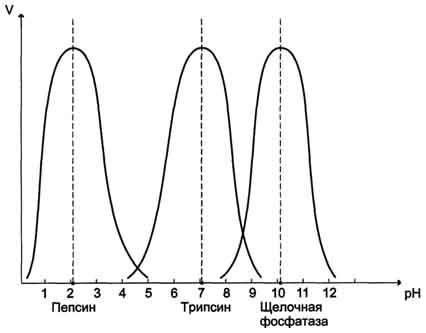
4 ФАКТОР. Зависимость от рН Ф.
5 ФАКТОР. Влияние ингибиторов. Ингибирование: обратимое (если после удаления ингибитра Ф восст.) и необратимое.
Виды необратимого: -специфическое (действие цианидов на цитохромоксидазу), -неспецифическое(ведет к денатурации Ф, соли тяж.Ме, радиация,УФ)
Виды обратимого: -конкурентное –ингибитор по своей структуре похож на S, поэтому может взаимодействовать с акт.центром Ф, но при повышении концен.S, происходит вытеснение ингибитора из акт.центра, и скорость восстанавливается(сульфаниловые лекарства).

-неконкурентное – ингибитор не похож на субстрат, поэтому взаимодействует не с акт.центром, а с др.участком или с акт.центром, но не прочно.
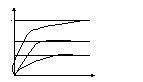 Vmax
без ингиб >> Vmax
с ингибитором
Vmax
без ингиб >> Vmax
с ингибитором
4. Содержание глюкозы в крови. Возрастные особенности.
Норма взрослого человека – 3,5-5,5 ммоль/л, если больше 11 ммоль/л, то сахар появляется в моче. Если меньше 3,3 ммоль/л – гипогликемия, больше 6 ммоль/л – гипергликемия. Недоношенные - 1,1-3,33, новорожденные - 2,22-3,33, 1 месяц – 2,7-4,44, 7 лет – 3,33-5,55, до 60 лет – 4,44-6,38, старше 60 – 4,61-6,10.
Билет
№5
1.Гидролиз белков. Методы, условия, продукты гидролиза. Определение степени гидролиза. Использование гидролизатов в медицине.
Гидролиз – расщепление пептидной связи при участии молекулы воды (вода отдает функциональные группы Н и ОН для восстановления пептидной связи).
Различают ферментативный, химический, полный и неполный гидролиз. Гидролиз протекает постепенно: белок – полипептид – олигопептид – дипептид – АМК. Его можно остановить на любой стадии, изменив оно из условий гиролиза.
Ферментативный гидролиз in vivo –пищеварение, для проведения его in vitro осн.усл являются: 1)набор очищенных кристаллических Ф, потому что Ф высоко специфичны; 2) t=37; 3)небольшое кол-во Ф по отношению к Б; 4) процесс длительный (неск.суток). Недостатки: зарастание микрофлорой и выделение токсических продуктов.
Химический гидролиз. Условия: 1)концентрированные щелочи и к-ты (25-30% 5-12н); 2) объем к-т, щелочи в 5-10 раз больше объема Б; 3) Время гиролиза от 10 до 96 ч; 4) t=100-110. Недостатки: при щел.гидролизе происходит рацетизация АМК, т.е. они переходят из L-ряда в D-ряд и живыми ор-мами не усваиваются; при кисл.гидролизе разрушается ряд АМК (триптофан, цистеин).
Оценка глубины гидролиза: 1.Качественные методы. Биуретовая р-ия (на пептидные связи), осадочные р-ии с ТХУ, НNO3, сульфосалициловой кислотой; р-ия с нингидрином (положение свободных NH2).
2. Количественные. Основаны на р-ии АМК с формальдегидом, на определении аминного азота – это азот, вход.в аминогруппы, наход.в α-положении.
В негидролизированном белке отношение аминного азота к общему составляет 1-10%, в неполном гидролизате – 10-75%, в полном – 70-90%.
Использование гиролизатов в меицине: 1)для изучения первичной структуры Б; 2)для парентерального питания; 3)в качестве кровезаменителя.
