- •Научно-исследовательский институт цитохимии и молекулярной фармакологии
- •Глава 1. Описание движения ионов в биологических компартментах с использованием различных математических моделей
- •1.1. Применение решений краевых задач для уравнения диффузии в целях описания пространственно временных градиентов незаряженных химических соединений в биологических компартментах
- •1.2. Расширение диффузионного подхода при описании пространственных потоков для случая движения заряженных частиц
- •1.3. Рассмотрение слу,чая малого компартмента и описание движения совокупности молекул с использованием уравнений молекулярной динамики.
- •1.4. Кинетический подход к моделированию переноса заряженных частиц через биологические мембраны
- •Глава 2. Построение физической модели движения заряженных частиц в ограниченном пространстве вблизи поверхности мембраны
- •2.1. Описание физико-химических свойств моделируемой системы с учетом используемых предположений и допущений
- •2.2. Формулировка задачи Коши для системы уравнений Ланжевена и ее пошаговое решение
- •2.3. Возможные варианты распределения плотности фиксированных зарядов в рассматриваемой системе и их влияние на динамику движения ионов
- •Глава 3. Разработка алгоритма описания движения ионов в рассматриваемом примембранном пространстве на основе решения уравнений Ланжевена
- •3.1. Последовательное пошаговое построение траектории перемещения частиц в рассматриваемом компартменте
- •3.2. Формулировка правил описания трансмембранного ионного тока в рамках предложенной модели
- •3.3. Методика проведения компьютерного эксперимента с использованием предложенного оптимизированного алгоритма
- •3.4. Принцип получения вольтамперной характеристики ионного белкового канала, на основе используемого в работе подхода
- •3.5. Моделирование открытия ионного канала рецептора под действием связывания лиганда с использованием вероятностного подхода
- •Глава 4. Формализация предложенного алгоритма в виде независимого программного обеспечения для пк
- •4.1. Создание программного продукта на базе предложенного в работе алгоритма с использованием объектно-ориентированной среды разработки Delphi
- •Выбор параметров мембраныСоздание массива ионов
- •Создание массива неподвижных зарядов
- •4.2. Описание интерфейса программного пакета и локализация основных параметров модели
- •Глава 5. Приложение разработанного подхода к описанию реальных мембранных белковых каналов
- •5.1. Случай неселективной мембранной поры заданного диаметра, в незаряженной мембране, разделяющей два компартмента с фиксированным градиентом ионов
- •5.3. Моделирование трансмебранных хлорных токов, возникающих при открытии ионного канала глицинового рецептора
5.3. Моделирование трансмебранных хлорных токов, возникающих при открытии ионного канала глицинового рецептора
Глициновый рецептор представляет собой интегральный мембранный белок, содержащий трансмембранную СГ - селективную пору. Он принадлежит к первому подсемейству лиганд-зависимых ионных каналов. Механизм работы GlyR, как и у большинства лиганд-зависимых рецепторов, состоит в увеличении проводимости мембраны в ответ на связывание агониста с рецептором. С присоединением нейротрансмиттера белок открывает селективную ионную пору через мембрану, позволяя пассивное движение малых ионов по электрохимическому градиенту. Подобный ионный поток изменяет мембранный потенциал и в свою очередь воздействует на активность потенциал-зависимых каналов и электрическую проводимость клетки. Первоначально очищенный GlyR был получен из спинного мозга крысы с помощью аффинной хроматографии на аминострихнинагарозных колонках [50,51]. В результате анализа структуры рецептора были идентифицированы субъединицы 48 кДа (al) и 58 кДа (Р) [52,53]. Было показано, что in vivo рецептор содержит в себе пять субъединиц, которые расположены псевдосимметрично вокруг селективной ионной поры, в стехиометрическом соотношении (За:2Р) [54]. Примечательно, что упомянутые субъединицы имеют сходную мембранную топологию. В составе субъединиц присутствует большой М^-концевой внеклеточный домен, содержащий две консервативные цистеиновые петли, одна из которых включает в себя специфичный глицин-связывающий участок [55]. Кроме того, каждая субъединица содержит в себе четыре a-спиральных трансмембранных домена (М1-М4) (Рис. 23) [56].
В глициновых рецепторах из нейронов спинного мозга последовательность проницаемостей моновалентных анионов выглядит следующим образом:
Г>Вг>СГЖ
Данная последовательность выстроена пропорционально энергии гидратных оболочек ионов [63]. Для различных типов ауЛ возможно небольшое изменение геометрии ионной поры. Так, например, диаметр узкого центрального района ионной поры различается в зависимости от типа клеток [64]:
5.2 А — ауЯ из нейронов спинного мозга
5.5-^-6.0 А - ауК. из нейронов гиппокампа
5.22 -г 5.45 А - рекомбинантные 01уЯ
В отличие от анионселективных рецепторов типа 01уЯ, катионселективные рецепторы того же подсемейства ЬС1С имеют поры более высокого диаметра. Минимальный размер поры рецепторов этого типа составляет 7.6 А [65].
Важнейшим компонентом мембранных каналов является воротный механизм. Он представляет собой особый компонент белковой структуры, который посредством конформационного изменения позволяет ионам проникать через канал в случае присоединения агониста, и блокирует прохождение в случае его отсутствия. На данный момент не существует точной информации о том, какие из структур в канале (г/уЯ несут функцию воротного механизма. Тем не менее, в отношении их природы были выдвинуты две гипотезы. Согласно одной из них, основанной на структурном анализе, трансмембранный домен ТМ2, в случае конформационного изменения, связанного с присоединением агониста, изгибается и закрывает пору в районе Ь9' (Рис. 26) [66,67]
.
0.4
0.3
-
0.2
-
♦ І+
■
I-
Рис.
28. Зависимость ионного тока через канал
глицинового рецептора от концентрации
ионов во внешнем компартменте в
отсутствие заряженных аминокислотных
остатков.
о
0.1
0.0
С,
мМи>
I, ПААмплитуда анионного тока возрастает как по сравнению с катионным, так и в сравнении с анионным током через простую неселективную пору. При концентрации в 5 мМ ток ионов СГ составляет 0.3 пА и линейно возрастает до значения 3.1 пА при концентрации 120 мМ. Следовательно, при физиологическом градиенте концентраций 120 мМ / 5 мМ проводимость канала с заряженными кольцами превышает проводимость поры с аналогичной геометрией на порядок. Таким образом, наличие заряженных аминокислотных остатков в структуре канала не только обеспечивает избирательность по заряду иона, но и многократно увеличивает ток. В связи с тем, что заряженные аминокислотные остатки, находящиеся внутри канала,-являются основной системой повышающей, проводимость канала и обеспечивающей его ионоселективность, необходимо оценить, каким образом их положение может влиять на значения трансмембранных токов. В общем случае факторов, оказывающих влияние на токи, можно выделить три:
Удаленность кольца заряженных остатков от края мембраны'
Изменение диаметра кольца
Симметричность и количество остатков в кольце
Для исследования того, насколько удаленность колец заряженных остатков от края мембраны влияет на проводимость канала, их положение менялось по оси канала от 0 А, что соответствует расположению на границе канала, до 35 А. В качестве геометрии канала были выбраны цилиндрические поры диаметров 10 А (Рис. 30) и 6 А (Рис. 31) соответственно. Концентрация ионов во внешнем и внутреннем компартментах составляла 120 мМ и 5 мМ: В случае «широкого» канала наблюдается линейное падение тока с ростом удаленности колец от края канала с 1.2 пА на границе до 0.38 пА в центре. Для «узких» каналов наблюдается более резкий спад с 2 пА до 0.2 пА.
В настоящее время экспериментальное описание токовых характеристик канальных рецепторов основано на использовании методики Patch-Clamp. В связи с особенностью данного метода, на данный момент снятие концентрационных зависимостей для ионных каналов затруднительно. Параметры ионных токов оцениваются опосредованно через вольтамперные характеристики. По этой причине, как и в предыдущих разделах, была выполнена серия модельных экспериментов для получения вольтамперных характеристик ионного канала GlyR на основе известных экспериментальных данных. Концентрация NaCl во внешнем и внутреннем компартментах была 120 мМ и 5 мМ соответственно [30]. Для ионного канала без селективного фильтра вольтамперная характеристика имеет классический вид и пересекает ось абсцисс в районе -82 мВ, что соответствует нернстовскому потенциалу при градиенте концентраций 120/5 (Рис. 32). При наличии селективного фильтра, зависимость приобретает линейный характер (Рис. 33). Ионный ток при отсутствии внешнего потенциала имеет значение 4.7 пА, что полностью соответствует экспериментальным данным. Показано, что при физиологических градиентах концентрации наиболее приближенными к экспериментальным результатам являются симуляции с учетом снятия ионами гидратной оболочки (Таблица 2). В этом случае погрешность не превышает 6.5%, по сравнению с 30% для случая проникновения ионов в гидратной оболочке. В тоже время, в ситуации достаточно большого «нефизиологичного» симуляция тока с учетом проникновения ионов в гидратной оболочке в канал отклоняется от экспериментальных значений лишь на 9.5%.
Таким образом, в случае хлорного канала глицинового рецептора процесс изменение структуры окружения иона при входе в канал играет, по- видимому, большую роль, нежели для калиевого канала. Причина этого заключается в наличии как положительных, так и отрицательных зарядов в
|
Таблица 2. Сравнение экспериментальных значений трансмембранных ионных токов, измеренных для случая калиевого канала б/уЛ с результатами компьютерной симуляции на основе предложенного алгоритма. Концентрация 1ЧаС1 принималась равной значениям использованным в экспериментальной системе Соие=120 мМ; С|„=5 мМ. (А) или Сои^бОО мМ; €¡„=150 мМ (Б). Результаты компьютерного моделирования представлены в виде М±8В от десяти симуляций. • |
Величина трансмембранного тока, пА |
Ссылка на работу, комментарии |
|
|
3,310,18 |
Моделирование по предложенному алгоритму с учетом прохождения иона в гидратной оболочке |
|
А |
4,4±0,3 |
Моделирование по» предложенному алгоритму с учетом прохождения иона«- без гидратной оболочки |
|
|
4,7±0,1 |
< Экспериментальные данные [72] |
|
Б |
6,9±0,6 |
Моделирование по предложенному алгоритму с учетом прохождения иона в гидратной оболочке |
|
6,3 |
Экспериментальные данные [73] |
канале,, а также некоторой удаленностью колец положительного заряда друг от друга.
Как и в предыдущем разделе были проведены компьютерные эксперименты по получению зависимости ионного тока через канал от процентного содержания заряженных липидов в мембране. Результаты моделирования представлены на Рис. 34. В отличие от полученных результатов компьютерных симуляций для калиевого канала, значение трансмембранного хлорного тока для 01уИ убывает с ростом процентного содержания отрицательно заряженных липидов в мембране и построенная зависимость линейна. Таким образом, наличие в мембране отрицательно заряженных липидов. существенно снижает трансмембранный ток ионов хлора.1 Причина
I
продемонстрированных различий заключается в неоднородности распределения зарядов в канале. Более координированное поле от близко расположенных отрицательных зарядов в калиевом канале позволяет затаскивать ионы калия вне зависимости от стохастически расположенных на поверхности мембраны отрицательных зарядов. В тоже время удаленные кольца, положительных зарядов! не справляются с возникшим полем,
I
отрицательных зарядов, что приводит к уменьшению вероятности попадания анионов в канал и как следствие к падению суммарного тока. Примечательно, что подобная структура в виде симметрично расположенных вокруг центральной оси зарядов может характеризоваться не только
ч
суммарным зарядом, но и симметричностью его расположения. При этом следует отметить, что поскольку структура селективного фильтра определяется наличием пяти заряженных аминокислотных остатков, по одному от каждой субъединицы, то изменение первичной структуры хотя бы одной из субъединиц должно повлиять на величину и симметричность электрического поля в канале, а, следовательно, и на значения токов через канал рецептора. Для проверки данного предположения было проведено исследование зависимости ионных токов от количества заряженных остатков в кольце и их симметричности (Таблица 3) [70]. Структура канала
соответствует стандартной конической геометрии, подробно описанной выше. Значения концентрации ионов во внутреннем и внешнем компартментах принимались равными 5 мМ и 120 мМ соответственно. Для оценки относительной избирательной селективности фильтра был введен следующий параметр:
1 -1+
Из таблицы видно, что на относительную избирательность в существенной степени влияет симметричное расположение заряженных остатков в кольце. При этом симметричность влияет и на абсолютную величину ионного тока. Так в случае не симметричного расположения трех зарядов относительно центральной оси кольца трансмембранный анионный ток на 46% ниже, чем в случае их симметричного расположения. , Таким образом, различное относительное положение субъединиц в условиях наличия или отсутствия в упомянутых положениях зарядов в гетерогенном пентамере С1уЯ может приводить не только к структурным, но и к функциональным изменением свойств данного белка.
Как
и в случае калиевого канала, наличие
зарядов в канале не только определяет
селективность поры, но и увеличивает
ионный ток. В этом смысле у ионных
каналов с описанной структурой возникает
свойство помпы, способной закачивать
ионы и при весьма малом градиенте
концентраций. Степень подобного эффекта
будет напрямую зависеть от плотности
зарядов. Биологический смысл подобного
феномена может заключаться в существовании
дополнительной стабилизации функции
белка в условиях отклонения внешних
условий (изменении величин градиентов).
На примере глицинового рецептора можно
провести оценку реальной симуляции
измерения тока в зависимости от времени.
В соответствии с предложенным алгоритмом
были проведены компьютерные эксперименты
по открытию и закрытию глицинового
рецептора при присоединении в его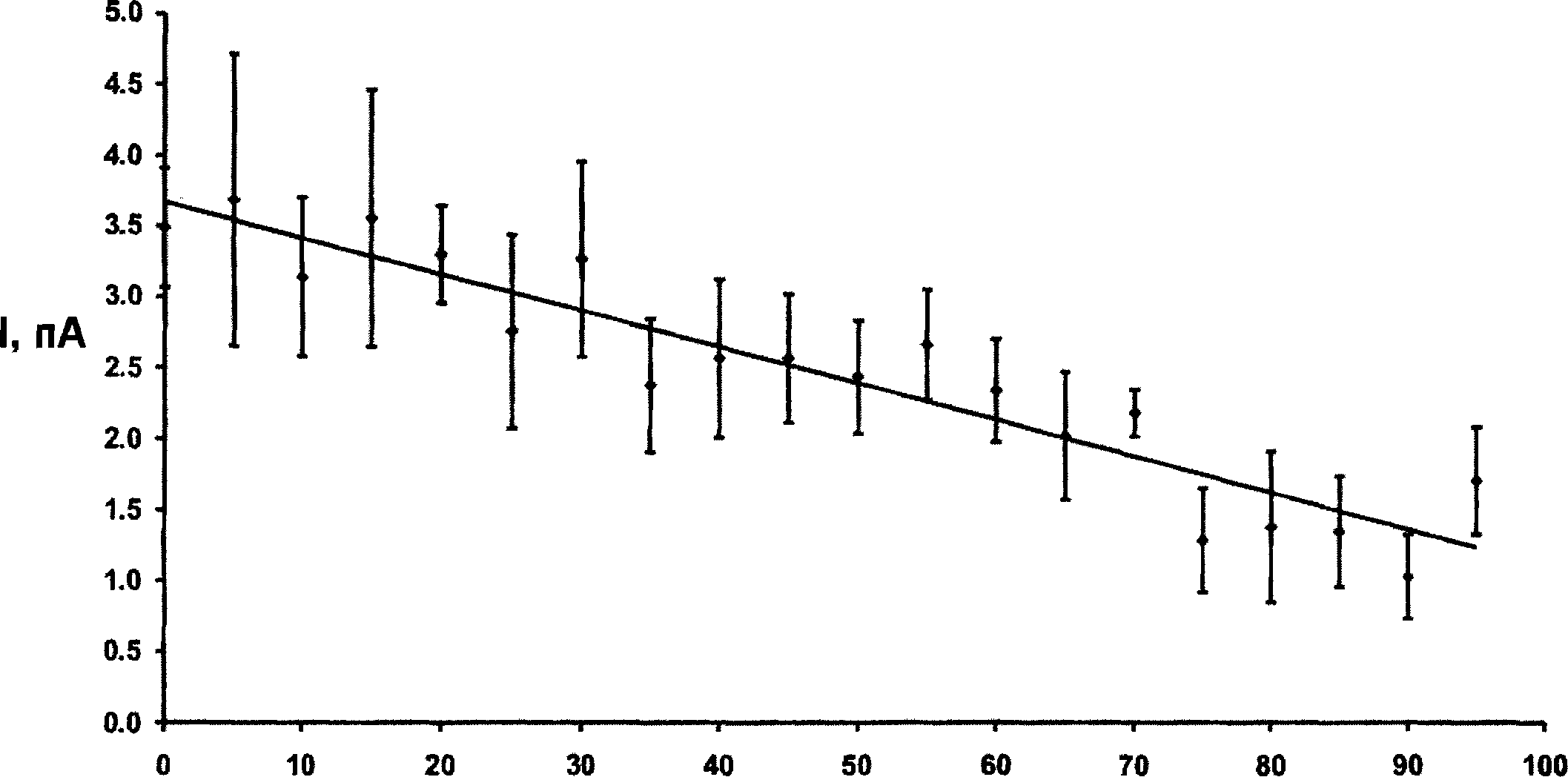
Заряженные липиды, %
Рис. 34. Зависимость ионного тока через канал С1уК от процентного содержания отрицательно заряженных липидов в мембране
|
.Таблица
3. Зависимость ионоселективности
канала С1уК от количества заряженных
аминокислотных остатков и их взаимного
расположения в селективном фильтре. |
Ионный ток, пА |
в | |||||
|
|
| ||||||
|
Полностью собранный фильтр |
|
0.52±0.09 |
3.5±0.2 |
0.74 | |||
|
Один остаток отсутствует |
© |
0.48±0.09 |
1.8±0.2 |
0.57 | |||
|
Отсутствуют два не соседних остатка |
а |
0.40±0.09 |
1.42±0.13 |
0.56 | |||
|
Отсутствуют два соседних остатка |
<л> |
0.42±0.0б |
0.77±0.11 |
0.30 | |||
|
Отсутствуют три остатка, не являющихся соседними по окружности кольца |
О |
0.25±0.06 |
0.63±0.06 |
0.43 | |||
|
Отсутствуют три остатка, соседних по окружности кольца |
О |
0.29±0.10 |
0.51±0.10 |
0.28 | |||
|
Отсутствуют четыре остатка |
б |
0.21±0.09 |
0.35±0.05 |
0.26 | |||
|
В кольце отсутствуют заряженные остатки |
о |
0.34±0.05 |
0.34±0.08 |
0.00 | |||
Т.мс
100
ккМ
з
Т,мс
[
Оіу]
=
500 мкМ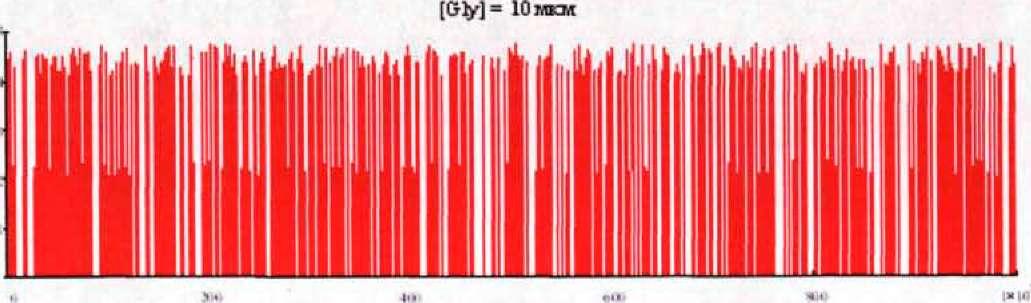

Б
(V
В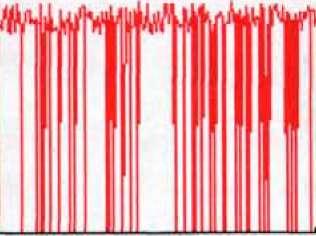


МІ
III. ПСІІ
Т.мс
[51>г] = 1000 мк
М
Г
д
Т.мс

5рА
І ЮО т
е
Рис. 35. Временные характеристики ионных токов через канал вІуК для различных концентраций глицина в синаптической щели: (Л) 10 мкМ, (Б) 100 мкМ, (В) 500 мкМ, (Г) 1000 мкМ, (Д) Экспериментальная характеристика [72]
выводы
Сформулирован оптимизированный алгоритм для описания движения ионов в ограниченном компартменте вблизи поверхности мембраны, основанный на пошаговом решении уравнений Ланжевена. На его основе разработано программное обеспечение, позволяющее моделировать трансмембранные токи при различных градиентах ионов, плотности фиксированных зарядов, а также геометрии ионных каналов.
Показано, что, снятие гидратной оболочки иона при входе в калиевый канал приводит к увеличению трансмембранных ионных токов по сравнению с аналогичным переносом частиц в гидратной оболочке.
В ходе компьютерного моделирования получены токовые характеристики для хлорного канала глицинового рецептора, на основе которых показано, что наличие заряженных аминокислотных остатков в полости канала обеспечивают как значительное увеличение анионного тока, так и ионную селективность.
Изменение симметричности и величины электрического поля формируемого заряженными аминокислотными остатками в полости канала глицинового рецептора приводит к существенному изменению ионных токов, причем их симметричное расположение лучше обеспечивает ионную селективность и избирательную проводимость.
На примере хлорного канала глицинового рецептора теоретически обоснована возможность существования не нулевого трансмембранного тока в условиях отсутствия градиента концентрации переносимого иона при условии близкого расположения к входному участку канала неэкранированных зарядов аминокислотных остатков белка.
С использованием вероятностного подхода в рамках алгоритма, предложенного в данной работе, создан виртуальный симулятор позволяющий получить временные зависимости трансмембранных токов через единичный белковый канал.
Заключение
Представленный в данной работе алгоритм позволяет проводить компьютерную симуляцию трансмембранных ионных токов в случае мембранных каналов, имеющих различную геометрию и при условии существования в растворе самых различных ионов. Принципиальной особенностью данного подхода является его высокая адаптированность к нуждам экспериментаторов. Разработанное программное обеспечение позволяет не только провести моделирование в узкоспециализированных условиях, но и рассматривать самые различные задачи, необходимые для оценки трансмембранных токов.
Еще одним важным преимуществом представленного подхода является возможность инкорпорировать результаты моделирования в более сложные многокомпонентные модели более высокого уровня. В самом деле, если предположить, что проводимость каждого из каналов данного типа не зависит от их числа и места расположения, то для определенной поверхности мембраны на которой размещается порядка 1000 белковых каналов с помощью предложенного алгоритма можно получить приближенные оценки токов/потоков ионов представленные с учетом реальных локальных флуктуаций, характерных для отдельных каналов. Более того, проведение виртуальных экспериментов при разных значениях параметров непосредственно моделирует флуктуацию условий биологической системы, и подобные результаты могут быть получены с уже существующим программным обеспечением без дополнительных модификаций. Таким образом, следующей перспективной задачей в данном направлении исследования можно считать всестороннее приложение разработанного алгоритма к экспериментальным системам и дополнение алгоритма за счет процедур, программирующих выявляемую регуляцию.
Список литературы
Crank J. 2005. The mathematics of diffusion. New York: OXFORD University Press Inc. 414p
Cherepanov DA, Junge W, Mulkidjanian AY. 2004. Proton transfer dynamics at the membrane/water interface: dependence on the fixed and mobile pH buffers, on the size and form of membrane particles, and on the interfacial potential barrier. Biophysical journal 86(2):665-80
Zifarelli G, Soliani P, Pusch M. 2008. Buffered Diffusion around a Spherical Proton Pumping Cell: A Theoretical Analysis. Biophysical Journal 94:53-62
Cheng Y, Suen JK, Zhang D, Bond SD, Zhang Y, Song Y, Baker NA, Bajaj CL, Hoist MJ, McCammon JA. 2007. Finite Element Analysis of the Time-Dependent Smoluchowski Equation for Acetylcholinesterase Reaction Rate Calculations. Biophysical Journal 92:3397-406
Selivanov VA, Krause S, Roca J, Cascante M. 2007. Modeling of Spatial Metabolite Distributions in the Cardiac Sarcomere. Biophysical Journal 92:3492-500
Vlad VO, Cavalli-Sforza LL, Ross J. 2004. Enhanced (hydrodynamic) transport induced by population growth in reaction-diffusion systems with application to population genetics. Proc. Nat. Acad. Sci. 101(28): 10249-53
Lewis M, Renclawowicz J, van den Driessche P. 2006. Traveling Waves and Spread Rates for a West Nile Virus Model. Bulletin of Mathematical Biology 68:3-23
Yeung C, Shtrahman M, X. W. 2007. Stick-and-Diffuse and Caged Diffusion: A Comparison of Two Models of Synaptic Vesicle Dynamics. Biophysical Journal 92:2271-80
Bentele K, Falcke M. 2007. Quasi-Steady Approximation for Ion Channel Currents. Biophysical Journal 93:2597-608
Ю.Шуваев АН, Брильков AB. 2007. Стохастическая модель внутриклеточной динамики многокопийных бактериальных плазмид с учетом контроля репликации. МАТЕМАТИЧЕСКАЯ БИОЛОГИЯ И БИОИНФОРМАТИКА 2(1):66-72
11 .Вardwell L, Zou X, Nie Q, Komarova NL. 2007. Mathematical Models of Specificity in Cell Signaling. Biophysical Journal 92:3425-41
Wheatley DN. 2003. Diffusion, perfusion and the exclusion principles in the structural and functional organization of the living cell: reappraisal of the properties of the 'ground substance'. J Exp. Bio. 206:1955-61
Полянин АД. 2001. Справочник по линейным уравнениям математической физики. Москва: ФИЗМАТ ЛИТ. 576р
Полянин АД, Зайцев, В. Ф. 2002. Справочник по нелинейным уравнениям математической физики: Точные решения. Москва: ФИЗМАТЛИТ. 432р
Eisenberg, R. S.: "Computing the field in proteins and channels". The Journal of membrane biology 1996 150 1-25
Chen, D. P. and Eisenberg, R. S.: "Flux, coupling, and selectivity in ionic channels of one conformation". Biophysical journal 1993 65 727-746
17.Schuss, Z., Nadler, B. and Eisenberg, R. S.: "Derivation of Poisson and Nernst-Planck equations in a bath and channel from a molecular model". Physical review. E, Statistical, nonlinear, and soft matter physics 2001 64 036116
Nadler, В., Schuss, Z., Hollerbach, U. and Eisenberg, R. S.: "Saturation of conductance in single ion channels: the blocking effect of the near reaction field". Physical review. E, Statistical, nonlinear, and soft matter physics 2004 70 051912
Karplus, M. and Petsko, G. A.: "Molecular dynamics simulations in biology". Nature 1990 347 631-639
Weiner, S. J., Kollman, P. A., Case, D. A., Singh, U. C., Ghio, C., Alagona,G., Profeta, S. and Weiner, P.: "A new force field for molecular
mechanical simulation of nucleic acids and proteins.". Journal of the American Chemical Society 1984 106 765-784
Brooks, B. R., Bruccoleri, R. E., Olafson, B. D., States, D. J., Swaminathan, S. and Karplus, M.: "CHARMM: a program for macromolecular energy minimization and dynamics calculations.". Journal of Computational Chemistry 1983 4 187-217
Lindahl, E., Hess, B. and van der Spoel, D.: "GROMACS 3.0: a package for molecular simulation and trajectory analysis.". Journal of Molecular Modeling 2001 7 306-317
Aksimentiev, A. and Schulten, K.: "Imaging alpha-hemolysin with molecular dynamics: ionic conductance, osmotic permeability, and the electrostatic potential map". Biophysical journal 2005 88 3745-3761
Allen, M. P. and Frenkel, D.: "Observation of dynamical precursors of the isotropic-nematic transition by computer simulation". Physical review letters 1987 58 1748-1750
Chung, S. H. and Kuyucak, S.: "Recent advances in ion channel research". Biochimica et biophysica acta 2002 1565 267-286
Colquhoun, D.: "Binding, gating, affinity and efficacy: the interpretation of structure-activity relationships for agonists and of the effects of mutating receptors" British journal of pharmacology 1998 125 924-947
Twyman, R. E. and Macdonald, R. L.: "Kinetic properties of the glycine receptor main- and sub-conductance states of mouse spinal cord neurones in culture" The Journal of physiology 1991 435 303-331
Fucile, S., D, d. S. J., David-Watine, B., Korn, H. and Bregestovski, P.: "Comparison of glycine and GABA actions on the zebrafish homomeric glycine receptor" The Journal of physiology 1999 517 ( Pt 2) 369-383
Grewer, C.: "Investigation of the alpha(l)-glycine receptor channel-opening kinetics in the submillisecond time domain" Biophysical journal 1999 77 727-738
Beato, M., Groot-Kormelink, P. J., Colquhoun, D. and Sivilotti, L. G.: "Openings of the rat recombinant alpha 1 homomeric glycine receptor as a function of the number of agonist molecules bound" The Journal of general physiology 2002 119 443-466
Mangin, J. M., Baloul, M., L, P. D. C., Rogister, В., Rigo, J. M. and Legendre, P.: "Kinetic properties of the alpha2 homo-oligomeric glycine receptor impairs a proper synaptic functioning" The Journal of physiology 2003 553 369-386
Hodgkin, A. L. and Huxley, A. F.: "A quantitative description of membrane current and its application to conduction and excitation in nerve" The Journal of physiology 1952 117 500-544
Rudy, Y.: "From genetics to cellular function using computational biology" Annals of the New York Academy of Sciences 2004 1015 261-270
Бороновский, С. E. и Нарциссов, Я. Р.: "Электростатическая модель ионного канала глицинового рецептора". Научная сессия МИФИ2006 5 158-159
Wuytack, F.: "Half a century of ion-transport ATPases: the P- and V-type ATPases" Pflugers Archiv : European journal of physiology 2009'457 569571
Dale Purves, G. J. A., David Fitzpatrick, Lawrence. C. Katz, AnthonySamuel LaMantia, James O. McNamara, S. Mark Williams: "Neuroscience. Chapter 4: Channels and Transporters." 2001
Boyer, P. D.: "A research journey with ATP synthase" The Journal of biological chemistry 2002 277 39045-39061
Boyer, P. D.: "The ATP synthase~a splendid molecular machine" Annual review of biochemistry 1997 66 717-749
Zhou, Y., Morais-Cabral, J. H., Kaufman, A. and MacKinnon, R.: "Chemistry of ion coordination and hydration revealed by a K+ channel-Fab complex at 2.0 A resolution". Nature 2001 414 43-48
Beckstein, O., Biggin, P. C., Bond, P., Bright, J.' N., Domene, C., Grottesi, A., Holyoake, J. and Sansom, M. S.: "Ion channel gating: insights via molecular simulations". FEBS letters 2003 555 85-90
Agre, P., King, L. S., Yasui, M., Guggino, W. B., Ottersen, O. P., Fujiyoshi, Y., Engel, A. and Nielsen, S.: "Aquaporin water channels—from atomic structure to clinical medicine". The Journal of physiology 2002 542 3-16
Wikstrom, M., Verkhovsky, M. I. and Hummer, G.: "Water-gated mechanism of proton translocation by cytochrome c oxidase". Biochimica et biophysica acta 2003 1604 61-65
Wikstrom, M.: "Proton translocation by bacteriorhodopsin and heme-copper oxidases". Current opinion in structural biology 1998 8 480-488'
Miller, C.: "An overview of the potassium channel family". Genome biology 2000 1
Jiang, Y., Lee, A., Chen, J., Ruta, V., Cadene, M:, Chait, B. T. and MacKinnon, R.: "X-ray structure of a voltage-dependent K+ channel". Nature 2003 423 33-41
46 Jiang, Y., Ruta, V., Chen, J., Lee, A. and MacKinnon, R.: "The principle of gating charge movement in a voltage-dependent K+ channel". Nature 2003 423 42-48
Doyle, D. A., J, M. C., Pfuetzner, R. A., Kuo, A., Gulbis, J. M., Cohen, S. L., Chait, B. T. and MacKinnon, R.: "The structure of the potassium channel: molecular basis of K+ conduction and selectivity". Science (New York, NY.) 1998 280 69-77
Kariev, A. M. and Green, M. E.: "Quantum mechanical calculations on selectivity in the KcsA channel: the role of the aqueous cavity". The journal °f physical chemistry. B 2008 112 1293-1298
49Judge, S. I. and Jr, B. C.: "Potassium channel blockers in multiple sclerosis: neuronal Kv channels and effects of symptomatic treatment". Pharmacology & therapeutics 2006 111 224-259
Pfeiffer, F. and Betz, H.: "Solubilization of the glycine receptor from rat spinal cord". Brain research 1981 226 273-279
Pfeiffer, F., Graham, D. and Betz, H.: "Purification by affinity chromatography of the glycine receptor of rat spinal cord". The Journal of biological chemistry 1982 257 9389-9393
Grenningloh, G., Pribilla, I., Prior, P., Multhaup, G., Beyreuther, K., Taleb, O. and Betz, H.: "Cloning and expression of the 58 kd beta subunit of the inhibitory glycine receptor". Neuron 1990 4 963-970
Grenningloh, G., Rienitz, A., Schmitt, B., Methfessel, C., Zensen, M., Beyreuther, K., Gundelflnger, E. D. and Betz, H.: "The strychnine-binding subunit of the glycine receptor shows homology with nicotinic acetylcholine receptors". Nature 1987 328 215-220
Langosch, D., Thomas, L. and Betz, H.: "Conserved quaternary structure of ligand-gated ion channels: the postsynaptic glycine receptor is a pentamer". Proceedings of the National Academy of Sciences of the United States of America 1988 85 7394-7398
Rajendra, S., Vandenberg, R. J., Pierce, K. D., Cunningham, A. M., French, P. W., Barry, P. H. and Schofield, P. R.: "The unique extracellular disulfide loop of the glycine receptor is a principal ligand binding'element". The EMBO journal 1995 14 2987-2998
Miyazawa, A., Fujiyoshi, Y. and Unwin, N.: "Structure and gating mechanism of the acetylcholine receptor pore". Nature 2003 423 949-955
57.Spencer, R. H. and Rees, D. C.: "The alpha-helix and the organization and gating of channels". Annual review of biophysics and biomolecular structure 2002 31 207-233
58.Shan, Q., Haddrill, J. L. and Lynch, J. W.: "A single beta subunit M2 domain residue controls the picrotoxin sensitivity of alphabeta heteromeric glycine receptor chloride channels". Journal of neurochemistry 2001 76 1109-1120
Xu, M. and Akabas, M. H.: "Identification of channel-lining residues in the M2 membrane-spanning segment of the GABA(A) receptor alphal subunit". The Journal of general physiology 1996 107 195-205
Lynch, J. W.: "Molecular structure and function of the glycine receptor chloride channel". Physiological reviews 2004 84 1051-1095
Bormann, J., Hamill, O. P. and Sakmann, B.: "Mechanism of anion permeation through channels gated by glycine and gamma-aminobutyric acid in mouse cultured spinal neurones". The Journal of physiology 1987 385 243-286
Keramidas, A., Moorhouse, A. J., Pierce, K. D., Schofield, P. R. and Barry, P. H.: "Cation-selective mutations in the M2 domain of the inhibitory glycine receptor channel reveal determinants of ion-charge selectivity". J The Journal of general physiology 2002 119 393-410
Fatima-Shad, K. and Barry, P. H.: "Anion permeation in GAB A- and glycine-gated channels of mammalian cultured hippocampal neurons". Proceedings. Biological sciences / The Royal Society 1993 253 69-75
Rundstrom, N., Schmieden, V., Betz, H., Bormann, J. and Langosch, D.: "Cyanotriphenylborate: subtype-specific blocker of glycine receptor chloride channels". Proceedings of the National Academy of Sciences of the United States of America 1994 91 8950-8954
Lester, H. A.: "The permeation pathway of neurotransmitter-gated ion channels". Annual review of biophysics and biomolecular structure 1992 21 267-292
Miyazawa, A., Fujiyoshi, Y., Stowell, M. and Unwin, N.: "Nicotinic acetylcholine receptor at 4.6 A resolution: transverse tunnels in the channel wall". Journal of molecular biology 1999 288 765-786
Unwin, N.: "Acetylcholine receptor channel imaged in the open state". Nature 1995 373 37-43
Wilson, G. G. and Karlin, A.: "The location of the gate in the acetylcholine receptor channel". Neuron 1998 20 1269-1281
Han, N. L., Clements, J. D. and Lynch, J. W.: "Comparison of taurine- and glycine-induced conformational changes in the M2-M3 domain of the glycine receptor". The Journal of biological chemistry 2004 279 1955919565
Boronovsky, S. E., Seraya, I. P. and Nartsissov, Y. R.: "Brownian dynamic model of the glycine receptor chloride channel: effect of the position of charged amino acids on ion membrane currents". Systems biology 2006 153 394-397
LeMasurier, M., Heginbotham, L. and Miller, C.: "KcsA: it's a potassium channel". The Journal of general physiology 2001 118 303-314
Beato, M., Groot-Kormelink, P. J., Colquhoun, D. and Sivilotti, L. G.: "The activation mechanism of alphal homomeric glycine receptors". The Journal of neuroscience : the official journal of the Society for Neuroscience 2004 24 895-906
Bednarczyk, P., Szewczyk, A. and Dolowy, K.: "Transmembrane segment M2 of glycine receptor as a model system for the pore-forming structure of ion channels". Acta biochimica Polonica 2002 49 869-875
Chung, S. H., Allen, T. W., Hoyles, M., Kuyucak, S. and AD - Protein Dynamics Unit, D. o. C., Australian National University, Canberra, ACT 0200, Australia AD - Department of Theoretical Physics, Research School of Physical Sciences, Au: "Permeation of ions across the potassium channel: Brownian dynamics studies". Biophysical Journal 1999 77 2517-2533
Chung, S. H., Hoyles, M., Allen, T., Kuyucak, S. and AD - Protein Dynamics Unit, D. o. C., Australian National University, Canberra, ACT 0200, Australia AD - Department of Theoretical Physics, Research School of Physical Sciences, Austr: "Study of ionic currents across a model membrane channel using Brownian dynamics". Biophysical Journal 1998 75
. 793-809
Moy, G., Corry, B., Kuyucak, S., Chung, S. H. and AD - Protein Dynamics Unit, D. o. C., Australian National University, Canberra, ACT 0200,
Australia AD - Department of Theoretical Physics, Research School of Physical Sciences, Australi: "Tests of continuum theories as models of ion channels. I. Poisson- Boltzmann theory versus brownian dynamics". Biophysical Journal 2000 78 2349-2363
Corry, B., Kuyucak, S., Chung, S. H. and AD - Protein Dynamics Unit, D. o. C., Australian National University, Canberra, ACT 0200, Australia AD - Department of Theoretical Physics, Research School of Physical Sciences, AustralianNation: "Tests of continuum theories as models of ion channels. II. Poisson- Nernst-Planck theory versus brownian dynamics". Biophysical Journal 2000 78 2364-2381
Vora, T., Corry, B:, Chung, S. H. and AD - Department of Theoretical Physics, R. S. o. P. S., Australian National University, Canberra, ACT 0200, Australia AD - Department of Chemistry, University of Western Australia, Crawley, W: "A model of sodium channels". Biochimica et Biophysica Acta - Biomembranes 2005 1668 106-116
Corry, B., O'Mara, M., Chung, S. H. and AD - Department of Theoretical Physics, R. S. o. P. S. a. E., Australian National University, Canberra, ACT 0200, Australia AD - Department of Chemistry, University of Western Australia, Perth, WA 60: "Permeation dynamics of chloride ions in the C1C- 0 and C1C-1 channels". Chemical Physics Letters 2004 386 233-238
Krishnamurthy, V., Hoyles, M., Saab, R., Chung, S. H. and AD Department of Electrical and Computer Engineering, U. o. B. C., Vancouver, Canada AD - Department of Theoretical Physics, Research School of Physical Sciences, Australia: "Permeation in gramicidin ion channels by directly estimating the potential of mean force using Brownian dynamics simulations". Journal of Computational and Theoretical Nanoscience 2006 3 702-711
Corry, B., Chung, S. H. and AD - Chemistry, Sch. of Biomed. and Chem. Sciences, University of Western Australia, Crawley, WA 6009, Australia AD - Department of Theoretical Physics, Research School of Physical
Sciences, Australian National University: "Influence of protein flexibility on the electrostatic energy landscape in gramicidin A". European Biophysics Journal 2005 34 208-216
82.Edwards, S., Corry, B., Kuyucak, S., Chung, S. H. and AD - Protein Dynamics Unit, D. o. P., Faculty of Science, Canberra, ACT 0200, Australia AD - Department of Theoretical Physics, Research School of Physical Sciences, Australian Nationa: "Continuum electrostatics fails to describe ion permeation in the gramicidin channel". Biophysical Journal 2002 83 13481360
S3.Gurtovenko, A. A. and Vattulainen, I:: "Ion leakage through transient water pores in protein-free lipid membranes driven by transmembrane ionic charge imbalance". Biophysical Journal 2007 92 1878-1890
Leontiadou, H., Mark, A. E. and Marrink, S. J.: "Ion transport across transmembrane pores". Biophysical Journal 2007 92 4209-4215
Chen, H., Wu, Y. and Voth, G. A.: "Proton transport behavior, through the influenza A M2 channel: Insights from molecular simulation". Biophysical Journal 2007 93 3470-3479
Baoukina; S., Monticelli, L., Amrein, M. and Tieleman, D. P.: "The molecular mechanism, of monolayer-bilayer transformations of lung surfactant from molecular dynamics simulations": Biophysical Journal 2007 93 3775-3782
Knecht, V. and Marrink, S. J.: "Molecular dynamics simulations of lipid vesicle fusion in atomic detail". Biophysical Journal 2007 92 4254-4261
88.Sliozberg, Y. and Abrams, C. F.: "Spontaneous conformational» changes in the E. coli GroEL subunit from all-atom molecular dynamics simulations". Biophysical Journal 2007 93 1906-1916
89.Weronski, P., Jiang, Y. and Rasmussen, S.: "Molecular dynamics study of small PNA molecules in lipid-water system". Biophysical Journal 2007 92 3081-3091
Kony, D: B., Damm, W., Stoll, S., Van Gunsteren, W. F. and Hunenberger, P. H.: "Explicit-solvent molecular dynamics simulations, of the polysaccharide schizophyllan in water". Biophysical Journal 2007 93 442455
Anselmi, M., Brunori, M., Vallone, B. and Di Nola, A.: "Molecular dynamics simulation .of deoxy and carboxy murine neuroglobin in water". Biophysical Journal 2007 93 434-441
Atzberger, P. J. and Peskin, C. S.: "A Brownian Dynamics Model of Kinesin in Three Dimensions Incorporating the Force-extension Profile of the Coiled-coil Cargo Tether". Bulletin of Mathematical Biology 2006 68 131-160
93:Chung, S. Hi and Corry, B.: "Conduction properties of KcsA measured using brownian dynamics with flexible carbonyl groups in the selectivity filter". Biophysical Journal 2007 93 44-53
Nishizawa, M. and Nishizawa, K.: "Molecular dynamics. simulations of a stretch-activated channel inhibitor GsMTx4 with lipid membranes: Two binding modes and effects of lipid structure". Biophysical Journal 2007 92 4233-4243
Pineda,. J. R., Callender, R. and Schwartz, S. D.: "Ligand binding and* protein dynamics in lactate dehydrogenase". Biophysical Journal 2007 93 1474-1483'
Wu, E. L., Mei, Y., Han, K. and Zhang, J. Z.: "Quantum and molecular dynamics study for binding of macrocyclic inhibitors to human ?-thrombin". Biophysical-Journal 2007 92 4244-4253
Guigas, G., Weiss, M. and AD- - Cellular Biophysics, Group , German Cancer Research Center, Heidelberg, Germany: "Sampling the cell with- anomalous diffusion - The discovery of slowness". Biophysical Journal 2008 94 90-94