
Kompendium_po_biofizike_1
.pdf
метод основан на измерении газообмена организма. Установлено, что между объемом потребляемого биологической системой кислорода и энерготратами существует линейная зависимость. Коэффициентом для такой зависимости служит так называемый
калорический эквивалент кислорода, равный количеству тепла, образующемуся в организме при использовании 1 л кислорода при окислении питательных веществ.
Калорический эквивалент не одинаков при окислении белков, жиров и углеводов. О том, какие вещества преимущественно окисляются в организме судят по так называемому
дыхательному коэффициенту ДК, который вычисляется как отношение объема, выдыхаемого CO2 к поглощаемому O2:
ДК=VCO2/VO2. ДК стремится к 1 при окислении углеводов, а при окислении жиров получают самое низкое значение ДК (ДК=0,7).
При непрямой калориметрии посредством газоанализа измеряют объемы потребляемого кислорода и выделенного углекислого газа. Далее определяют дыхательный коэффициент, по которому находят калорический эквивалент. Умножив калорический эквивалент на количество поглощенного кислорода, определяют энерготраты организма.
71

БИОЭНЕРГЕТИКА. ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ И ЖИВЫЕ ОРГАНИЗМЫ
1. Свободная и связанная энергия в организме
Движение частиц в любом теле может быть упорядоченным или неупорядоченным. Между упорядоченным и неупорядоченным движениями существует принципиальная разница: упорядоченное может полностью превратиться в неупорядоченное, а переход в неупорядоченное движение в упорядоченное никогда не бывает полным. Причина различия между двумя типами движения связана с неодинаковой вероятностью каждого из них.
Внутренняя энергия в идеальном газе полностью, а в других телах в значительной части связана с неупорядоченным тепловым движением молекул. В то же время совершение работы всегда требует переноса вещества, т.е. упорядоченного (направленного) движения. Поэтому принципиально невозможно всю внутреннюю энергию тела использовать для совершения работы.
Та часть внутренней энергии системы, которую в принципе можно использовать для совершения работы называется свободной энергией G . Остальную часть внутренней энергии системы, которую даже в принципе нельзя превратить в работу
называется связанной энергией WCB , т.е. U G |
WCB . |
При необратимых процессах свободная |
энергия не может |
быть преобразована в работу полностью, так как часть энергии диссипирует, а при обратимых процессах – может.
В живых организмах разновидностью свободной энергии является химическая энергия молекул dG  x dv ,где x – химический потенциал (химический потенциал системы по отношению к некоторому веществу равен приросту свободной энергии системы при возрастании количества этого вещества на 1 моль).
x dv ,где x – химический потенциал (химический потенциал системы по отношению к некоторому веществу равен приросту свободной энергии системы при возрастании количества этого вещества на 1 моль).
Свободная энергия, как и полная, является функцией состояния, т.е. функция тех условий, в которых находится система (T , p , x ).
72

2. Энтропия и еѐ свойства
Тепловая энергия в организме представляет собой конкретную форму связанной энергии биосистемы, так как в условиях жизнедеятельности она не может быть преобразована ни в одну из форм работ, совершаемых организмом. Связанная энергия зависит от температуры (WCB ~ T ), однако связанная энергия различных систем с одинаковой температурой не всегда одинакова, – она зависит еще и от свойств системы. Эти свойства S принято называть энтропией (от греческого «изменение», «превращение»). Тогда свободная энергия будет равна:
WCB |
ST , а энтропия – S |
WCB |
|
T |
|||
|
|
Энтропия - это физическая величина, характеризующая значение связанной энергии данной системы, приходящееся на единицу температуры (1K).
Свойства энтропии.
Энергия в различных формах имеет разную практическую ценность, которая тем выше, чем большую часть этой энергии можно преобразовать в работу, а поскольку мерой связанной энергии является энтропия, то чем ниже энтропия системы, тем выше ценность свойственной ей внутренней энергии. В организме все процессы сопряжены: т.е. организованы так, чтобы достигнуть максимума использования свободной энергии. Это достигается на клеточном уровне с помощью мембран на органном уровне за счет регуляторных систем: нервной, эндокринной, гуморальной.
Энтропия является функцией состояния системы. Это означает, что величина энтропии определяется параметрами системы в данный момент и не зависит от ее «истории», т.е. от того, как система пришла в данное состояние.
Так как энтропия - функция состояния, то изменение энтропии в обратимом процессе будет таким же и в реальном необратимом процессе, хотя затраченное количество тепла будет фактически больше чем при обратном процессе.
73

Для обратимых процессов изменение энтропии равно 0, для необратимых процессов – всегда больше 0. Т.е. в изолированной системе энтропия может только возрастать. Энтропия указывает направление естественных процессов - в изолированной системе они приводят к возрастанию энтропии (доля связанной энергии возрастает, а свободной – уменьшается).
Энтропия системы, находящейся в равновесном состоянии, будет максимальной.
Между энтропией состояния и его вероятностью
существует определенная зависимость: |
S k ln Pтд , |
где Pтд – |
|
термодинамическая |
вероятность |
(число |
возможных |
микросостояний, которыми может быть реализовано данное макросостояние системы).
3. Второе начало термодинамики
Второе начало термодинамики говорит о направлении процессов. В простых случаях их направление можно предсказать на основании «здравого смысла». Например, тепло переходит от теплого тела к холодному, при трении механическая энергия превращается в тепловую. Однако не всегда в биофизике и биохимии можно правильно предвидеть, как будет проходить явление. Поэтому нужен алгоритм, который давал бы возможность достоверно предсказать направление процессов – это и есть второе начало термодинамики.
2-е начало термодинамики: «В изолированной системе общее изменение энтропии всегда положительно: S 0 .
II начало термодинамики для биологических систем.
И.П. Пригожин предположил, что полное изменение энтропии открытой системы нужно представить в виде 2-х частей: причиной первой из них ( i S ) служат внутренние процессы, которые необратимы и непременно сопровождаются диссипацией энергии; вторая часть ( e S ) обусловлена обменом энергией и веществом между системой и окружающей средой. Следовательно, S  e S
e S  i S . Аналогичное выражение можно
i S . Аналогичное выражение можно
74

написать и для изменения полной свободной энергии открытой системы: G  eG
eG 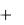 i G .
i G .
Так как все реальные процессы |
в |
открытых системах |
||||
необратимы, |
то |
i S всегда |
больше |
нуля, а |
i G - всегда |
|
отрицательно. |
Что же касается |
e S (или |
eG ), |
то знаки этих |
||
величин в разных ситуациях могут иметь разные значения, в ходе обмена с окружающей средой свободная энергия системы может увеличиваться, и уменьшаться.
Ворганизме первый случай имеет место при усвоении пищи,
авторой - при неблагоприятных воздействиях, вызывающих дополнительные затраты свободной энергии.
В общем случае в открытой системе S 0 и S 0 , причем в разные промежутки времени изменения полной энтропии могут быть различны.
В связи с этим в термодинамику открытых систем был введен параметр, который отсутствовал в классической термодинамике –
скорость изменения энтропии |
dS |
|
: |
|
|
|
|
|
|||||
dt |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
dS |
|
|
di S |
|
de S |
|
|
|||
|
|
|
dt |
|
|
dt |
|
dt |
|
||||
Член |
di S |
называется продукцией энтропии, а |
de S |
– потоком |
|||||||||
dt |
dt |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||
энтропии.
В открытых системах внутреннее изменение энтропии всегда положительно, а внутреннее изменение свободной энергии всегда отрицательно.
|
di S |
0, |
di G |
0 |
|
|
|
|
|
|
dt |
dt |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
||
В изолированной системе |
de S |
0 |
и |
dS |
|
di S |
. Для |
||
dt |
dt |
|
dt |
||||||
поддержания жизни необходимо непрерывное поступление в организм свободной энергии из окружающей среды, чтобы пополнять беспрестанную убыль свободной энергии самого организма, идущей на выполнение работы в различных видах.
75

Стационарное состояние открытой системы – это такое состояние, при котором основные макроскопические параметры системы остаются постоянными.
|
Стационарное состояние |
|
|
|
Равновесное состояние |
|
|
||||
|
Свободная |
энергия |
и |
|
|
Свободная |
энергия |
и |
|
||
|
работоспособность |
системы |
|
|
работоспособность |
системы |
|
||||
|
постоянны, но не минимальны |
|
|
|
минимальны |
|
|
|
|
||
|
Энтропия |
в |
системе |
|
|
Энтропия |
в |
системе |
|
||
|
постоянна за |
счет |
равенства |
|
|
максимальна |
|
|
|
|
|
|
продукции и потока энтропии |
|
|
|
|
|
|
|
|
||
|
Наличие |
|
постоянных |
|
|
Отсутствие |
градиентов |
в |
|
||
|
градиентов в системе |
|
|
|
|
системе |
|
|
|
|
|
Термодинамическим критерием (условием) стационарного состояния является равенство между продукцией энтропии организмом и потоком энтропии из него в окружающую среду:
di S |
|
de S |
, а полное изменение энтропии равно нулю |
dS |
0 . |
dt |
|
dt |
dt |
||
|
|
|
Т.е. открытая система поддерживает свою полную энтропию постоянной за счѐт увеличения энтропии окружающей среды.
Для поддержания стационарного состояния открытая система из окружающей среды черпает свободную энергию. Для сохранения термодинамического равновесия затрачивать свободную энергию не нужно.
4. Теорема Пригожина.
В стационарном состоянии продукция энтропии имеет постоянное и минимальное из всех возможных значений:
di S |
min . |
|
dt |
||
|
Теорема Пригожина показывает, что в стационарном состоянии диссипация свободной энергии происходит с меньшей скоростью, чем в любых других состояниях, т.е.  в стационарном состоянии максимален:
в стационарном состоянии максимален:
dF dF
dU dF TdS
76

Сопряженность биопроцессов - некоторая организация процессов, позволяющая достигнуть максимума использования свободной энергии. Реализуется на клеточном уровне – за счет мембран; на органном – за счет регуляторных систем: нервной, эндокринной, гуморальной.
77

СТРУКТУРНО-ФУНКЦИОНАЛЬНАЯ ОРГАНИЗАЦИЯ МЕМБРАН. ТРАНСПОРТ ВЕЩЕСТВ ЧЕРЕЗ БИОЛОГИЧЕСКИЕ МЕМБРАНЫ
1. Значение биологических мембран в процессе жизнедеятельности клетки
Клеточная теория − фундаментальная в биологии теория, позволившая дать научное обоснование закономерностей живого мира и послужившая основой для развития эволюционного учения. Основоположниками клеточной теории являются ученые
М. Шлейден (ботаник), Т. Шванн (зоолог) и Р. Вирхов (патологоанатом).
Маттиас Шлейден, Теодор Шванн сформулировали клеточную теорию, основываясь на множестве исследований о клетке (1838).
Обобщив имеющиеся знания о клетке, М. Шлейден и Т. Шванн доказали, что клетка является основной единицей любого организма. Клетки животных, растений и бактерий имеют схожее строение.
Позднее (1858 г.) Рудольф Вирхов дополнил клеточную теорию тезисом о единстве всех живых организмов и непрерывности самой жизни – «каждая клетка – из клетки».
Таким образом, Т. Шванн и М. Шлейден и Р. Вирхов ввели в науку основополагающее представление о клетке: вне клеток нет жизни.
Клеточная мембрана (КМ) – это оболочка клетки,
выполняющая следующие три основные функции:
барьерную – КМ обеспечивает избирательный (селективный), регулируемый пассивный и активный обмен веществом с окружающей средой;
матричную – КМ отвечает за определенное взаимное расположение и ориентацию мембранных белков для обеспечения их оптимального взаимодействия;
механическую – КМ обеспечивает прочность и автономность клетки и внутриклеточных структур.
78

Кроме трех основных функций, перечисленных выше, КМ выполняет и другие функции:
энергетическая – синтез АТФ на внутренних мембранах митохондрий и фотосинтез на мембранах митохондрий;
генерация и проведение биоэлектрических потенциалов; рецепторная – в основе механической, обонятельной,
зрительной, химической и тепловой рецепции лежат процессы, происходящие на КМ.
2. Молекулярная организация и модели клеточных мембран
Термин «модели клеточных мембран» можно понимать в следующих двух смыслах:
модель клеточной мембраны как этап в знаниях человечества о строении и структуре мембран;
модель клеточной мембраны – как искусственно созданное исследователями подобие реальных мембран (прообраз реального объекта), предназначенное для изучения (моделирования) свойств КМ.
Первая модель строения биологических мембран (БМ) была предложена в 1902 году немецким ученым Э. Овертоном.
На основании экспериментально обнаруженных способностей проникать в клетку веществ, растворимых в липидах
Овертон пришел к заключению, что БМ состоит из тонкого слоя фосфолипидов. На границе раздела полярной и неполярной сред молекулы фосфолипидов образуют тонкий монослой, в котором полярные «головки» молекул фосфолипидов погружены в полярную среду
(например, в воду), а неполярные «хвосты» молекул обращены в сторону неполярной среды (например, воздуха).
79

В 1925 году ученые Гортер и Грендел проводили опыты по экстрагированию липидов из мембран эритроцитов и установили, что площадь монослоя липидов, извлеченных из мембран, примерно в два раза больше площади поверхности эритроцитов. Это обстоятельство позволило исследователям сделать заключение о том, что в составе БМ липиды образуют двойной слой. Так появилась билипидная модель БМ (см. рисунок 24).
Чуть позже появились экспериментальные данные, которые свидетельствовали о том, что многие физические свойства (диэлектрическая проницаемость, удельная емкость, поверхностное натяжение и т.д.) клеточных мембран и липидного бислоя  различаются количественно.
различаются количественно.
Данное обстоятельство указывало на то, что строение
Рисунок 25. Структура |
БМ более сложное, чем простой |
биологической мембраны |
липидный бислой. |
В 1935 году Даниелли и Девсон устранили имеющиеся противоречия – они высказали идею, что в состав БМ, помимо липидов, входят еще и молекулы белков. Исследователи предложили так называемую
«бутербродную» или «сэндвичную» модель БМ – липидные слои располагаются между двумя слоями белковых молекул наподобие бутерброда.
Современная модель строения БМ была выдвинута в 1972 году Сингером и Никольсоном и получила название жидкостно-мозаичной модели.
80
