
- •Глава1. История развития биоорганической химии …………………………………
- •Глава 2. Лекции по биоорганической химии …………………………………………
- •Глава 1
- •1.. Характеристика химических связей в биоорганических соединениях
- •2. Сопряженные системы
- •2.1. Общие понятия о строении сопряженных систем
- •Ациклические сопряженные системы. Особенности электронного строения
- •2 . 3 . Циклические сопряженные системы. Ароматичность
- •2. 3. 2. Медико-биологическое значение карбоциклических ароматических
- •2. 3. 3. Гетероциклические ароматические соединения
- •Медико- биологическое значение гетероциклических ароматических соединений
- •2.1. Взаимное влияние атомов в молекулах биоорганических соединений.
- •2.2. Кислотно-основные свойства органических соединений
- •Электроотрицательности атома, несущего неподеленную пару электронов.
- •Влияние природы заместителя
- •2.3. Медико- биологическое значение изучения темы « Кислотно-основные
- •3.1. Виды изомерии
- •3.2. Структурная изомерия.
- •3.2.1. Изомерия скелета
- •3.3. Динамическая изомерия.
- •3. 3.1. Кето-енольная таутомерия.
- •3.3.2. Лактим-лактамная таутомерия
- •3.4 Пространственная изомерия
- •3.4.1 Геометрическая( цис, транс) изомерия
- •Оптическая ( зеркальная) изомерия
- •Пространственное строение шестичленных циклов
- •3.4.4. Медико-биологическое значение стереоизомерии
- •4.1 Классификация реакций в биоорганической химии
- •4.1.1 Типы разрыва химических связей
- •4.1.2. Гомолитический тип разрыва связей.
- •4.1.3. Гетеролитический тип разрыва связей
- •Механизмы биоорганических реакций
- •4.2.1. Реакции электрофильного присоединения в ряду алкенов(а е)
- •4.2.2. Реакции нуклеофильного присоединения
- •Образование полуацеталей и ацеталей
- •Присоединение натрия гидросульфита
- •7. Реакции у α- углеродного атома в карбонильных соединениях
- •8. Альдольная конденсация
- •1. Реакция нитрования
- •2. Реация сульфирования
- •3. Реакция галогенирования
- •4. Реакция алкилирования
- •4.2.4. Реакции нуклеофильного замещения ( s n )
- •Окислительно-восстановительные реакции ( оксидо-редуктазные)
- •Лекция 5 карбоновые кислоты и их гетерофункциональные
- •5.1. Классификация карбоновых кислот
- •5.2. Строение карбоксильной группы
- •5.2.1. Значение величин рКа некоторых карбоновых кислот :
- •5.3. Химические свойства карбоновых кислот
- •Этилацетат
- •5.4. Характеристика отдельных представителей монокарбоновых кислот ,
- •Масляная кислота ( н- бутановая кислота)
- •5.5. Непредельные монокарбоновые кислоты
- •5.6. Дикарбоновые кислоты
- •5.7. Непредельные ди- и трикарбоновые кислоты
- •5.8. Гидроксикислоты
- •5.8.3. Дигидроксидикарбоновые кислоты
- •5.9. Oксокарбоновые кислоты( альдегидо -, кетокарбоновые кислоты)
- •5.10 Приложение : Происхождение названий карбоновых кислот Сn н2n о2
- •6.1. Определение « липиды»
- •Классификация липидов
- •6.3. Основные представители липидов
- •6.3.1. Природные высшие карбоновые кислоты
- •Образование соли
- •3. Тиоэфиры
- •4. Дегидрирование насыщенной кислоты в активной форме с участием фермента.
- •6.3.2. Триацилглицерины( триглицериды)
- •6.3.3. Фосфатиды ( фосфолипиды ) и фосфатидовая кислота
- •Холестерин( холестерол) и его производные
- •6. 4. Принципы создания липотропных лекарственных препаратов
- •6.5 . Строение и химический состав мембран клеток
- •7.1. Номенклатура, особенности пространственного и структурного строения природных аминокислот
- •7. 2 Классификация природных аминокислот
- •7. 3 Физические свойства природных аминокислот
- •7.4 Поведение аминокислот в водных растворах: образование цвиттер-ионов, изменение заряда и электрофоретической подвижности в зависимости от рН-среды. Изоэлектрическая точка
- •7.5. Качественная реакция обнаружения аминокислот
- •7. 6 . Химические свойства аминокислот
- •7 .6. 1 Химические свойства аминокислот in vitro
- •7.6.2. Химические свойства аминокислот in vivo
- •7.7. Строение витамина в6 и механизм реакции с его участием
- •7.8. Реакция поликонденсации, образование полипептидов
- •7. 9. Медико - биологическое значение аминокислот
- •7. 10. Применение аминокислот и их производных в качестве
- •Незаменимые аминокислоты обозначены звездочкой*
- •8.1. Определения « пептид» «белок»
- •8.2. Классификация белков
- •8.3. Строение пептидов и белков.
- •8.3.1. Первичная структура белка
- •8.3.2. Вторичная структура белка
- •8.3.3. Третичная и четвертичная структура белка
- •8.4. Физико-химические свойства белка
- •8.4.1. Амфотерность - кислотно- основные свойства белков.
- •8.4.2. Денатурация белка
- •8.5. Качественные реакции обнаружения белков в биологических объектах.
- •8. 6. Приложение. История развития химии белков
- •9. 1. Классификация углеводов
- •9.2. Моносахариды
- •9.3. Изомерия моносахаридов. Стереоизомерия. L- и д- ряды. Диастереомеры, энантиомеры, эпимеры. Значение отдельных представителей
- •9.4 Химические свойства моносахаридов
- •9.4. 3. Фосфорные эфиры
- •9.4.3 Образование гликозидов
- •9.4.4. Реакции восстановления
- •9.4.5 Реакции окисления моносахаридов
- •9.5. Биологическое значение моносахаридов и их производных.
- •10.1. Олигосахариды. Дисахариды
- •10.1.1. Нередуцирующие дисахариды
- •10.1.2 Редуцирующие дисахариды.
- •10.2. Полисахариды
- •10.2.1. Гомополисахариды
- •11.1. Классификация нуклеиновых кислот, отличия в строении и составе как следствие различных биологических функций
- •11.2. Азотистые основания нуклеиновых кислот
- •Азотистые т основания- производные пиримидина
- •11.2.2. Азотистые основания- производные пурина( аденин, гуанин)
- •11.3. Нуклеозиды
- •11.4. Нуклеотиды
- •11.5. Строение нуклеиновых кислот
- •11.6. Метаболизм пуриновых соединений в клетке
- •11.7. Биологически важные соединения- мононуклеотиды, динуклеотиды- участники важнейших биохимических процессов
- •11.8 Приложение . Справочные материалы к теме лекции
- •1953 – Дж. Уотсон и ф. Крик - модель двухцепочечной структуры днк.
- •12.1 Современная концепция создания биоорганических соединений –
- •12.1.1. Особые химические требования к лекарственному веществу
- •12.1.3. . Пути поиска и создания лекарственных препаратов
- •12.1.4 Классификация лекарственных веществ
- •12.2 Синтез, химические и физические свойства лекарственных соединений
- •12.2.1. Производные 4-аминобензойной кислоты
- •12.2.2. Производные 4-аминобензолсульфокислоты
- •Hso3Cl сульфохлорирование h2nr’ амин
- •Ацетиланилин
- •12. 2. 3. Лекарственные средства, производные салициловой кислоты
- •12.2.4. Лекарственные средства, производные 4 –аминофенола
- •12.2.5 Лекарственные средства на основе пиридинкарбоновых кислот
- •12. 2. 6. Производные пиримидина
- •12. 2 .7. Производные пурина- кофеин, теофиллин, теобромин
- •13.1. Номенклатура алкалоидов
- •13.2. Классификация алкалоидов
- •13. 3. Функции алкалоидов
- •13.4. Содержание в растениях
- •13.5. Качественные реакции обнаружения алкалоидов
- •13.6. Фармакологическая активность- общий взгляд
- •13.7. Отдельные представители
- •13. 7.1. Алкалоиды группы фенилэтиламина
- •7.2 Производные пяти – и шестичленных гетероциклических соединений
- •137.3. Группа тропана
- •13.8. Витамины
- •Действие в организме
- •Стадии зрительного процесса на сетчатке глаза
- •14.1. Полимеры-определение. Виды полимеров
- •14. 2. Классификация вмс
- •14.3. Реакции полимеризации
- •14.3.1. Номенклатура полимеров.
- •14.3.2 . Общая характеристика мономеров.
- •14.3.3. Механизмы реакции полимеризации
- •14.4. Радикальная полимеризация
- •14.5. Ионная полимеризация
- •14.5.1. Катионная полимеризация
- •14.5.2. Анионная полимеризация
- •14.6. Координационная полимеризация
- •14.7.1. Блочная полимеризация
- •14.7.2. Эмульсионная полимеризация
- •14.7.3. Полимеризация в растворе
- •14.8. Конфигурация полимеров
- •14. 10. Физическое состояние полимеров
- •14.10.1. Аморфные полимеры
- •14 10.2. Кристаллические полимеры
- •14.11. Натуральный каучук
- •14.12 . Конденсационные полимеры
- •14. 13 Основные представители вмс
- •2. Структурные формулы биоорганических соединений
- •Сопряженные соединения
- •Карбоновые кислоты (указаны тривиальные названия)
- •Незаменимые аминокислоты обозначены звездочкой -*
- •Углеводы и их производные
- •Азотистые основания и их производные
- •1. Теоретические положения строения и свойств биоорганических
- •2. Важнейшие биополимеры организма
- •3. Липиды и низкомолекулярные регуляторы метаболизма.Важнейшие группы лекарственных средств
- •Курс лекций по биоорганической химии
- •060103 – Педиатрия
- •060104 –Медико-профилактическое дело
- •060105 - Стоматология
Незаменимые аминокислоты обозначены звездочкой*
|
Общая формула α-L-аминокислот в проекции Фишера |
|
Алифатические аминокислоты
|
Глицин
|
Аланин |
|
Валин*
|
Лейцин* |
|
Изолейцин*
|
|
Кислые аминокислоты
|
Аспарагиновая кислота |
Глутаминовая кислота
|
Основные аминокислоты
|
Аргинин |
Лизин* |
|
Орнитин
|
|
Аминокислоты, содержащие амидную группу
|
Глутамин
|
Аспарагин |
Серусодержащие аминокислоты
|
Цистеин
|
Метионин* |
Гидроксиаминокислоты
|
Серин
|
Треонин* |
Карбоциклические ароматические аминокислоты
|
Фенилаланин*
|
Тирозин |
Гетероциклические ароматические аминокислоты
|
|
Гистидин |
Циклические аминокислоты
|
Пролин |
4-гидроксипролин |
Для полного усвоения темы надо знать формулы биогенных аминов( ГАМК, ß- аланин, аминоэтанол, 2-аминоэтантиол, гистамин) и амидов- глутамина и аспарагина.
Кислотно-основные свойства аминокислот
-
аминокислота
рКа( СООН)
рКа( NH2)
{ a }D(в воде)
аланин
2,35
9,87
+ 8,5
4-аминомасляная кислота
4.03
10.56
аргинин
1,82
8,99
+ 12,5
аспарагин
2,14
8,72
+ 28.0
аспарагиновая кислота
1,99; 3,80
9,90
+ 25
валин
2,29
9,74
+28,3
глицин
2,35
9,78
глутаминовая кислота
2,10; 4, 07
9,47
+12,0
глутамин
2,17
9,13
+6,3
лейцин
2,33
9,74
- 11,0
лизин
2,16
9,06; 10,54( а)
+13,5
пролин
1,95
10,64
-86,2
серин
2,19
9,21
-7,5
тирозин
2,20; 10,41(ОН)
9,21
треонин
2,09
9,10
триптофан
2,46
9,41
-33,7
фенилаланин
2,20
9,31
-34,5
цистеамин(меркамин)
8.35( SH )
10,81
цистеин
1,92; 8,37( SH )
10,70
-16,5
-
Сравните кислотные свойства( по первой группе) аспарагиновой и глутаминовой кислот.
-
Сравните основные свойства а- и ω- аминогрупп лизина. Подтверждают ли эти
данные схему образования цвиттер- иона?
ЛЕКЦИЯ 8
ПОЛИПЕПТИДЫ. БЕЛКИ
Содержание лекции
8.1. Определения « пептид», «белок»
Биологические функции пептидов и белков.
-
Классификация белков
-
Строение пептидов и белков
8.3.1.Пептиды. Образование пептидной связи, ее электронное строение (делокализация, NН кислотный центр, таутомерия);
8.3.2.Вторичная структура белка. Белки глобулярные и фибрилярные. Характер
внутри- и межмолекулярных взаимодействий;
8.3.3. Третичная и четвертичная структура белка. Стабилизация глобулярных белков
(ионные, ковалентные, дисперсионные связи). Гидрофильные и гидрофобные
участки; Роль SH групп пептидов и белков в биологических процессах.
8.4. Физико-химические свойства белка ( амфотерные свойства, изоэлектрическая точка, способность к диализу, электрофорез белков) . Денатурация белков.
-
Качественные реакции обнаружения белков в биологических объектах
8.6. Приложение . История развития химии белков.
Исходный уровень знаний для усвоения темы:
Теория Бренстеда-Лоури кислотно-основных свойств биоорганических соединений, классификация аминокислот, амфотерные свойства аминокислот, реакция нуклеофильного замещения - образование , гидролиз амидов, понятия «водородная связь», «изоэлектрическая точка», определение интервала значений рI аминокислот, химические свойства тиольных групп.
Ключевые слова к теме
C- концевая аминокислота, N- концевая аминокислота, белок( глобулярный, фибриллярный), денатурация, качественные реакции,, пептид, пептидная связь, а – спираль, структура белка( первичная, вторичная, третичная, четвертичная), фермент, электрофорез.













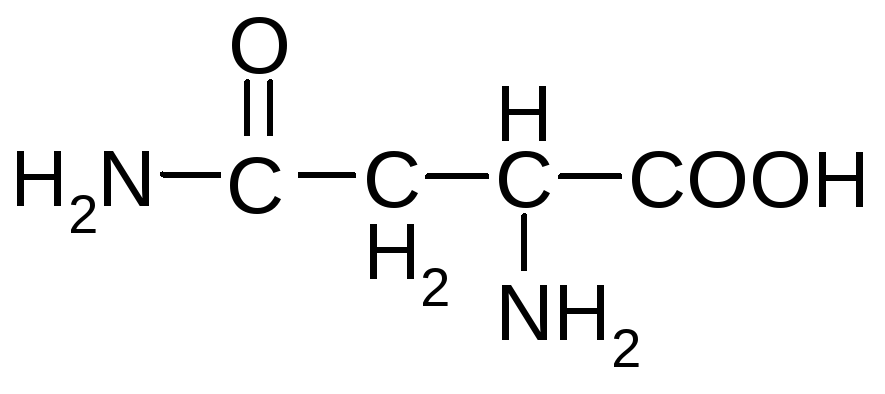
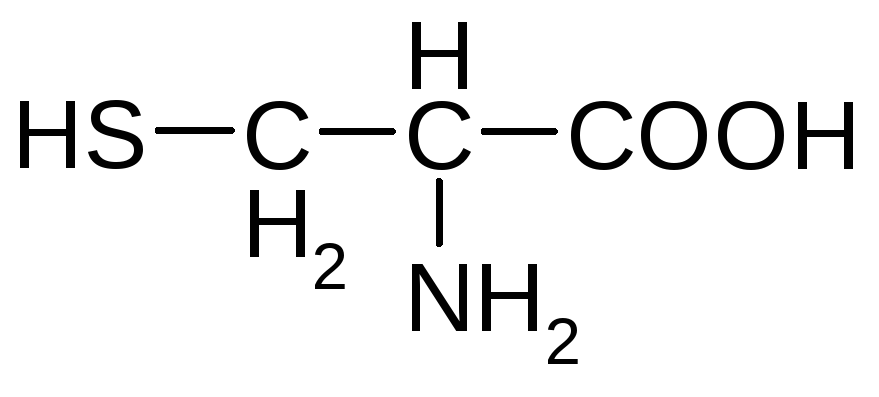





 Триптофан*
Триптофан*

