
Материаловедение
.pdf
1.2. Основные группы полупроводниковых материалов |
11 |
турных дефектов состоит в основном в том, что они изменяют число носителей заряда. Возможность изменять электрические свойства полупроводника путем точной дозировки добавляемых примесей или путем получения контролируемого числа структурных дефектов имеет огромное технологическое значение и дает основу для массового производства полупроводниковых приборов. Более того, само требование высокой степени чистоты и структурного совершенства явилось одной из основных причин того, что широкое применение полупроводников и развитие полупроводниковой техники стали возможны только с конца 40-х годов этого века, хотя первые упоминания о полупроводниках относятся еще к 1833 году.
Таким образом, различие в типах химической связи приводит к резкому различию энергетических и кристаллических структур материалов и их физических свойств.
1.2.Основные группы полупроводниковых материалов
В настоящее время известно 104 химических элемента, из них 79 металлов и 25 неметаллов. Среди последних 13 элементов проявляют полупроводниковые, а остальные 12 — диэлектрические свойства (см. табл. 1.1).
Но кроме элементарных полупроводников насчитываются сотни и даже тысячи соединений, твердых растворов, обладающих полупроводниковыми свойствами. Поэтому было бы целесообразно классифицировать полупроводниковые материалы.
Все полупроводники могут быть разделены на кристаллические и некристаллические.
В настоящем курсе не будут рассматриваться особенности материаловедения и технологии некристаллических полупроводников, которые обычно выделяются в особый раздел физики полупроводников и о которых можно прочитать в специальной литературе [7, 8]. Однако для полноты классификации дадим о них самые общие сведения.
К числу некристаллических полупроводников относятся: аморфные полупроводники (a-Si, a-Ge, Se, Sb, Te); жидкие полупроводники (расплавленный Se, Te, расплавы оксидов, сульфидов, селенидов и теллуридов некоторых металлов); стеклообразные полупроводники.2 Наибольшее распространение среди стеклообразных полупроводников получили халь-
2Стекла — сильно переохлажденные жидкости с очень большой вязкостью.

12 |
Глава 1. Основные свойства и группы полупроводников |
когенидные (сплавы P, As, Sb, Bi с S, Se, Te, например, As2Se3, As2S3, As2Te3) и оксидные (V2O5 − P2O5 − MeOx).3
Общей чертой некристаллических полупроводников является отсутствие дальнего порядка в расположении атомов, результатом которого оказываются существенные изменения в энергетическом спектре и низкая подвижность носителей заряда.
Исследования дифракции рентгеновских лучей, электронов и исследование дальней тонкой структуры рентгеновских спектров поглощения (EXAFS-спектроскопия) показывают, что ближайшее окружение и межатомные расстояния в некристаллических полупроводниках практически не отличаются от их кристаллических аналогов. Таким образом, можно сделать вывод, что полупроводниковые свойства материалов обусловлены ближним порядком (типом связи), а не дальним порядком (кристаллической структурой материалов).
Среди кристаллических полупроводников часто выделяют группы со сходными теми или иными свойствами. Так по количеству входящих в состав вещества компонент можно выделить:
1)элементарные (гомеополярные) полупроводники: C, Si, Ge, α-Sn, P, As, Sb, Bi, S, Se, Te, I, B. Важнейшими представителями этой группы являются Ge и Si — основные материалы полупроводниковой электроники. Германий и кремний имеют кубическую структуру типа алмаза, где каждый атом окружен 4 ближайшими соседями (см. гл. 2).
2)гетерополярные полупроводники (бинарные, трехкомпонентные и так далее).
Вэтом курсе будут рассматриваться в основном только элементарные
ибинарные полупроводники, что позволит на простых примерах выявить общие закономерности, характерные для полупроводников, и более детально разобраться в физико-химических проблемах, которые возникают при получении этих материалов. Кроме того, следует отметить, что в электронной промышленности из-за сложностей получения чистых многокомпонентных материалов, как правило, применяются элементарные и бинарные полупроводники.
Среди бинарных полупроводников выделим наиболее изученные и широко используемые группы полупроводниковых соединений. В одну группу обычно включают соединения с одинаковой стехиометрической формулой, то есть образованные из элементов, расположенных в одних и тех же группах периодической системы элементов Д. И. Менделеева.
а) Алмазоподобные полупроводники.
3Me — металлы I–VI групп.

Таблица 1.1. Фрагмент таблицы периодической системы Д. И. Менделеева. Для каждого элемента в нижней строке
˚
указаны его атомный радиус (в A) (слева) и величина электроотрицательности по Полингу (справа) [20].
I |
|
II |
|
III |
IV |
V |
VI |
VII |
|
|
VIII |
|
|
|
|
||||||
H |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
He |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
0.78 |
2.1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1.28 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Li |
3 |
Be |
4 |
5 |
B |
6 |
C |
7 |
N |
8 |
O |
9 |
F |
|
|
|
|
|
|
10 |
Ne |
1.52 |
1.0 |
1.13 |
1.5 |
1.31 |
2.0 |
0.77 2.5 |
0.71 |
3.0 |
0.66 |
3.5 |
0.58 |
4.0 |
|
|
|
|
|
|
|
|
|
Na |
11 |
Mg |
12 |
13 |
Al |
14 |
Si |
15 |
P |
16 |
S |
17 |
Cl |
|
|
|
|
|
|
18 |
Ar |
1.54 |
0.9 |
1.60 |
1.2 |
1.43 |
1.5 |
1.17 |
1.8 |
1.15 |
2.1 |
1.04 |
2.5 |
0.99 |
3.0 |
|
|
|
|
|
|
1.74 |
|
K |
19 |
Ca |
20 |
Sc |
21 |
Ti |
22 |
V |
23 |
Cr |
24 |
Mn |
25 |
Fe |
26 |
Co |
27 |
Ni |
28 |
|
|
2.27 |
0.8 |
1.97 |
1.0 |
1.61 |
1.3 |
1.45 |
1.5 |
1.32 |
1.6 |
1.25 |
1.6 |
1.24 |
1.5 |
1.24 |
1.8 |
1.25 |
1.8 |
1.25 |
1.8 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
29 |
Cu |
30 |
Zn |
31 |
Ga |
32 |
Ge |
33 |
As |
34 |
Se |
35 |
Br |
|
|
|
|
|
|
36 |
Kr |
1.28 |
1.9 |
1.33 |
1.6 |
1.22 |
1.6 |
1.22 |
1.8 |
1.25 |
2.0 |
1.17 |
2.4 |
1.14 |
2.8 |
|
|
|
|
|
|
1.89 |
|
Rb |
37 |
Sr |
38 |
Y |
39 |
Zr |
40 |
Nb |
41 |
Mo |
42 |
Tc |
43 |
Ru |
44 |
Rh |
45 |
Pd |
46 |
|
|
2.47 |
0.8 |
2.15 |
1.0 |
1.81 |
1.2 |
1.60 |
1.4 |
1.43 |
1.6 |
1.36 |
1.8 |
1.36 |
1.9 |
1.34 |
2.2 |
1.34 |
2.2 |
1.38 |
2.2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
47 |
Ag |
48 |
Cd |
49 |
In |
50 |
Sn |
51 |
Sb |
52 |
Te |
53 |
I |
|
|
|
|
|
|
54 |
Xe |
1.44 |
1.9 |
1.49 |
1.7 |
1.63 |
1.7 |
1.40 |
1.8 |
1.82 |
1.9 |
1.43 |
2.1 |
1.33 |
2.5 |
|
|
|
|
|
|
2.18 |
2.6 |
Cs |
55 |
Ba |
56 |
La |
57 |
Hf |
72 |
Ta |
73 |
W |
74 |
Re |
75 |
Os |
76 |
Ir |
77 |
Pt |
78 |
|
|
2.65 |
0.7 |
2.17 |
0.9 |
1.88 |
1.1 |
1.56 |
1.3 |
1.43 |
1.5 |
1.37 |
1.7 |
1.37 |
1.9 |
1.35 |
2.2 |
1.36 |
2.2 |
1.38 |
2.2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
79 |
Au |
80 |
Hg |
81 |
Tl |
82 |
Pb |
83 |
Bi |
84 |
Po |
85 |
At |
|
|
|
|
|
|
86 |
Rn |
1.44 |
2.4 |
1.60 |
1.9 |
1.70 |
1.8 |
1.75 |
1.8 |
1.55 |
1.9 |
1.67 |
2.0 |
|
2.2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Fr |
87 |
Ra |
88 |
Ac |
89 |
Ku 104 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2.7 |
0.7 |
2.23 |
0.9 |
1.88 |
1.1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
материалов полупроводниковых группы Основные .2.1
13

14 |
Глава 1. Основные свойства и группы полупроводников |
Стехиометрическая формула этих полупроводников — ANB8−N, где A и B — компоненты соединения, N — номер группы компонента A в периодической таблице Менделеева. Компоненты этих соединений расположены симметрично относительно IV группы в таблице Менделеева.
Соединения имеют гранецентрированную кубическую решетку и кристаллизуются в структурах типа алмаза или сфалерита (цинковой обманки), либо гексагональную решетку и кристаллизуются в структуре типа вюртцита.
Физические свойства соединений элементов VI группы в значительной мере определяются концентрацией собственных точечных дефектов структуры (см. гл. 3), проявляющих электрическую активность (центры рассеяния и рекомбинации).
Полупроводники ANB8−N находят широкое применение во многих областях техники и, прежде всего, в оптоэлектронных приборах.
К ним относятся:
AIIIBV — GaAs, InSb, InP, GaSb, GaP, AlSb (структура сфалерита). AIIBVI — CdSe, CdTe, HgTe, ZnS, ZnSe (структура сфалерита); CdS,
CdSe, ZnS, ZnSe (структура вюртцита).4
AIBVII (кристаллизующиеся в кубической структуре типа сфалерита) — CuBr, AgI.
AIVBIV — β-SiC (структура сфалерита).
б) Халькогениды элементов четвертой группы.
Стехиометрическая формула этих полупроводников — AIVBVI. Типичные представители — PbS, PbTe, SnTe.
Эти материалы имеют гранецентрированную кубическую решетку типа NaCl или слабо искаженные структуры на ее основе. Они имеют узкую запрещенную зону и используются как источники и приемники ИК-излучения. Собственные точечные дефекты структуры в AIVBVI имеют низкую энергию ионизации и проявляют электрическую активность.
в) Халькогениды элементов пятой группы.
Стехиометрическая формула этих материалов — AV2 BVI3 . К этой группе относятся халькогениды мышьяка (As2S3, As2Se3, As2Te3), кристаллизующиеся в структуры с моноклинной решеткой; халькогениды сурьмы (Sb2Se3, Sb2S3) — соединения с ромбической решеткой; халькогениды висмута (Bi2Te3, Bi2Se3) — соединения с ромбоэдрической решеткой.
Халькогениды сурьмы и висмута используются для создания полупроводниковых термоэлектрических генераторов.
4Обратите внимание на то, что некоторые из приведенных полупроводников существуют
вдвух кристаллических модификациях.
1.2. Основные группы полупроводниковых материалов |
15 |
Среди гетерополярных полупроводников принято также выделяют следующие группы полупроводников:
а) Магнитные полупроводники [9, 10].
Во всех этих материалах присутствуют атомы с частично заполненными d- и f-оболочками (атомы переходных металлов и редкоземельных элементов). Отличительной особенностью многих из них является возникновение магнитного упорядочения при низких температурах.
Эта группа включает такие соединения как, например, EuS, EuSe, MnTe, простые (NiO, CoO, FeO, ZnO, EuO, Cu2O) и сложные окислы переходных металлов, например, ферриты типа MeO·Fe2O3 или MeFe2O4 (ZnFe2O4, MnFe2O4), кристаллизующиеся в структуре шпинели.
Эти материалы находят применение в радиотехнических приборах, оптических устройствах, управляемых магнитным полем, и в волноводных устройствах СВЧ. Оксидные полупроводники (NiO, ZnO, EuO, Cu2O) используются как разнообразные датчики — температуры, химического состава газа.
б) Полупроводники-сегнетоэлектрики [11,12].
Отличительными особенностями этой группы кристаллов является наличие электрических моментов в кристалле и возникновение спонтанной поляризации при понижении температуры.
Типичным примером этих материалов являются полупроводники со структурой перовскита и стехиометрической формулой ABO3. Их примером могут служить BaTiO3 и PbTiO3. К этой же группе полупровод- ников-сегнетоэлектриков относятся и некоторые соединения AIVBVI — GeTe и SnTe.
Используются эти материалы при создании запоминающих и нели- нейно-оптических устройств, в качестве пьезодатчиков.
в) Органические полупроводники: антрацен, нафталин, фталоцианины, поливинилкарбазол [13,14].
В последние годы наметился существенный прогресс в использовании этих материалов в разных областях техники, например, для создания транзисторов и оптоэлектронных приборов.
Такое деление полупроводников можно было бы продолжить и дальше, однако остановимся на приведенных наиболее часто выделяемых группах.
Изучение курса основы материаловедения и технологии полупроводников начнем с обсуждения природы химических связей и анализа особенностей химической связи в полупроводниках.
Глава 2
Основы теории химической связи и закономерности образования полупроводников
2.1. Электронная конфигурация свободных атомов
Химическая связь в твердых телах образуется в результате взаимодействия атомов (ионов). Наиболее существенным результатом этого взаимодействия является расщепление энергетических уровней валентных электронов свободных атомов и образование энергетических зон. С другой стороны, взаимодействие электронов данного атома и соседних атомов не разрушает полностью исходную структуру электронных уровней отдельных атомов. Эти два факта дают основание считать, что электронное строение свободных атомов и, прежде всего, строение их валентных оболочек определяет химическую связь, характер ближнего порядка и, в конечном счете, электронные свойства твердых тел. Периодическая таблица элементов Д. И. Менделеева отражает закономерности электронного строения свободных атомов.
Структура энергетического спектра свободных атомов рассчитывается с помощью методов квантовой механики. Простейшим атомом является атом водорода, обладающий единственным электроном. Уравнение Шредингера для него имеет точное решение и позволяет провести классификацию состояний электрона в атоме. Отметим, что изучение атома водорода дает основу для классификации состояний любого атома, так как электронная структура атома водорода имеет ряд существенных черт, характерных для электронной структурой более сложных атомов.
2.1. Электронная конфигурация свободных атомов |
17 |
||
Уравнение Шредингера для атома водорода можно записать в виде |
|
||
|
|
ˆ |
(2.1) |
|
|
Hψ = Eψ, |
|
ˆ |
2 |
— гамильтониан (pˆ = −i — оператор импульса, |
|
где H |
= pˆ 2/2m + U |
||
U(r) = −e /r — потенциальная энергия электрона в поле, созданном неподвижным ядром, m — масса электрона, e — заряд электрона, r — радиус-вектор электрона), ψ(r) — волновая функция электрона (|ψ(r)|2 определяет плотность вероятности нахождения электрона в данной точке пространства), а E — энергия состояния электрона.
Для сферически симметричного потенциала U(r) уравнение (2.1) проще всего решать в сферической системе координат. В этом случае уравнение Шредингера для атома водорода допускает разделение переменных. Собственные волновые функции уравнения (2.1) ищутся в виде ψ = R(r)Θ(ϑ)Φ(ϕ), где r, ϑ, ϕ — сферические координаты. Решение этих уравнений совместно с соответствующими граничными условиями приводит к появлению трех целочисленных квантовых чисел n, l, ml, которые служат параметрами для собственных волновых функций уравнения (2.1), описывающих состояния электрона в атоме. Учет спина электрона приводит к появлению четвертого квантового числа ms. Полная волновая функция электрона равна произведению координатной и спиновой волновых функций. Пространственная (координатная) часть волновой функции электрона в атоме называется атомной орбиталью.
Таким образом, собственные волновые функции уравнения (2.1) зависят от четырех параметров (четырех квантовых чисел): n, l, ml, ms.
Волновые функции электрона, имеющие одинаковые n, l и ml, образуют орбиталь. Совокупность орбиталей, имеющих одинаковые n и l, образует оболочку. Совокупность оболочек с одинаковым n образует электронный слой.
Главное квантовое число n может принимать значения 1, 2, 3, ... и определяет номер слоя. Слои с n = 1, 2, 3, 4, ... принято обозначать буквами K, L, M, N и т. д. Величина n характеризует удаленность электрона от атомного ядра.
Орбитальное квантовое число l определяет величину момента количества движения электрона относительно ядра (или симметрию электронного облака); l может иметь значения от 0 до (n − 1). Оболочки с l = 0, 1, 2, 3 называются s-, p-, d-, f-орбиталями соответственно.
Орбитальное магнитное квантовое число ml характеризует проекцию момента количества движения электрона на некоторое выделенное направление в пространстве; ml может принимать значения от −l до l (включая ноль).
18 |
Глава 2. Основы теории химической связи |
Спиновое магнитное квантовое число ms характеризует собственный механический момент электрона (ориентацию в пространстве вектора спина электрона); ms может принимать только два значения: +1/2 и −1/2.
Можно показать, что уравнение (2.1) имеет решения при любых положительных значениях энергии и при дискретных отрицательных значениях энергии, равных
|
|
|
|
me4 1 |
|
e2 1 |
13.6 |
|
|
|||||
|
|
|
En = − |
|
|
= − |
|
|
|
= − |
|
эВ, |
(2.2) |
|
|
|
|
2 2 |
|
n2 |
2a0 |
|
n2 |
n2 |
|||||
2 |
/me |
2 |
|
˚ |
|
|
|
|
|
|
|
|
||
где a0 = |
|
= 0.529 A — боровский радиус. Случай E > 0 соответ- |
||||||||||||
ствует делокализованным состояниям, характеризуемым волновым вектором и проекцией спина (электрон пролетает вблизи ядра и удаляется вновь на бесконечность). Случай E < 0 соответствует локализованным электронным состояниям, характеризуемым набором квантовых чисел n, l, ml и ms (электрон находится в пределах атома). Видно, что значения энергии для интересующего нас второго случая зависят от квантового числа n и не зависят от l, ml и ms. Именно поэтому число n и называется главным квантовым числом. Таким образом, каждому En соответствует несколько волновых функций ψn,l,ml,ms , отличающихся значениями квантовых чисел l, ml, ms. Это означает, что атом водорода может иметь одно и то же значение энергии, находясь в нескольких различных состояниях, то есть энергетические уровни вырождены, причем кратность вырождения равна 2n2.
Рассмотрим пространственные части (без учета спина электрона) собственных функций, являющихся решениями волнового уравнения (2.1), в порядке возрастания энергии, то есть n. Функции |ψn,l,ml |2 описывают пространственное распределение электронной плотности вокруг ядра и имеют независимые друг от друга радиальные R(r) и угловые Θ(ϑ)Φ(ϕ) части.
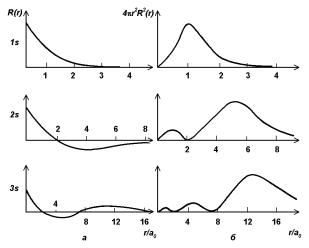
Радиальная часть R(r) волновой функции определяет распределение электронной плотности по радиусу от ядра. На рис. 2.1,а показаны радиальные части первых трех s-орбиталей. Отметим, что 1s-функция никогда не меняет знака, 2s-функция меняет его один раз, а 3s-функция — дважды. На рис. 2.1,б показано изменение электронной плотности с расстоянием от ядра для этих орбиталей. Электронная плотность концентрируется на все большем расстоянии от ядра по мере того, как значение n растет. Обычно радиальная функция плотности имеет самое большое значение за последней поверхностью, на которой R(r) = 0. Для p-, d- и f-орбиталей картины похожи.
2.1. Электронная конфигурация свободных атомов |
19 |
Рис. 2.1. Зависимость радиальной части волновой функции R(r) от r/a0 для трех
первых s-орбиталей (а) и соответствующие радиальные функции распределения электронной плотности 4πr2R2(r) (б).
Рассмотрим угловые части Θ(ϑ)Φ(ϕ) волновых функций. Они определяют угловое распределение электронной плотности — вероятность найти электрон в определенном направлении, рассчитанную на единицу телесного угла.
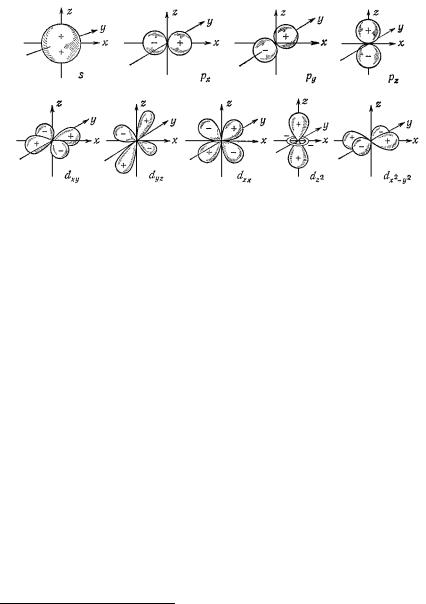
s-орбитали. В каждом электронном слое существует лишь одна s-орбиталь. Все s-орбитали сферически симметричны (рис. 2.2), так как все они описываются волновой функцией, которая не зависит от углов ϑ и ϕ (таково решение волнового уравнения).
p-орбитали. Начиная с n = 2 появляются p-орбитали. Каждый электронный слой, у которого существует l = 1, имеет 2l + 1 = 3 p-орбитали, которые зависят от углов ϑ и ϕ. Эти три p-орбитали называются px, py, pz, так как они полностью симметричны относительно осей x, y, z соответственно, но меняют знак при инверсии (на рис. 2.2 это показано с помощью знаков + и −).
Для n = 3 и 4 появляются еще d- (l = 2) и f-орбитали (l = 3) соответственно. При этом каждый электронный слой должен иметь пять d-орбиталей (рис. 2.2) и семь f-орбиталей. Все орбитали с одним и тем же n имеют сходное радиальное распределение электронной плотности и существенно различные угловые распределения.
Такова классификация состояний электрона в атоме водорода.
20 |
Глава 2. Основы теории химической связи |
Рис. 2.2. Орбитали s-, p- и d-типа.
Перейдем к рассмотрению свободных многоэлектронных атомов. Структура энергетического спектра сложных атомов обладает значительным сходством со структурой спектра атома водорода. Физическая причина этого сходства заключается в том, что и в более сложных атомах каждый электрон находится под действием приблизительно центральных сил с центром, расположенным на ядре. Как и в случае атома водорода, потенциальная энергия отдельного электрона является и в рассматриваемом случае функцией только расстояния от ядра. Уравнение Шредингера для многоэлектронного атома, как и для атома водорода, решается в сферических координатах методом разделения переменных, и при его решении находятся аналогичные наборы значений квантовых чисел n, l, ml, ms,1 а выражения для угловых частей собственных волновых функций этого уравнения оказываются точно такими же, как и в случае атома водорода. Однако энергия отдельного электрона теперь оказывается зависящей не только от n, но и от l2 что приводит к расщеплению атомных уровней энергии.
Обсудим причины, по которым снимается вырождение по l в сложных атомах. При расчетах структуры энергетического спектра многоэлектронного атома предполагается, что выделенный электрон в нем не взаимодействует с другими электронами, а ведет себя так, как если бы он был один в электростатическом поле ядра. Однако в этом случае потенциал, действующий на этот выделенный электрон, принципиально отличается
1Однако теперь l, ml, и ms относятся к суммарным моментам всех электронов в атоме. 2Энергия не зависит от ml и ms по соображениям симметрии в данной постановке
задачи, однако реально такая зависимость существует (см. ниже).
