
- •Основы химической технологии Лабораторный практикум Москва 2013
- •Раздел 1 Основные понятия и технологические критерии эффективности химико-технологических процессов
- •1.1. Классификация химико-технологических процессов.
- •1.2. Основные технологические критерии эффективности
- •1.2.1 Степень превращения (степень конверсии) реагента (х) – это отношение количества превращенного реагента к введенному в реакционную систему количеству этого реагента.
- •1.2.2 Выходом продукта по данному реагенту называют отношение количества реагента, превратившегося в данный продукт, к количеству этого реагента, введенного в систему.
- •1.2.7. Материальный баланс хтп.
- •1.3. Технологические параметры хтп
- •1.3.1. Время пребывания исходных веществ в реакционной зоне.
- •Раздел 2 Технология неорганических веществ
- •2.1. Каталитическое окисление аммиака
- •2.1.2. Введение
- •2.1.3. Теоретические основы процесса Химия процесса и равновесие.
- •Кинетика процесса.
- •2.1.4. Выбор оптимального технологического режима.
- •2.1.5. Схема лабораторной установки
- •2.1.6. Порядок проведения опыта
- •1. Подготовка колб для отбора газовых проб.
- •2. Техника проведения эксперимента.
- •Экспериментальные и расчетные данные
- •Контроль процесса
- •Анализ газовых фаз
- •Технологические расчеты
- •2.1.7. Задание
- •2.1.8. Техника безопасности
- •Материальный баланс контактного аппарата для окисления аммиака
- •Библиографический список
- •2.2. Электрохимическое получение гидроксида натрия, хлора и водорода диафрагменным методом
- •2.2.2. Введение
- •2.2.3. Теоретические основы процесса
- •Электродные реакции и термодинамика процесса электролиза водного раствора хлорида натрия в диафрагменной ванне.
- •Электродные реакции и потенциалы разряда ионов
- •Кинетика электродных процессов.
- •Выход по току
- •Удельный расход электроэнергии
- •Коэффициент использования электроэнергии
- •Конверсия сырья
- •2.2.4. Выбор оптимального технологического режима
- •Состав электролита
- •Материал электродов
- •Диафрагма
- •2.2.5. Экспериментальная часть
- •Исходные данные
- •Предварительные расчеты
- •Порядок выполнения работы
- •Экспериментальные данные
- •Контроль процесса Определение концентрации щелочи в католите.
- •1. В связи с техническими сложностями измерения объема подаваемого электролита и анализа всех продуктов при расчёте материального баланса делаем следующие допущения:
- •2. Последовательность расчета материального баланса
- •Материальный баланс процесса электролиза
- •Расчет технологических показателей
- •Технологические показатели процесса электролиза
- •2.2.6. Задание
- •2.2.5.Техника безопасности
- •Библиографический список
- •2.3. Контактное окисление оксида серы (IV)
- •2.3.2.Введение
- •2.3.3. Теоретические основы процесса
- •2.3.4. Выбор технологического режима.
- •Зависимость равновесного выхода η* от состава исходной газовой смеси
- •Зависимость равновесного выхода от температуры при различном давлении
- •2.3.5. Расчетная часть Исходные данные
- •2.3.6. Расчет материального баланса.
- •Показатели процесса окисления оксида серы (IV)
- •2.3.7. Задание
- •Приложение Расчёт степени превращения so2 в so3 (степени контактирования)
- •Библиографический список
- •Раздел 3
- •3.1.3. Теоретические основы процесса.
- •Снон(адс) сн2о (газ)
- •3.1.5. Описание лабораторной установки
- •3.1.6. Предварительные расчеты
- •3.1.7. Порядок проведения опыта
- •Исходные и экспериментальные данные
- •Технологические параметры и критерии процесса
- •Экспериментальные данные
- •3.1.8. Контроль процесса
- •3.1.9. Расчет материального баланса контактного аппарата.
- •Материальный баланс контактного аппарата для получения формальдегида.
- •3.1.10. Задание
- •3.2.3. Теоретические основы процесса
- •3.2.5. Описание лабораторной установки.
- •3.2.6. Порядок проведения опыта.
- •Исходные и экспериментальные данные
- •Объем спирта, поступившего в реактор _____мл
- •Контроль процесса
- •Экспериментальные результаты опыта.
- •Данные хроматографического анализа контактного газа
- •3.2.7. Расчет материального баланса реактора
- •Материальный баланс реактора синтеза бутадиена.
- •3.2.8. Задание
- •3.3.3. Теоретические основы процесса
- •Усредненные энергии связей
- •Механизм превращения углеводородов в процессе пиролиза
- •3.3.4. Выбор оптимального технологического режима
- •3.3.5. Описание лабораторной установки
- •3.3.6. Порядок проведения опыта
- •Исходные и экспериментальные данные
- •Экспериментальные данные проведения опыта
- •3.3.7. Расчет материального баланса пиролиза
- •Материальный баланс реактора пиролиза керосиновой фракции.
- •3.3.8. Задание
- •Библиографический список.
- •Раздел 4 Приложение
- •4.1. Хроматографический анализ
- •Характеристики хроматографических пиков
- •Прикладной катализ Химия и технология гомогенного катализа
2.2.2. Введение
Электрохимические методы практически вытеснили ранее применяемые химические, в произвлдстве хлора и его кислородных соединений.
Основным промышленным способом одновременного получения гидроксида натрия, хлора и водорода является электролиз водного раствора хлорида натрия. Существуют два параллельных производства гидроксида натрия: с использованием жидкого ртутного катода (амальгамный метод) и с твёрдым катодом (диафрагменный метод). Последний реализуется в проточных электролитических ваннах с фильтрующей диафрагмой, разделяющей анодное и катодное пространство.
Электролит, находящийся в катодном пространстве называют католитом, в анодном – соответственно анолитом.
Диафрагменный способ прост в аппаратурном оформлении, относительно дешев и не использует ртуть, пары которой опасны для здоровья человека. Однако, необходимо отметить, что гидроксид натрия, получаемый при использовании электролизёра диафрагменного типа, не обладает достаточной чистотой и не может быть использован, например, в производстве искусственного волокна или целлюлозы.
Кроме того, концентрация гидроксида натрия, получаемого диафрагменным методом сравнительно не высока (до 140 г/л) по сравнению с амальгамным – до 600 г/л.
2.2.3. Теоретические основы процесса
Процесс электрохимического получения гидроксида натрия, хлора и водорода, как и любой другой химико-технологический процесс, может быть проанализирован с термодинамической и кинетической точки зрения.
Электродные реакции и термодинамика процесса электролиза водного раствора хлорида натрия в диафрагменной ванне.
Электролиз концентрированного раствора хлорида натрия можно охарактеризовать как сложный гетерогенный процесс, протекающий на границе раздела фаз: твердый электрод – жидкий электролит – газ.
Процесс может быть описан суммарным уравнением:
2NaCl + 2Н2О = 2NaOH + H2 + Cl2 (2.2.1)
электролит катодный анодный
продукт продукт
В реальных условиях получения гидроксида натрия в ванне диафрагменного типа протекают следующие основные электродные реакции:
на катоде выделение водорода (процесс восстановления):
К 2Н2О + 2е- = Н2 + 2ОН- (2.2.2)
на аноде - хлора (процесс окисления):
А 2Cl- – 2e- = Cl2 (2.2.3)
Вероятность протекания различных электродных реакций на катоде и аноде при проведении процесса в стандартных условиях (25 ОС, Р = 1 атм., активность ионов равна 1) можно оценить на основании величины стандартного электродного потенциала (ЕО). На катоде в первую очередь протекают те процессы, стандартный электродный потенциал которых наиболее электроположителен, на аноде реализуются процессы с наиболее электроотрицательным значением ЕО. Стандартные потенциалы электродных реакций, протекание которых принципиально возможно при электролизе раствора хлорида натрия, приведены в табл. 2.2.1.
Таблица 2.2.1.
Электродные реакции и потенциалы разряда ионов
|
№ п/п |
Электродная реакция |
Потенциал разряда, В |
||
|
Стан-дартный, ЕО |
Равно-весный, ЕP |
В условиях электро-лиза, Е |
||
|
1. 2.
3. 4.
|
2Cl- - 2e- = Cl2 4OH- - 4e- = O2 + 2H2O (в нейтр. и кислых р-рах: 2Н2О – 4е- =О2 + 4Н+ ) Na+ + e- = Na 2H3O+ + 2e- = H2 +2H2O (в нейтр. и щелоч. р-рах: 2Н2О + 2е- =Н2 + 2ОН-)
|
+ 1,36 + 0,40
- 2,71 0,00
|
+ 1,32 + 0,82
- 2,72 - 0,41*) |
+ 1,57 + 1,91
- 2,72 - 1,13 |
|
*)
При выделении водорода из щелочного
раствора
|
||||
Анализируя данные Табл. 2.2.1 можно сделать вывод, что при стандартных условиях (электрод Pt) на катоде наиболее вероятным является выделение водорода, а на аноде – кислорода в результате разрядки гидроксоаниона. Выделение металлического натрия из водного раствора на твердом электроде невозможно, поскольку эта реакция (Табл. 2.2.1, реакция 3) имеет большой отрицательный потенциал. В кислой среде возможно совместное выделение хлора и кислорода, т.к. их потенциалы электродных реакций близки между собой.
В условиях, отличных от стандартных, электродный потенциал называют равновесным (ЕP) и рассчитывают по уравнению Нернста:
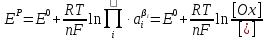
(2.2.4)
где ЕО – величина стандартного электродного потенциала, В;
R – газовая постоянная, равная 8,315 Дж/моль∙K;
Т – температура, К;
n – число электронов, участвующих в электродной реакции;
F – число Фарадея, равное 96500 кулонов (или 26,8 Ач) на моль;
 –
произведение
активностей или концентраций (давлений)
веществ, участвующих в электродной
реакции, в степенях, равных
стехиометрическим
коэффициентам (с учетом знака
–
произведение
активностей или концентраций (давлений)
веществ, участвующих в электродной
реакции, в степенях, равных
стехиометрическим
коэффициентам (с учетом знака
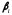 ),
по форме совпадающее с константой
равновесия;
),
по форме совпадающее с константой
равновесия;
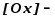 концентрация
окисленной формы вещества в степени,
равной стехиометрическому коэффициенту;
концентрация
окисленной формы вещества в степени,
равной стехиометрическому коэффициенту;
 концентрация
восстановленной формы вещества в
степени, равной стехиометрическому
коэффициенту.
концентрация
восстановленной формы вещества в
степени, равной стехиометрическому
коэффициенту.
Второе слагаемое уравнения (2.2.4) учитывает отклонение от стандартных условий температуры и активностей веществ.
Равновесный потенциал электрода характеризует термодинамическое равновесие, которое устанавливается на электроде без протекания тока. Таким образом, термодинамический анализ электрохимических потенциалов можно осуществлять на основании величины равновесных электродных потенциалов. В случае выделения на катоде водорода (табл. 2.2.1, реакция 4) равновесный электродный потенциал равен:
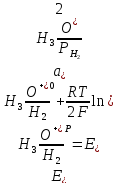 (2.2.5)
(2.2.5)
При выделении хлора на аноде (табл. 1, реакция 1):
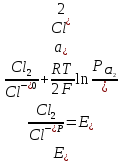 (2.2.6)
(2.2.6)
Из
уравнений (2.2.5-2.2.6) следует, что равновесие
электродных реакций, так же, как и в
других ХТП, можно смещать в сторону
исходных или конечных продуктов, изменяя
температуру, активность ионов (Н3О+
или Cl-)
исходных реагентов и парциальные
давления (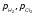 )
конечных продуктов. При этом может
измениться последовательность в ряду
потенциалов.
)
конечных продуктов. При этом может
измениться последовательность в ряду
потенциалов.
Кроме того, практические, то есть реализующиеся в условиях электролиза потенциалы разряда ионов всегда выше, чем рассчитанные по уравнению Нернста.
Практический потенциал (Е) отличается от равновесного на величину перенапряжения (см. Кинетику электродных процессов):
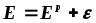 ,
,
где - потенциал перенапряжения, соответственно, на аноде или катоде.
Таким образом, практический потенциал разряда иона равен алгебраической сумме величин равновесного потенциала и перенапряжения (потенциал анода становится более положительным, а потенциал катода – более отрицательным).
Следует отметить, что в реальных условиях на одном и том же электроде могут протекать несколько параллельных электродных реакций. Так, при электролизе раствора хлорида натрия на аноде могут одновременно выделяться хлор и кислород. Как видно из Табл. 2.2.1 согласно значениям равновесных потенциалов на аноде прежде всего должно происходить выделение кислорода (реакция 2), так как равновесный электродный потенциал данной реакции меньше, чем равновесный потенциал выделения хлора. Варьируя условия электролиза (температуру, концентрацию хлорид-анионов, материал анода) можно, меняя перенапряжение, ускорить процесс выделения хлора по сравнению с выделением кислорода, чего и добиваются в реальных условиях (практический потенциал выделения кислорода становится больше соответствующей величины для хлора).
Одновременно с основной реакцией в объеме электролита и на электродах могут протекать вторичные побочные реакции. В анодном пространстве выделяющийся хлор может растворяться в электролите и взаимодействовать с водой, образуя соляную и слабо диссоциирующую хлорноватистую кислоты:
Cl2 + H2O HCl + HClO (2.2.7)
В случае проникновения гидроксид-ионов из катодного пространства в анодное образуются хорошо диссоциирующие хлорид и гипохлорит натрия:
HClO + NaOH NaClO + H2O (2.2.8)
HCl + NaOH = NaCl + H2O (2.2.9)
Таким образом, суммарная реакция образования гипохлорита натрия выглядит так:
Cl2 + 2NaOH = NaClO + NaCl + H2O (2.2.10)
Кроме того, гипохлорит натрия может диспропорционировать при повышенных температурах с образованием хлората натрия:
3NaClO NaClO3 + 2NaCl (2.2.11)
Образующийся кислород может взаимодействовать с графитовым анодом:
С + О2 = СО2 (2.2.12)
Могут протекать и другие побочные электродные процессы. Например, восстановление гипохлорит-ионов на катоде (2.2.13) и их окисление на аноде (2.2.14):
К ClO- +2H+ + 2e- = Cl- + H2O (2.2.13)
A 6ClO- + 3H2О - 6e- = 2ClO3 - + 4Cl- +1,5O2 +6H+ (2.2.14)
Доля побочных электродных реакций в оптимальных условиях проведения процесса невелика (3 - 5%), но эти реакции могут существенно снижать качество и выход основных продуктов при нарушении технологических режимов, а также вызывают разрушение диафрагмы.
Таким образом, электрохимическое равновесие, устанавливающееся на электроде, зависит от концентраций исходных и конечных продуктов, температуры, давления и может быть смещено в ту или другую сторону. В отличие от других ХТП, равновесие электродной реакции можно смещать, прикладывая ДОПОЛНИТЕЛЬНОЕ напряжение с помощью внешнего источника постоянного тока.

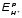 =
- 0,83 В
=
- 0,83 В