
- •Основы химической технологии Лабораторный практикум Москва 2013
- •Раздел 1 Основные понятия и технологические критерии эффективности химико-технологических процессов
- •1.1. Классификация химико-технологических процессов.
- •1.2. Основные технологические критерии эффективности
- •1.2.1 Степень превращения (степень конверсии) реагента (х) – это отношение количества превращенного реагента к введенному в реакционную систему количеству этого реагента.
- •1.2.2 Выходом продукта по данному реагенту называют отношение количества реагента, превратившегося в данный продукт, к количеству этого реагента, введенного в систему.
- •1.2.7. Материальный баланс хтп.
- •1.3. Технологические параметры хтп
- •1.3.1. Время пребывания исходных веществ в реакционной зоне.
- •Раздел 2 Технология неорганических веществ
- •2.1. Каталитическое окисление аммиака
- •2.1.2. Введение
- •2.1.3. Теоретические основы процесса Химия процесса и равновесие.
- •Кинетика процесса.
- •2.1.4. Выбор оптимального технологического режима.
- •2.1.5. Схема лабораторной установки
- •2.1.6. Порядок проведения опыта
- •1. Подготовка колб для отбора газовых проб.
- •2. Техника проведения эксперимента.
- •Экспериментальные и расчетные данные
- •Контроль процесса
- •Анализ газовых фаз
- •Технологические расчеты
- •2.1.7. Задание
- •2.1.8. Техника безопасности
- •Материальный баланс контактного аппарата для окисления аммиака
- •Библиографический список
- •2.2. Электрохимическое получение гидроксида натрия, хлора и водорода диафрагменным методом
- •2.2.2. Введение
- •2.2.3. Теоретические основы процесса
- •Электродные реакции и термодинамика процесса электролиза водного раствора хлорида натрия в диафрагменной ванне.
- •Электродные реакции и потенциалы разряда ионов
- •Кинетика электродных процессов.
- •Выход по току
- •Удельный расход электроэнергии
- •Коэффициент использования электроэнергии
- •Конверсия сырья
- •2.2.4. Выбор оптимального технологического режима
- •Состав электролита
- •Материал электродов
- •Диафрагма
- •2.2.5. Экспериментальная часть
- •Исходные данные
- •Предварительные расчеты
- •Порядок выполнения работы
- •Экспериментальные данные
- •Контроль процесса Определение концентрации щелочи в католите.
- •1. В связи с техническими сложностями измерения объема подаваемого электролита и анализа всех продуктов при расчёте материального баланса делаем следующие допущения:
- •2. Последовательность расчета материального баланса
- •Материальный баланс процесса электролиза
- •Расчет технологических показателей
- •Технологические показатели процесса электролиза
- •2.2.6. Задание
- •2.2.5.Техника безопасности
- •Библиографический список
- •2.3. Контактное окисление оксида серы (IV)
- •2.3.2.Введение
- •2.3.3. Теоретические основы процесса
- •2.3.4. Выбор технологического режима.
- •Зависимость равновесного выхода η* от состава исходной газовой смеси
- •Зависимость равновесного выхода от температуры при различном давлении
- •2.3.5. Расчетная часть Исходные данные
- •2.3.6. Расчет материального баланса.
- •Показатели процесса окисления оксида серы (IV)
- •2.3.7. Задание
- •Приложение Расчёт степени превращения so2 в so3 (степени контактирования)
- •Библиографический список
- •Раздел 3
- •3.1.3. Теоретические основы процесса.
- •Снон(адс) сн2о (газ)
- •3.1.5. Описание лабораторной установки
- •3.1.6. Предварительные расчеты
- •3.1.7. Порядок проведения опыта
- •Исходные и экспериментальные данные
- •Технологические параметры и критерии процесса
- •Экспериментальные данные
- •3.1.8. Контроль процесса
- •3.1.9. Расчет материального баланса контактного аппарата.
- •Материальный баланс контактного аппарата для получения формальдегида.
- •3.1.10. Задание
- •3.2.3. Теоретические основы процесса
- •3.2.5. Описание лабораторной установки.
- •3.2.6. Порядок проведения опыта.
- •Исходные и экспериментальные данные
- •Объем спирта, поступившего в реактор _____мл
- •Контроль процесса
- •Экспериментальные результаты опыта.
- •Данные хроматографического анализа контактного газа
- •3.2.7. Расчет материального баланса реактора
- •Материальный баланс реактора синтеза бутадиена.
- •3.2.8. Задание
- •3.3.3. Теоретические основы процесса
- •Усредненные энергии связей
- •Механизм превращения углеводородов в процессе пиролиза
- •3.3.4. Выбор оптимального технологического режима
- •3.3.5. Описание лабораторной установки
- •3.3.6. Порядок проведения опыта
- •Исходные и экспериментальные данные
- •Экспериментальные данные проведения опыта
- •3.3.7. Расчет материального баланса пиролиза
- •Материальный баланс реактора пиролиза керосиновой фракции.
- •3.3.8. Задание
- •Библиографический список.
- •Раздел 4 Приложение
- •4.1. Хроматографический анализ
- •Характеристики хроматографических пиков
- •Прикладной катализ Химия и технология гомогенного катализа
Библиографический список
1. Скорчеллетти В.В. Теоретическая электрохимия. – Л.:Химия, 1974. - 568 с.
2. Якименко Л.М. Производство водорода, кислорода, хлора и щелочей. – М.: Химия, 1981. – 280 с.
3. Файнштейн С.Я. Производство хлора методом диафрагменного электролиза. – М.: Химия, 1984. – 304 с.
4. Кубасов В.Л., Банников В.В. Электрохимическая технология неорганических веществ. – М.: Химия, 1989. – 288 с.
2.3. Контактное окисление оксида серы (IV)
2.3.1. Цель работы. Ознакомить с закономерностями простого, обратимого, экзотермического, гетерогенно-каталитического процесса окисления SO2 в SO3 на ванадиевом катализаторе, который является основной стадией производства серной кислоты; провести характерные для этого процесса технологические расчеты.
2.3.2.Введение
Процесс получения оксида серы (VI) является одним из немногочисленных простых химико-технологических процессов, осуществляемых в промышленном масштабе, а конечный продукт производства - серная кислота – один из базовых продуктов химической промышленности. Объем и эффективность производства серной кислоты непрерывно возрастают при одновременном совершенствовании технологических схем, росте единичных мощностей установок, сокращении энергозатрат, решении экологических проблем. Получение в больших масштабах серной кислоты осуществляют контактным методом, включающим в себя: получение SO2 путем обжига колчедана или сжигания серы; контактное окисление SO2 в SO3 и абсорбцию оксида серы (VI) с получением концентрированной серной кислоты или олеума. Стадия окисления SO2 в SO3 на оксидном катализаторе является типичным примером гетерогенно-каталитического процесса.
2.3.3. Теоретические основы процесса
Химизм, равновесие и кинетика.
Реакция окисления
SO2
+
1/2
O2
SO3

протекает
с уменьшением объема и выделением тепла.
Изменение стандартной молярной энтальпии
реакции
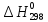 = -98,8
кДж/моль.
Константа равновесия, рассчитанная по
уравнению
= -98,8
кДж/моль.
Константа равновесия, рассчитанная по
уравнению
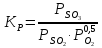
где
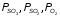 –
равновесные парциальные давления SO3,
SO2
и O2,
имеет значения в диапазоне 103
-
10 в интервале температур 400-600°С.
–
равновесные парциальные давления SO3,
SO2
и O2,
имеет значения в диапазоне 103
-
10 в интервале температур 400-600°С.
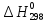 = -70,9 кДж/моль.
= -70,9 кДж/моль.
Для газовой смеси, используемой в процессе окисления SO2 в качестве исходной и содержащей 7% SO2, 11% О2 и 82% N2 (по объему), при давлении 0,1 МПа равновесная степень превращения SO2 (X*) имеет следующие значения:
Таблица 2.3.1
Зависимость равновесной степени превращения от температуры
|
t, oC |
400 |
440 |
480 |
520 |
560 |
590 |
650 |
|
Х*, % |
99,2 |
98,0 |
95,4 |
90,7 |
82,5 |
75,0 |
58,5 |
В интервале температур 400 – 1000°С реакция окисления SO2 обратима. При температурах ниже 400°С равновесие почти полностью смещено в сторону SO3, при температурах выше 1000°С – в сторону исходных веществ. На равновесную степень превращения в соответствии с принципом Ле-Шателье положительно влияют понижение температуры, повышение давления, увеличение концентрации кислорода и вывод SO3 из зоны реакции.
Реакция не протекает без катализатора из-за высокого значения энергии активации (Еа = ~280 кДж/моль). Процесс окисления с заметной скоростью для различных катализаторов начинается при определенной температуре - температуре зажигания. Реакция ускоряется в присутствии платины (Еа = 70 кДж/моль) при температуре не ниже 25О°С, оксида железа (III) (Еа = 150 кДж/моль) при температуре не ниже 55О°С; катализаторы на основе оксида ванадия (V) при температуре не ниже 400°С (Еа = 90 кДж/моль).
Платиновый катализатор обладает наибольшей активностью, однако дорог и быстро отравляется ядами (мышьяком, селеном, хлором и др.). Оксид железа (III) - малоактивный катализатор. В настоящее время в производстве серной кислоты применяется только ванадиевый катализатор.
Активными компонентами ванадиевых катализаторов являются сульфо- и пиросульфованадаты калия, которые в условиях проведения реакции находятся в расплавленном состоянии на поверхности кремнеземистого носителя. Формы контактной массы - гранулы, кольца. Рабочий интервал температур 400 - 600°С. При температурах выше 600°С активность катализатора уменьшается из-за разрушения активного комплекса V2О5 ∙ K2S2O7 и взаимодействия компонентов контактной массы с носителем. При температурах ниже 400°С возможно образование каталитически неактивного соединения - сульфата ванадила VOSO4.
Процесс гетерогенного катализа на пористом катализаторе многостадиен. В общем виде различаются следующие стадии:
1). Перенос газообразных веществ из объема к поверхности катализатора (внешняя диффузия);
2). Диффузия реагирующих веществ внутри пор катализатора (внутренняя диффузия);
3). Адсорбция O2 и SO2 на катализаторе;
4). Химическое взаимодействие исходных веществ с участием катализатора;
-
. Десорбция SO3;
-
. Диффузия SO3 внутри зерна катализатора к его поверхности (внутренняя диффузия);
7). Перенос продукта реакции в газовую фазу (внешняя диффузия).
Скорость всего процесса определяется скоростью наиболее медленной стадии. В зависимости от выбранных условий скорость образования SO3 определяется скоростью внешней или внутренней диффузии или же скоростью химического взаимодействия.
При промышленных скоростях газового потока и при использовании катализатора с диаметром гранул не более 0,5 см и с размером пор 5·10-5 см процесс окисления оксида серы (IV) протекает в кинетической области.
Г.К. Боресков установил, что скорость окисления SO2 на ванадиевом катализаторе приближенно описывается уравнением
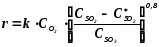 (2.3.1)
(2.3.1)
где С - текущие концентрации веществ;
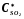 -
равновесная концентрация при данной
температуре;
-
равновесная концентрация при данной
температуре;
k - константа скорости.
Из уравнения 2.3.1 следует, что скорость реакции уменьшается с приближением к равновесию.
Константа
скорости возрастает в пределах температур
работы катализатора 400-600°С
согласно закону Аррениуса. При изменении
температуры с 400 до 500°С она
увеличивается в 30 раз, однако при этом
наблюдается падение значения движущей
силы процесса (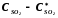 ).
Движущая сила уменьшается, так как с
ростом температуры
равновесие реакции смещается влево и
растет значение
).
Движущая сила уменьшается, так как с
ростом температуры
равновесие реакции смещается влево и
растет значение
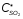 .
Поэтому
зависимость
скорости процесса от температуры, при
прочих постоянных условиях (Р,
С,
τ),
представляет собой кривую с максимумом
(рис.2.3.1):
до оптимальной температуры скорость
растет за
счет значительного возрастания k,
а затем понижается в силу того, что
начинает преимущественно
сказываться уменьшение движущей силы.
Поскольку
наибольшее влияние на величину движущей
силы процесса оказывает
концентрация кислорода (высокий порядок
.
Поэтому
зависимость
скорости процесса от температуры, при
прочих постоянных условиях (Р,
С,
τ),
представляет собой кривую с максимумом
(рис.2.3.1):
до оптимальной температуры скорость
растет за
счет значительного возрастания k,
а затем понижается в силу того, что
начинает преимущественно
сказываться уменьшение движущей силы.
Поскольку
наибольшее влияние на величину движущей
силы процесса оказывает
концентрация кислорода (высокий порядок
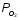 в кинетическом уравнении), то можно
считать, что адсорбция кислорода
поверхностью
катализатора лимитирует скорость
окисления и k
является константой
скорости хемосорбции кислорода.
в кинетическом уравнении), то можно
считать, что адсорбция кислорода
поверхностью
катализатора лимитирует скорость
окисления и k
является константой
скорости хемосорбции кислорода.
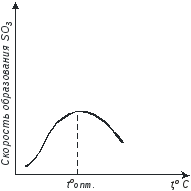
Рис. 2.3.1 Влияние температуры на скорость реакции образования оксида серы (VI) при постоянном времени контактирования
