
- •Основы химической технологии Лабораторный практикум Москва 2013
- •Раздел 1 Основные понятия и технологические критерии эффективности химико-технологических процессов
- •1.1. Классификация химико-технологических процессов.
- •1.2. Основные технологические критерии эффективности
- •1.2.1 Степень превращения (степень конверсии) реагента (х) – это отношение количества превращенного реагента к введенному в реакционную систему количеству этого реагента.
- •1.2.2 Выходом продукта по данному реагенту называют отношение количества реагента, превратившегося в данный продукт, к количеству этого реагента, введенного в систему.
- •1.2.7. Материальный баланс хтп.
- •1.3. Технологические параметры хтп
- •1.3.1. Время пребывания исходных веществ в реакционной зоне.
- •Раздел 2 Технология неорганических веществ
- •2.1. Каталитическое окисление аммиака
- •2.1.2. Введение
- •2.1.3. Теоретические основы процесса Химия процесса и равновесие.
- •Кинетика процесса.
- •2.1.4. Выбор оптимального технологического режима.
- •2.1.5. Схема лабораторной установки
- •2.1.6. Порядок проведения опыта
- •1. Подготовка колб для отбора газовых проб.
- •2. Техника проведения эксперимента.
- •Экспериментальные и расчетные данные
- •Контроль процесса
- •Анализ газовых фаз
- •Технологические расчеты
- •2.1.7. Задание
- •2.1.8. Техника безопасности
- •Материальный баланс контактного аппарата для окисления аммиака
- •Библиографический список
- •2.2. Электрохимическое получение гидроксида натрия, хлора и водорода диафрагменным методом
- •2.2.2. Введение
- •2.2.3. Теоретические основы процесса
- •Электродные реакции и термодинамика процесса электролиза водного раствора хлорида натрия в диафрагменной ванне.
- •Электродные реакции и потенциалы разряда ионов
- •Кинетика электродных процессов.
- •Выход по току
- •Удельный расход электроэнергии
- •Коэффициент использования электроэнергии
- •Конверсия сырья
- •2.2.4. Выбор оптимального технологического режима
- •Состав электролита
- •Материал электродов
- •Диафрагма
- •2.2.5. Экспериментальная часть
- •Исходные данные
- •Предварительные расчеты
- •Порядок выполнения работы
- •Экспериментальные данные
- •Контроль процесса Определение концентрации щелочи в католите.
- •1. В связи с техническими сложностями измерения объема подаваемого электролита и анализа всех продуктов при расчёте материального баланса делаем следующие допущения:
- •2. Последовательность расчета материального баланса
- •Материальный баланс процесса электролиза
- •Расчет технологических показателей
- •Технологические показатели процесса электролиза
- •2.2.6. Задание
- •2.2.5.Техника безопасности
- •Библиографический список
- •2.3. Контактное окисление оксида серы (IV)
- •2.3.2.Введение
- •2.3.3. Теоретические основы процесса
- •2.3.4. Выбор технологического режима.
- •Зависимость равновесного выхода η* от состава исходной газовой смеси
- •Зависимость равновесного выхода от температуры при различном давлении
- •2.3.5. Расчетная часть Исходные данные
- •2.3.6. Расчет материального баланса.
- •Показатели процесса окисления оксида серы (IV)
- •2.3.7. Задание
- •Приложение Расчёт степени превращения so2 в so3 (степени контактирования)
- •Библиографический список
- •Раздел 3
- •3.1.3. Теоретические основы процесса.
- •Снон(адс) сн2о (газ)
- •3.1.5. Описание лабораторной установки
- •3.1.6. Предварительные расчеты
- •3.1.7. Порядок проведения опыта
- •Исходные и экспериментальные данные
- •Технологические параметры и критерии процесса
- •Экспериментальные данные
- •3.1.8. Контроль процесса
- •3.1.9. Расчет материального баланса контактного аппарата.
- •Материальный баланс контактного аппарата для получения формальдегида.
- •3.1.10. Задание
- •3.2.3. Теоретические основы процесса
- •3.2.5. Описание лабораторной установки.
- •3.2.6. Порядок проведения опыта.
- •Исходные и экспериментальные данные
- •Объем спирта, поступившего в реактор _____мл
- •Контроль процесса
- •Экспериментальные результаты опыта.
- •Данные хроматографического анализа контактного газа
- •3.2.7. Расчет материального баланса реактора
- •Материальный баланс реактора синтеза бутадиена.
- •3.2.8. Задание
- •3.3.3. Теоретические основы процесса
- •Усредненные энергии связей
- •Механизм превращения углеводородов в процессе пиролиза
- •3.3.4. Выбор оптимального технологического режима
- •3.3.5. Описание лабораторной установки
- •3.3.6. Порядок проведения опыта
- •Исходные и экспериментальные данные
- •Экспериментальные данные проведения опыта
- •3.3.7. Расчет материального баланса пиролиза
- •Материальный баланс реактора пиролиза керосиновой фракции.
- •3.3.8. Задание
- •Библиографический список.
- •Раздел 4 Приложение
- •4.1. Хроматографический анализ
- •Характеристики хроматографических пиков
- •Прикладной катализ Химия и технология гомогенного катализа
Экспериментальные данные
|
Операция |
Время от начала опыта, мин |
Сила тока, А |
Напря-жение, В |
Объем пробы като-лита, мл |
Объем H2SO4, мл |
Кол-во NaOH, г |
Выход по току, % |
|
Оценка расхода электро-лита: Проба 1 Проба 2
Определение выхода по току: Проба 1 Пробы 2 Пробы 3 Пробы 4 |
0 10 20
30 40 50 60
|
|
|
|
|
|
|
Контроль процесса Определение концентрации щелочи в католите.
Пробу католита, количественно переносят из мерного цилиндра в коническую колбу для титрования, разбавляют в 2 - 3 раза дистиллированной водой и добавляют 2 - 3 мл. 3%-ного раствора пероксида водорода для разрушения гипохлорит- и хлорат ионов. Через 2 - 3 мин. в раствор вносят 2 - 4 капли индикатора – метилового оранжевого и титруют раствором серной кислоты до изменения окраски индикатора (от желтой до светло оранжевой).
Практическую
массу щелочи, полученной при электролизе
(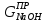 ),
рассчитывают по формуле:
),
рассчитывают по формуле:
 (2.2.32)
(2.2.32)
где
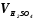 – объем кислоты, затраченной на
титрование, мл;
– объем кислоты, затраченной на
титрование, мл;
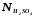 – нормальность
раствора кислоты (моль/л);
– нормальность
раствора кислоты (моль/л);
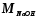 – молярная
масса гидроксида натрия , 40,0 г/моль.
– молярная
масса гидроксида натрия , 40,0 г/моль.
Массовую концентрацию щелочи в католите (г/л) - СNaOH - рассчитывают по формуле:
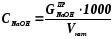 (2.2.33)
(2.2.33)
где Vкат – объем пробы католита, мл.
Расчет материального баланса
Материальный баланс процесса электролиза рассчитывают для времени электролиза, заданного преподавателем.
1. В связи с техническими сложностями измерения объема подаваемого электролита и анализа всех продуктов при расчёте материального баланса делаем следующие допущения:
Учитываем две реакции – получения гидроксида натрия (2.2.1) и гипохлорита натрия (2.2.8). Процессами образования хлората натрия, кислорода и др. пренебрегаем.
Объем вытекающего католита принимаем равным объему введенного электролита, плотность электролита принимаем равной = 1,2 г/см3.
При
таких допущениях выход по току по
водороду (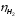 )
равен 100 %,
а выходы по току по гидроксиду натрия
и хлору одинаковы (
)
равен 100 %,
а выходы по току по гидроксиду натрия
и хлору одинаковы (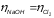 ).
).
2. Последовательность расчета материального баланса
а) Объем католита Vкат в литрах определяют экспериментально и пересчитывают на базис, заданный преподавателем.
б)
Определяют массу введенного электролита,
рассчитывают количество введенных
хлорида натрия
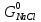 и воды
и воды
 ,
исходя
из концентрации насыщенного раствора
хлорида натрия при 20 С
– 26,3 масс. %.
,
исходя
из концентрации насыщенного раствора
хлорида натрия при 20 С
– 26,3 масс. %.
в)
Зная силу тока и время электролиза, по
уравнениям (2.2.16) и (2.2.18 – 2.2.20) рассчитывают
теоретические массы продуктов электролиза:
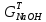 ,
,
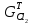 ,
,
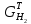 ;
;
г)
Учитывая значения выходов по току,
полученные по уравнению (2.2.15), рассчитываем
практические массы полученных продуктов:
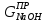 ,
,
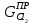 и
и
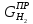 ;
;
д)
По основному уравнению материального
баланса (2.2.1) с учетом теоретических
масс продуктов рассчитываем массу
хлорида натрия и воды, затраченные на
образование всех продуктов электролиза
(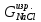 и
и
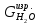 );
);
е) Масса гидроксида натрия, пошедшая на побочные реакции (2.2.10), является разностью между теоретической и практической массой гидроксида натрия;
ж)
По уравнению (2.2.10), учитывая массу
гидроксида натрия, пошедшего на побочную
реакцию, рассчитываем массу образовавшихся
хлорида натрия и гипохлорита натрия, а
также воды:
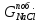 ,
,
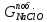 и
и
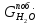 ;
;
з)
Масса воды в католите ( )
определяется как разность между массой
воды, введенной с электролитом, и массой
воды, пошедшей на основную
реакцию
(воду, образовавшуюся по побочной реакции
тоже нужно учесть):
)
определяется как разность между массой
воды, введенной с электролитом, и массой
воды, пошедшей на основную
реакцию
(воду, образовавшуюся по побочной реакции
тоже нужно учесть):
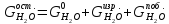
Вода, унесенная с хлором и водородом, не учитывается
е)
Масса хлорида натрия
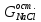 в
католите определяется как разность
между массой хлорида натрия, введенного
с электролитом, и массой хлоридом натрия,
пошедшего на основную
реакцию (с учётом
в
католите определяется как разность
между массой хлорида натрия, введенного
с электролитом, и массой хлоридом натрия,
пошедшего на основную
реакцию (с учётом
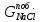 ):
):
Таблица 2.2.3
