
- •Основы химической технологии Лабораторный практикум Москва 2013
- •Раздел 1 Основные понятия и технологические критерии эффективности химико-технологических процессов
- •1.1. Классификация химико-технологических процессов.
- •1.2. Основные технологические критерии эффективности
- •1.2.1 Степень превращения (степень конверсии) реагента (х) – это отношение количества превращенного реагента к введенному в реакционную систему количеству этого реагента.
- •1.2.2 Выходом продукта по данному реагенту называют отношение количества реагента, превратившегося в данный продукт, к количеству этого реагента, введенного в систему.
- •1.2.7. Материальный баланс хтп.
- •1.3. Технологические параметры хтп
- •1.3.1. Время пребывания исходных веществ в реакционной зоне.
- •Раздел 2 Технология неорганических веществ
- •2.1. Каталитическое окисление аммиака
- •2.1.2. Введение
- •2.1.3. Теоретические основы процесса Химия процесса и равновесие.
- •Кинетика процесса.
- •2.1.4. Выбор оптимального технологического режима.
- •2.1.5. Схема лабораторной установки
- •2.1.6. Порядок проведения опыта
- •1. Подготовка колб для отбора газовых проб.
- •2. Техника проведения эксперимента.
- •Экспериментальные и расчетные данные
- •Контроль процесса
- •Анализ газовых фаз
- •Технологические расчеты
- •2.1.7. Задание
- •2.1.8. Техника безопасности
- •Материальный баланс контактного аппарата для окисления аммиака
- •Библиографический список
- •2.2. Электрохимическое получение гидроксида натрия, хлора и водорода диафрагменным методом
- •2.2.2. Введение
- •2.2.3. Теоретические основы процесса
- •Электродные реакции и термодинамика процесса электролиза водного раствора хлорида натрия в диафрагменной ванне.
- •Электродные реакции и потенциалы разряда ионов
- •Кинетика электродных процессов.
- •Выход по току
- •Удельный расход электроэнергии
- •Коэффициент использования электроэнергии
- •Конверсия сырья
- •2.2.4. Выбор оптимального технологического режима
- •Состав электролита
- •Материал электродов
- •Диафрагма
- •2.2.5. Экспериментальная часть
- •Исходные данные
- •Предварительные расчеты
- •Порядок выполнения работы
- •Экспериментальные данные
- •Контроль процесса Определение концентрации щелочи в католите.
- •1. В связи с техническими сложностями измерения объема подаваемого электролита и анализа всех продуктов при расчёте материального баланса делаем следующие допущения:
- •2. Последовательность расчета материального баланса
- •Материальный баланс процесса электролиза
- •Расчет технологических показателей
- •Технологические показатели процесса электролиза
- •2.2.6. Задание
- •2.2.5.Техника безопасности
- •Библиографический список
- •2.3. Контактное окисление оксида серы (IV)
- •2.3.2.Введение
- •2.3.3. Теоретические основы процесса
- •2.3.4. Выбор технологического режима.
- •Зависимость равновесного выхода η* от состава исходной газовой смеси
- •Зависимость равновесного выхода от температуры при различном давлении
- •2.3.5. Расчетная часть Исходные данные
- •2.3.6. Расчет материального баланса.
- •Показатели процесса окисления оксида серы (IV)
- •2.3.7. Задание
- •Приложение Расчёт степени превращения so2 в so3 (степени контактирования)
- •Библиографический список
- •Раздел 3
- •3.1.3. Теоретические основы процесса.
- •Снон(адс) сн2о (газ)
- •3.1.5. Описание лабораторной установки
- •3.1.6. Предварительные расчеты
- •3.1.7. Порядок проведения опыта
- •Исходные и экспериментальные данные
- •Технологические параметры и критерии процесса
- •Экспериментальные данные
- •3.1.8. Контроль процесса
- •3.1.9. Расчет материального баланса контактного аппарата.
- •Материальный баланс контактного аппарата для получения формальдегида.
- •3.1.10. Задание
- •3.2.3. Теоретические основы процесса
- •3.2.5. Описание лабораторной установки.
- •3.2.6. Порядок проведения опыта.
- •Исходные и экспериментальные данные
- •Объем спирта, поступившего в реактор _____мл
- •Контроль процесса
- •Экспериментальные результаты опыта.
- •Данные хроматографического анализа контактного газа
- •3.2.7. Расчет материального баланса реактора
- •Материальный баланс реактора синтеза бутадиена.
- •3.2.8. Задание
- •3.3.3. Теоретические основы процесса
- •Усредненные энергии связей
- •Механизм превращения углеводородов в процессе пиролиза
- •3.3.4. Выбор оптимального технологического режима
- •3.3.5. Описание лабораторной установки
- •3.3.6. Порядок проведения опыта
- •Исходные и экспериментальные данные
- •Экспериментальные данные проведения опыта
- •3.3.7. Расчет материального баланса пиролиза
- •Материальный баланс реактора пиролиза керосиновой фракции.
- •3.3.8. Задание
- •Библиографический список.
- •Раздел 4 Приложение
- •4.1. Хроматографический анализ
- •Характеристики хроматографических пиков
- •Прикладной катализ Химия и технология гомогенного катализа
Раздел 3
Технология органических веществ
3.1. Получение метаналя (формальдегида) окислительным дегидрированием метанола
3.1.1. Цель работы
Ознакомление с основными закономерностями гетерогенно- каталитического процесса, включающего параллельные и последовательные побочные реакции, с рациональным проведением высокотемпературного экзотермического процесса в автотермическом режиме.
3.1.2. Введение
Формальдегид (метаналь) CH2O представляет собой бесцветный газ с острым раздражающим запахом (tконд = 19ОС при атмосферном давлении). Формальдегид хорошо растворяется в воде, спирте, эфире, легко полимеризуется и конденсируется. Промышленность выпускает формальдегид в форме формалина - 37 % масс. водного раствора. В нем формальдегид присутствует в виде гидрата CH2OH2O и низкомолекулярных полимеров (полиоксиметиленгликолей):
nCH2O + H2O = H-(OCH2)n-OH, где n<8.
Во избежание более глубокой полимеризации и выпадения осадка к формалину добавляют 7 - 12 % масс. метанола в качестве стабилизатора.
Формальдегид является одним из наиболее крупнотоннажных продуктов органического синтеза. Ежегодно в мире производится около 7 млн. т. Его применяют для производства пластических масс (феноло-, карбамидо-, и меламино-формальдегидных полимеров, полиформальдегидов), изопрена и на его основе полиизопренового каучука, лекарственных препаратов (уротропина), взрывчатых веществ (пентрита) и т.д.
В промышленности формальдегид получают из метанола окислительным дегидрированием на металлических катализаторах (600 – 720о) или окислением избытком воздуха на молибдате железа при 250 – 400о. Первый способ преобладает.
3.1.3. Теоретические основы процесса.
Химия процесса. Формальдегид при катализе металлами образуется по двум реакциям: мягким окислением и дегидрированием метанола (указаны величины тепловых эффектов):
CH3OH + 0,5O2 CH2O + H2O 147,4 кДж/моль (3.1.1)
CH3OH
CH2O
+ H2
-
93,4
кДж/моль
(3.1.2)

Наряду с основными протекают побочные реакции:
CH3OH + 1,5O2 CO2 + 2H2O 575 кДж/моль (3.1.3)
CH2O + 0,5O2 HCOOH 270,4 кДж/моль (3.1.4)
HCOOH + 0,5O2 CO2 + H2O 14,5 кДж/моль (3.1.5)
CH2О CO + H2 1,9 кДж/моль (3.1.6)
2CO CO2 + C 172 кДж/моль (3.1.7)
Следовательно, синтез формальдегида относится к сложным процессам.
Равновесие основных реакций. На рис. 3.1.1 приведена зависимость равновесного выхода * формальдегида от температуры для реакции окисления и дегидрирования.
Равновесие
экзотермической реакции окисления
(3.1.1) в широком диапазоне температур
полностью смещено в правую сторону, *
100%,
т.е. реакция (3.1.1) необратима. Равновесие
эндотермической реакции дегидрирования
(3.1.2), согласно принципу Ле Шателье, при
повышении температуры смещается вправо,
равновесный выход растет и достигает
практически 100%
при температуре > 700ОС
(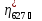 = 96,5%;
= 96,5%;
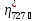 =
98,9%).
=
98,9%).
Кинетика процесса. Метанол может превращаться по различным направлениям: (3.1.1), (3.1.2), (3.1.3). Проведение процесса при высокой температуре приводит к значительному ускорению реакции глубокого окисления метанола до оксида углерода (IV) (3.1.3), так как энергия активации этой реакции больше энергии активации основных реакций превращения метанола в формальдегид. Для ускорения основных реакций (3.1.1), (3.1.2) необходимо проводить процесс с участием избирательно действующего катализатора. В качестве катализатора можно использовать металлы IБ подгруппы Периодической системы элементов: Ag, Au, Cu. Промышленным катализатором является серебро, ибо оно проявляет наиболее высокую селективность.

Рис. 3.1.1 Зависимость равновесных выходов формальдегида от температуры: 1 - по реакции окисления, 2 - по реакции дегидрирования.
Механизм химических взаимодействий на серебряном катализаторе включает в себя ряд последовательных превращений. Метанол не адсорбируется на серебре в отсутствие кислорода. Кислород, адсорбируясь на серебряном катализаторе, образует с серебром различные поверхностные соединения. Эти соединения являются действительными катализаторами протекающих процессов. Считается, что реакции (3.1.1) и (3.1.2) катализируют соединения, в которых кислород связан относительно прочно, а побочные процессы глубокого окисления метанола связаны с наличием на поверхности соединений с непрочно связанным кислородом. Доля последних возрастает при избытке кислорода в системе. В результате изучения взаимодействия метанола и кислорода с медными и серебряными катализаторами был предложен следующий механизм реакции:
СН3ОН(газ) + О(адс) СН3О(адс) + ОН(адс)
СН3ОН(газ) + ОН(адс) СН3О(адс) + Н2О(адс)
СН3О(адс) СНОН(адс) + Н(адс)
2Н(адс) Н2(газ)
Н2О(адс) Н2О (газ)
