
- •Основы химической технологии Лабораторный практикум Москва 2013
- •Раздел 1 Основные понятия и технологические критерии эффективности химико-технологических процессов
- •1.1. Классификация химико-технологических процессов.
- •1.2. Основные технологические критерии эффективности
- •1.2.1 Степень превращения (степень конверсии) реагента (х) – это отношение количества превращенного реагента к введенному в реакционную систему количеству этого реагента.
- •1.2.2 Выходом продукта по данному реагенту называют отношение количества реагента, превратившегося в данный продукт, к количеству этого реагента, введенного в систему.
- •1.2.7. Материальный баланс хтп.
- •1.3. Технологические параметры хтп
- •1.3.1. Время пребывания исходных веществ в реакционной зоне.
- •Раздел 2 Технология неорганических веществ
- •2.1. Каталитическое окисление аммиака
- •2.1.2. Введение
- •2.1.3. Теоретические основы процесса Химия процесса и равновесие.
- •Кинетика процесса.
- •2.1.4. Выбор оптимального технологического режима.
- •2.1.5. Схема лабораторной установки
- •2.1.6. Порядок проведения опыта
- •1. Подготовка колб для отбора газовых проб.
- •2. Техника проведения эксперимента.
- •Экспериментальные и расчетные данные
- •Контроль процесса
- •Анализ газовых фаз
- •Технологические расчеты
- •2.1.7. Задание
- •2.1.8. Техника безопасности
- •Материальный баланс контактного аппарата для окисления аммиака
- •Библиографический список
- •2.2. Электрохимическое получение гидроксида натрия, хлора и водорода диафрагменным методом
- •2.2.2. Введение
- •2.2.3. Теоретические основы процесса
- •Электродные реакции и термодинамика процесса электролиза водного раствора хлорида натрия в диафрагменной ванне.
- •Электродные реакции и потенциалы разряда ионов
- •Кинетика электродных процессов.
- •Выход по току
- •Удельный расход электроэнергии
- •Коэффициент использования электроэнергии
- •Конверсия сырья
- •2.2.4. Выбор оптимального технологического режима
- •Состав электролита
- •Материал электродов
- •Диафрагма
- •2.2.5. Экспериментальная часть
- •Исходные данные
- •Предварительные расчеты
- •Порядок выполнения работы
- •Экспериментальные данные
- •Контроль процесса Определение концентрации щелочи в католите.
- •1. В связи с техническими сложностями измерения объема подаваемого электролита и анализа всех продуктов при расчёте материального баланса делаем следующие допущения:
- •2. Последовательность расчета материального баланса
- •Материальный баланс процесса электролиза
- •Расчет технологических показателей
- •Технологические показатели процесса электролиза
- •2.2.6. Задание
- •2.2.5.Техника безопасности
- •Библиографический список
- •2.3. Контактное окисление оксида серы (IV)
- •2.3.2.Введение
- •2.3.3. Теоретические основы процесса
- •2.3.4. Выбор технологического режима.
- •Зависимость равновесного выхода η* от состава исходной газовой смеси
- •Зависимость равновесного выхода от температуры при различном давлении
- •2.3.5. Расчетная часть Исходные данные
- •2.3.6. Расчет материального баланса.
- •Показатели процесса окисления оксида серы (IV)
- •2.3.7. Задание
- •Приложение Расчёт степени превращения so2 в so3 (степени контактирования)
- •Библиографический список
- •Раздел 3
- •3.1.3. Теоретические основы процесса.
- •Снон(адс) сн2о (газ)
- •3.1.5. Описание лабораторной установки
- •3.1.6. Предварительные расчеты
- •3.1.7. Порядок проведения опыта
- •Исходные и экспериментальные данные
- •Технологические параметры и критерии процесса
- •Экспериментальные данные
- •3.1.8. Контроль процесса
- •3.1.9. Расчет материального баланса контактного аппарата.
- •Материальный баланс контактного аппарата для получения формальдегида.
- •3.1.10. Задание
- •3.2.3. Теоретические основы процесса
- •3.2.5. Описание лабораторной установки.
- •3.2.6. Порядок проведения опыта.
- •Исходные и экспериментальные данные
- •Объем спирта, поступившего в реактор _____мл
- •Контроль процесса
- •Экспериментальные результаты опыта.
- •Данные хроматографического анализа контактного газа
- •3.2.7. Расчет материального баланса реактора
- •Материальный баланс реактора синтеза бутадиена.
- •3.2.8. Задание
- •3.3.3. Теоретические основы процесса
- •Усредненные энергии связей
- •Механизм превращения углеводородов в процессе пиролиза
- •3.3.4. Выбор оптимального технологического режима
- •3.3.5. Описание лабораторной установки
- •3.3.6. Порядок проведения опыта
- •Исходные и экспериментальные данные
- •Экспериментальные данные проведения опыта
- •3.3.7. Расчет материального баланса пиролиза
- •Материальный баланс реактора пиролиза керосиновой фракции.
- •3.3.8. Задание
- •Библиографический список.
- •Раздел 4 Приложение
- •4.1. Хроматографический анализ
- •Характеристики хроматографических пиков
- •Прикладной катализ Химия и технология гомогенного катализа
3.2.8. Задание
1. Провести процесс получения дивинила при заданных преподавателем условиях с записями всех данных по прилагаемой форме.
2. По хроматограмме контактного газа рассчитать состав газовой смеси в объемных процентах.
3. Составить приближенный материальный баланс реактора синтеза дивинила на заданный преподавателем базис.
4. Рассчитать технологические критерии процесса:
-
степень превращения спирта,
-
выход дивинила на этанол,
-
селективность процесса по 1,3-бутадиену на этанол,
-
интенсивность работы катализатора,
-
расходные коэффициенты на 1,3-бутадиен по этанолу (практический и стехиометрический).
5. Рассчитать время контактирования .
6. На основании технологических показателей дать оценку качества проведения ХТП.
Библиографический список
-
Лебедев Н.Н. Химия и технология основного органического и нефтехимического синтеза. - М.: Химия, 1988. – 592
-
Соколов Р.С. Химическая технология: Учебное пособие для студ. высш. учеб. заведений в 2-х томах. Т.2- М.: Гуманит. Изд. Центр. Владос, 2000.- 448с.
3.3. Получение низкомолекулярных алкенов пиролизом фракций нефти.
3.3.1 Цель работы.
Ознакомить студентов с основными закономерностями химических превращений углеводородов под действием высоких температур, с приемами проведения и исследования термических процессов на примере пиролиза фракций нефти.
3.3.2. Введение
Этилен и пропилен – крупнотоннажные мономеры, на основе которых промышленность органического синтеза производит продукты полимеризации (полиэтилен, полипропилен), гидратации (этиловый, изопропиловый спирты), хлорирования (дихлорэтан, винилхлорид), окисления (уксусный альдегид, оксиды этилена и пропилена, акролеин, акриловая кислота). В настоящее время основным способом получения этих алкенов является пиролиз (высокотемпературный крекинг) углеводородов. Пиролизу подвергают фракции прямой перегонки нефти, состоящие из алканов, циклоалканов и аренов, природные и попутные нефтяные газы, содержащие алканы.
3.3.3. Теоретические основы процесса
Термодинамика процесса. При температурах пиролиза (700 - 850оС) наиболее значительную часть химических превращений составляет термический распад углеводородов; одновременно идут также реакции синтеза: полимеризация, конденсация, гидрирование, алкилирование. При оценке возможных термических превращений важную роль играет термодинамическая стабильность углеводородов сырья, а также получающихся в процессе алкенов. Как известно, термодинамическая стабильность соединений и направление их взаимных превращений определяются изменением энергии Гиббса. На рис. 3.3.1 приведена температурная зависимость изменения энергии Гиббса ∆Gо при образовании углеводородов из простых веществ. Изменение энергии Гиббса при взаимном превращении углеводородов может быть определено для данной температуры как разность ординат точек на соответствующих кривых.
Система всегда стремится перейти в состояние, характеризующееся наименьшим значением энергии Гиббса, поэтому из рис. 3.3.1 следует, что при 500 К реакция превращения н-гексана в бензол термодинамически не разрешена (∆Gо бензола - ∆Gо н-гексана > 0) и возможна при 900 К (∆Gо бензола - ∆Gо н-гексана < 0) . Как видно из рис. 3.3.1 при температурах пиролиза термодинамическая стабильность углеводородов разных классов с одинаковым числом углеводородных атомов в молекуле понижается в следующем ряду: арены > алкены > цикланы > алканы. Таким образом, в процессе пиролиза термодинамически более вероятно образование аренов и алкенов.
Качественно оценить влияние температуры и давления на термодинамическую вероятность того или иного превращения можно исходя из принципа Ле Шателье. Повышение температуры способствует протеканию эндотермических реакций распада и дегидрирования, повышение давления – протеканию реакций гидрирования, алкилирования, полимеризации, идущих с уменьшением объема.
Кинетика процесса. Для осуществления той или иной реакции мало создать условия, обеспечивающие термодинамическую возможность и благоприятное положение равновесия. Необходимо, чтобы реакция протекала с приемлемой для технологических целей скоростью.
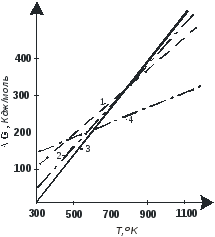
Рис. 3.3.1 Зависимость изменения энергии Гиббса GO при образовании углеводородов из простых веществ от температуры: 1 - гексен, 2 - циклогексан, 3 – н-гексан, 4 - бензол.
Энергии активации реакций пиролиза достаточно велики. Они находятся в пределах 200 - 280 кДж/моль. Следовательно, изменение температуры оказывает значительное влияние на скорость реакций пиролиза. Преобладающим типом первичных превращений углеводородов является их распад (разрыв связей С–С и С–Н, образование кратных связей). Константы скорости реакций распада представляют собой с достаточной степенью приближения функцию количества энергии, которую необходимо затратить для разрыва (диссоциации) определенного типа связи, т.е. являются функцией энергии связи.
Анализ значений энергий связей показывает, что при температурах пиролиза с наибольшей скоростью распадаются алканы, значительно медленнее арены (Табл. 3.3.1) Алкены и циклоалканы занимают промежуточное положение.
Таблица 3.3.1
