
- •Лекция №1 зміст, предмет та задачі дисципліни.
- •Лекция №2-4 природные α-аминокислоты. Строение классификация стереоизомерия химические свойства
- •Лекция №5 белки. Общие сведения, функции белков
- •Белки общие сведения.
- •2. Функции белков,содержание белков в органах и тканях
- •Лекция № 6-9. Физико-химические свойства белков, их структурная организация, классификация белков
- •1. Физико-химические свойства белков. Понятие структурной организации белков
- •2. Первичная и вторичная структура белка
- •3. Третичная и четвертичная структура белка
- •4. Классификация белков, химия простых белков, природные пептиды
- •Лекция № 10-12. Особенности белкового обмена, переваривание белков.
- •1. Особенности белкового обмена
- •2. Особенности переваривания белков, эндопептидазы
- •3. Переваривание белков в желудке и кишечнике
- •4. Всасывание продуктов гидролиза белков
- •5. Амины
- •Лекция № 13-15. Обезвреживание аммиака в организме, орнитиновый цикл, специфические пути обмена аминокислот.
- •1. Обезвреживание аммиака в организме
- •2. Специфические пути обмена аминокислот
- •Лекция № 16-18. Сложные белки хромопротеины и нуклеопротеины
- •1. Определение хромопротеинов. Гемо- и флавопротеины
- •2. Нуклеопротеины и липопротеины
- •3. Фосфопротеины и гликопротеины
- •Свойства иммуноглобулинов человека
- •Лекция № 19-21. Химический состав и структура нуклеиновых кислот
- •1. Химический состав нуклеиновых кислот
- •2. Особенности структуры нуклеиновых кислот
- •3. Первичная структура нуклеиновых кислот
- •4. Вторичная и третичная структура нуклеиновых кислот
- •Лекция № 22. Обмен нуклеиновых кислот
- •1. Общие представления об обмене нуклеопротеидов
- •Лекция 23-26 биосинтез днк
- •Лекция №27 биосинтез рнк, биогенез мрнк, биосинтез и распад гемоглобина
- •Биосинтез рнк, биогенез мРнк
- •3. Биогенез тРнк и рРнк, синтез рнк на матрице рнк
- •Распад нуклеиновых кислот
- •Биосинтез гемоглобина
- •Лекция № 28. Общие требования к синтезу белка
- •1. Составные части белоксинтезирующей системы, рибосомы и аминоацил-тРнк-синтетазы
- •2. Транспортные и матричные рнк, природа генетического кода
- •Лекция № 29. Синтез и постсинтетическая модификация белка
- •1. Синтез белка и его транспорт через мембраны
- •2. Транспорт синтезированных белков через мембраны
- •3. Регуляция синтеза белка
- •Лекция № 30-31. Понятие о ферментах, их химическая природа и строение
- •1. Понятие о ферментах, их химическая природа и строение
- •2. Активный центр ферментов
- •3. Изоферменты
- •Лекция № 32. Механизм действия ферментов
- •1. Механизм действия ферментов
- •2. Кинетика ферментативных реакций
- •Лекция № 34-35. Основные свойства ферментов и факторы, определяющие их активность
- •1. Основные свойства ферментов,
- •2. Активирование и ингибирование ферментов
- •3. Регуляция активности ферментов, определение активности ферментов
- •Лекция № 36. Классификация и номенклатура ферментов
- •Лекция №37-38 липиды загальні відомості, будова, класифікація хімічні властивості
- •Лекция №39-40 глицериды фосфолипиды
- •Лекция№41 жирные кислоты
- •Лекция №42 эйкозаноиды
- •Лекция №43-45 биосинтез насыщенных жирных кислот
- •Лекция №46 биосинтез триглицеридов
- •Лекция №47 метаболизм фосфолипидов
- •Лекция №48-49 биосинтез холестерина
- •Лекция №50 метаболизм кетоновых тел
- •Лекция №51-52 окисление жирных кислот
- •Лекция №53-54 углеводы строение, классификация, химические свойства
- •В животных тканях содержатся следующие моносахариды:
- •Лекция №55 переваривание и всасывание углеводов
- •Лекция №56-57 синтез и распад гликогена
- •Лекция №58-59 Тема: Биологическое окисление
- •Лекция № 60-61 гликолиз
- •Лекция№ 62 аэробный метаболизм пирувата
- •Лекция №63-64 глюконеогенез
- •Лекция 65-67 Цикл Трикарбоновых кислот.
- •Лекция № 68-69 пентозофосфатный путь окисления углеводов
- •Лекция №70 регуляция метаболизма углеводов
- •Лекция №71-72. Тема: взаимосвязь обмена белков, нуклеиновых кислот, углеводов и липидов
- •Литература
Лекция № 6-9. Физико-химические свойства белков, их структурная организация, классификация белков
1. Физико-химические свойства белков. Понятие структурной организации белков
Характерными физическими свойствами белков являются высокая вязкость растворов, ограниченная способность к диффузии, способность к значительному набуханию, оптическая активность, подвижность в электрическом поле. Белки обладают большой гидрофильностью, чем обусловлено высокое онкотическое давление белков. Растворы белков имеют низкое осмотическое давление.
Белки способны к поглощению ультрафилетового излучения с длиной волны менее 280 нм.
Белковые молекулы обладают большой молекулярной массой (6000—1 000 000) и не способны проникать через полупроницаемые искусственные мембраны и биомембраны здоровых живых организмов.
Форма белковых молекул
В природе существует два вида белковых молекул: нитевидные (фибриллярные) и шарообразные (глобулярные). Физико-химические и биологические свойства белков в свободном или связанном состоянии определяются их пространственной структурой.
Денатурация белков — нарушение общего плана строения белковой молекулы, приводящее к потере характерных для нее свойств под влиянием различных физических и химических факторов. Внешне денатурация проявляется потерей растворимости, повышением вязкости, резким снижением биологической активности белка.
Ренатурация белка (обратный процесс с полным восстановлением структуры и функции молекулы белка) возможна при непродолжительном действии денатурирующего агента. Денатурация необратима при нарушении первичной структуры белка.
Изоэлектрическая и изоионная точки белков
Значение pH раствора, при котором суммарный заряд белковых молекул равен нулю, — это изоэлектрическая точка белка (pI). Она определяется аминокислотным составом белка. В изоэлектрической точке белки наименее устойчивы в растворе, легко осаждаются.
Изоионный раствор белка — раствор, содержащий только ионизированные остатки аминокислот и ионы, образующиеся при диссоциации воды.
Изоионной точкой белка называется значение pH изоионного раствора этого белка.
Понятие о структурной организации белка Полипептидная теория
Полипептидная теория развита и экспериментально доказана Э.Фишером (1902-1919) на основе высказанного ранее А.Я. Данилевским предположения, что пептидная группа является основной связью в белковой молекуле.
Особенности пептидной связи.
1. Аминокислоты соединяются в полипептидные цепи в реакции поликонденсации с образованием пептидной связи за счет α-карбоксильной
группы одной аминокислоты и α-аминогруппы другой.
2. Повторяющиеся группы –NH-CH-CO- образуют пептидный остов.
Атомы N и С в нем располагаются примерно в одной плоскости, а атомы Н и радикалы -CH-R группировок направлены к этой плоскости под углом 109°. При этом в соседних аминокислотных остатках расположение атомов Н и радикалов (R) противоположно.

3. Пептидная связь является промежуточной между простой и двойной связями, т.к. расстояние между С и N в ней меньше (0,1325 нм), чем между Сα и N той же цепи (0,146 нм). Но оно больше, чем расстояние между С и N, соединенных двойной связью (0,127нм). Поэтому по месту пептидных связей легко осуществляется перегруппировка атомов и переход пептидной связи из кето-формы в енольную, которая отличается повышенной реакционной способностью.
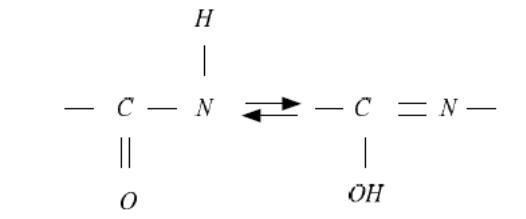
4. Вращение вокруг С – N связи является запретным. Поэтому все четыре атома пептидной связи лежат в одной плоскости, образуя достаточно жесткую планарную ( плоскостную) структуру. Однако возможно вращение между N и соседним Сα (связь N - Сα ) и С пептидной связи и соседним Сα (связь С-Сα). Благодаря этому линейная структура полипептидной цепи может приобретать более сложную пространственную конфигурацию.
5. Пептидная связь имеет транс-конфигурацию, т.е Сα-атомы располагаются по разные стороны от пептидной связи. Такая структура энергетически более выгодна. Образуются прочные ковалентные связи, формирующие энергетический остов молекулы.
6. Каждая пептидная связь может образовывать по две водородные связи с другими группами, в том числе пептидными. Исключение составляют пептидные связи, в образовании которых участвует пролин (формируется одна водородная связь). Там, где находится пролин, полипептидная цепь легко изгибается.
Полимеры, состоящие из аминокислот, образуют пептиды или белки в зависимости от числа входящих в них аминокислоных остатков. Но переход от пептида к пространственно структурированной молекуле белка определяется не механическим удлинением цепи, а специфической последовательностью аминокислот. К белкам относят полипептиды, способные самопроизвольно формировать и удерживать определенную пространственную структуру. Таким образом, отличительный признак белков – это самосборка пространственной структуры, стабилизация которой требует хорошо развитой системы нековалентных взаимодействий. Это может быть достигнуто лишь начиная с некоторой длины полипептидной цепи.
Линейная последовательность расположения аминокислот в полипептиде представляет собой первичную структуру белка.
Всего существует четыре уровня структурной организации белка — первичная, вторичная, третичная и четвертичная структура. Структура большинства белков состоит из трех уровней.
