
- •Лекция №1 зміст, предмет та задачі дисципліни.
- •Лекция №2-4 природные α-аминокислоты. Строение классификация стереоизомерия химические свойства
- •Лекция №5 белки. Общие сведения, функции белков
- •Белки общие сведения.
- •2. Функции белков,содержание белков в органах и тканях
- •Лекция № 6-9. Физико-химические свойства белков, их структурная организация, классификация белков
- •1. Физико-химические свойства белков. Понятие структурной организации белков
- •2. Первичная и вторичная структура белка
- •3. Третичная и четвертичная структура белка
- •4. Классификация белков, химия простых белков, природные пептиды
- •Лекция № 10-12. Особенности белкового обмена, переваривание белков.
- •1. Особенности белкового обмена
- •2. Особенности переваривания белков, эндопептидазы
- •3. Переваривание белков в желудке и кишечнике
- •4. Всасывание продуктов гидролиза белков
- •5. Амины
- •Лекция № 13-15. Обезвреживание аммиака в организме, орнитиновый цикл, специфические пути обмена аминокислот.
- •1. Обезвреживание аммиака в организме
- •2. Специфические пути обмена аминокислот
- •Лекция № 16-18. Сложные белки хромопротеины и нуклеопротеины
- •1. Определение хромопротеинов. Гемо- и флавопротеины
- •2. Нуклеопротеины и липопротеины
- •3. Фосфопротеины и гликопротеины
- •Свойства иммуноглобулинов человека
- •Лекция № 19-21. Химический состав и структура нуклеиновых кислот
- •1. Химический состав нуклеиновых кислот
- •2. Особенности структуры нуклеиновых кислот
- •3. Первичная структура нуклеиновых кислот
- •4. Вторичная и третичная структура нуклеиновых кислот
- •Лекция № 22. Обмен нуклеиновых кислот
- •1. Общие представления об обмене нуклеопротеидов
- •Лекция 23-26 биосинтез днк
- •Лекция №27 биосинтез рнк, биогенез мрнк, биосинтез и распад гемоглобина
- •Биосинтез рнк, биогенез мРнк
- •3. Биогенез тРнк и рРнк, синтез рнк на матрице рнк
- •Распад нуклеиновых кислот
- •Биосинтез гемоглобина
- •Лекция № 28. Общие требования к синтезу белка
- •1. Составные части белоксинтезирующей системы, рибосомы и аминоацил-тРнк-синтетазы
- •2. Транспортные и матричные рнк, природа генетического кода
- •Лекция № 29. Синтез и постсинтетическая модификация белка
- •1. Синтез белка и его транспорт через мембраны
- •2. Транспорт синтезированных белков через мембраны
- •3. Регуляция синтеза белка
- •Лекция № 30-31. Понятие о ферментах, их химическая природа и строение
- •1. Понятие о ферментах, их химическая природа и строение
- •2. Активный центр ферментов
- •3. Изоферменты
- •Лекция № 32. Механизм действия ферментов
- •1. Механизм действия ферментов
- •2. Кинетика ферментативных реакций
- •Лекция № 34-35. Основные свойства ферментов и факторы, определяющие их активность
- •1. Основные свойства ферментов,
- •2. Активирование и ингибирование ферментов
- •3. Регуляция активности ферментов, определение активности ферментов
- •Лекция № 36. Классификация и номенклатура ферментов
- •Лекция №37-38 липиды загальні відомості, будова, класифікація хімічні властивості
- •Лекция №39-40 глицериды фосфолипиды
- •Лекция№41 жирные кислоты
- •Лекция №42 эйкозаноиды
- •Лекция №43-45 биосинтез насыщенных жирных кислот
- •Лекция №46 биосинтез триглицеридов
- •Лекция №47 метаболизм фосфолипидов
- •Лекция №48-49 биосинтез холестерина
- •Лекция №50 метаболизм кетоновых тел
- •Лекция №51-52 окисление жирных кислот
- •Лекция №53-54 углеводы строение, классификация, химические свойства
- •В животных тканях содержатся следующие моносахариды:
- •Лекция №55 переваривание и всасывание углеводов
- •Лекция №56-57 синтез и распад гликогена
- •Лекция №58-59 Тема: Биологическое окисление
- •Лекция № 60-61 гликолиз
- •Лекция№ 62 аэробный метаболизм пирувата
- •Лекция №63-64 глюконеогенез
- •Лекция 65-67 Цикл Трикарбоновых кислот.
- •Лекция № 68-69 пентозофосфатный путь окисления углеводов
- •Лекция №70 регуляция метаболизма углеводов
- •Лекция №71-72. Тема: взаимосвязь обмена белков, нуклеиновых кислот, углеводов и липидов
- •Литература
Лекция № 60-61 гликолиз
Гликолиз (от греч. glycys—сладкий и lysis—растворение, распад) — это последовательность ферментативных реакций, приводящих к превращению глюкозы в пируват с одновременным образованием АТФ.
При аэробных условиях пируват проникает в митохондрии, где полностью окисляется до СО2 и Н2О. Если содержание кислорода недостаточно, как это может иметь место в активно сокращающейся мышце, пируват превращается в лактат.
Итак, гликолиз—не только главный путь утилизации глюкозы в клетках, но и уникальный путь, поскольку он может использовать кислород, еслипоследний доступен (аэробные условия), но может протекать и в отсутствие кислорода (анаэробные условия).
Анаэробный гликолиз—сложный ферментативный процесс распада глюкозы, протекающий в тканях человека и животных без потребления кислорода. Конечным продуктом гликолиза является молочная кислота. В процессе гликолиза образуется АТФ. Суммарное уравнение гликолиза можно представить следующим образом:
![]()
В анаэробных условиях гликолиз — единственный процесс в животном организме, поставляющий энергию. Именно благодаря гликолизу организм человека и животных определенный период может осуществлять ряд физиологических функций в условиях недостаточности кислорода. В тех случаях, когда гликолиз протекает в присутствии кислорода, говорят об аэробном гликолизе.
Последовательность реакций анаэробного гликолиза, так же как и их промежуточные продукты, хорошо изучена. Процесс гликолиза катализируется одиннадцатью ферментами, большинство из которых выделено в гомогенном, клисталлическом или высокоочищенном виде и свойства которых достаточно известны. Заметим, что гликолиз протекает в гиало-плазме (цитозоле) клетки.
Первой ферментативной реакцией гликолиза является фосфорили-рование, т. е. перенос остатка ортофосфата на глюкозу за счет АТФ. Реакция катализируется ферментом гексокиназой:
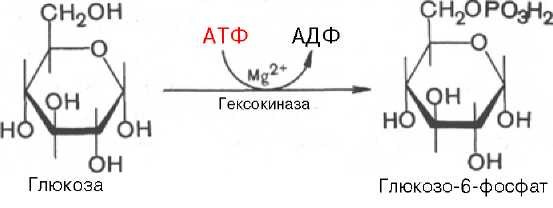
Образование глюкозо-6-фосфата в гексокиназной реакции сопровождается освобождением значительного количества свободной энергии системы и может считаться практически необратимым процессом.
Наиболее важным свойством гексокиназы является ее ингибирование глюкозо-6-фосфатом, т. е. последний служит одновременно и продуктом реакции, и аллостерическим ингибитором.
Фермент гексокиназа способен катализировать фосфорилирование не только D-глюкозы, но и других гексоз, в частности D-фруктозы, D-маннозы и т. д. В печени, кроме гексокиназы, существует фермент глюкокиназа, который катализирует фосфорилирование только D-глюкозы. В мышечной ткани этот фермент отсутствует (подробнее см. главу 16).Второй реакцией гликолиза является превращение глюкозо-6-фос-фата под действием фермента глюкозо-6-фосфат-изомеразы во фруктозо-6-фосфат:
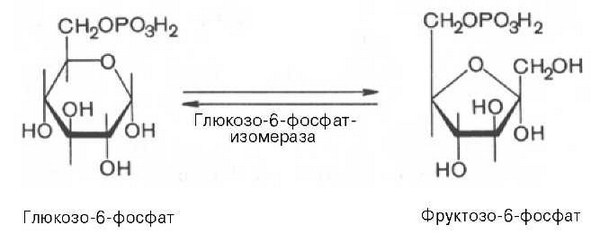
Эта реакция протекает легко в обоих направлениях, и для нее не требуется каких-либо кофакторов.
Третья реакция катализируется ферментом фосфофруктокиназой; образовавшийся фруктозо-6-фосфат вновь фосфорилируется за счет второй молекулы АТФ:
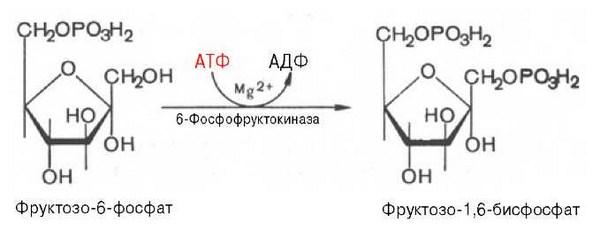
Данная реакция аналогично гексокиназной практически необратима, протекает в присутствии ионов магния и является наиболее медленно текущей реакцией гликолиза. Фактически эта реакция определяет скорость гликолиза в целом.
Фосфофруктокиназа относится к числу аллостерических ферментов. Она ингибируется АТФ и стимулируется АМФ. При значительных величинах отношения АТФ/АМФ активность фосфофруктокиназы угнетается и гликолиз замедляется. Напротив, при снижении этого коэффициента интенсивность гликолиза повышается. Так, в неработающей мышце активность фосфофруктокиназы низкая, а концентрация АТФ относительно высокая. Во время работы мышцы происходит интенсивное потребление АТФ и активность фосфофруктокиназы повышается, что приводит к усилению процесса гликолиза.
Четвертую реакцию гликолиза катализирует фермент альдолаза. Под влиянием этого фермента фруктозо-1,6-бисфосфат расщепляется на две фосфотриозы:
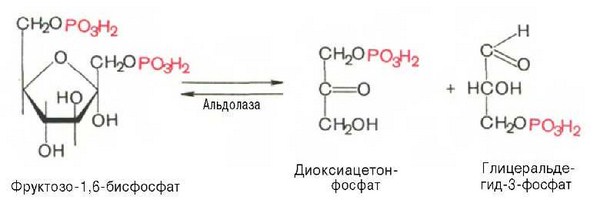
Эта реакция обратима. В зависимости от температуры равновесие устанавливается на различном уровне. При повышении температуры реакция сдвигается в сторону большего образования триозофосфатов (дигидро-ксиацетонфосфата и глицеральдегид-3-фосфата).
Пятая реакция — это реакция изомеризации триозофосфатов. Катализируется ферментом триозофосфатизомеразой:
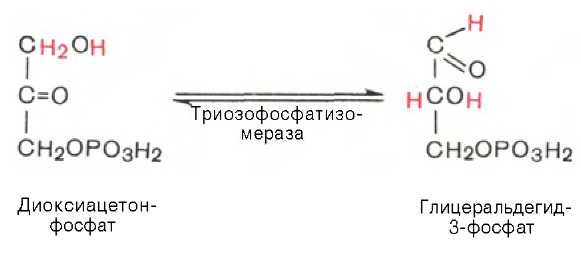
Равновесие данной изомеразной реакции сдвинуто в сторону дигид-роксиацетонфосфата: 95% дигидроксиацетонфосфата и около 5% глице-ральдегид-3-фосфата. В последующие реакции гликолиза может непосредственно включаться только один из двух образующихся триозофосфатов, а именно глицеральдегид-3-фосфат. Вследствие этого по мере потребления в ходе дальнейших превращений альдегидной формы фосфотриозы ди-гидроксиацетонфосфат превращается в глицеральдегид-3-фосфат.
Образованием глицеральдегид-3-фосфата как бы завершается первая стадия гликолиза. Вторая стадия — наиболее сложная и важная. Она включает окислительно-восстановительную реакцию (реакция гликолитической оксидоредукции), сопряженную с субстратным фосфорилированием, в процессе которого образуется АТФ.
В результате шестой реакции глицеральдегид-3-фосфат в присутствии фермента глицеральдегидфосфатдегидрогеназы, кофермента НАД и неорганического фосфата подвергается своеобразному окислению с образованием 1,3-бисфосфоглицериновой кислоты и восстановленной формы НАД (НАДН). Эта реакция блокируется йод – или бромацетатом, протекает в несколько этапов:
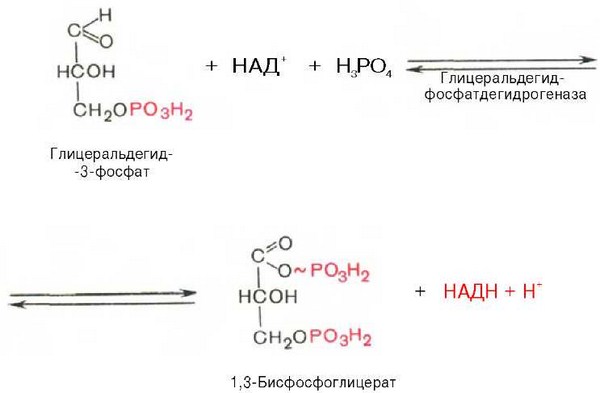
1,3-Бисфосфоглицерат представляет собой высокоэнергетическое соединение (макроэргическая связь условно обозначена знаком «тильда» ~). Механизм действия глицеральдегидфосфатдегидрогеназы сводится к следующему: в присутствии неорганического фосфата НАД+ выступает как акцептор водорода, отщепляющегося от глицеральдегид-3-фосфата. В процессе образования НАДН глицеральдегид-3-фосфат связывается с молекулой фермента за счет SH-групп последнего. Образовавшаяся связь богата энергией, но она непрочная и расщепляется под влиянием неорганического фосфата, при этом образуется 1,3-бисфосфоглицериновая кислота.
Седьмая реакция катализируется фосфоглицераткиназой, при этом происходит передача богатого энергией фосфатного остатка (фосфатной группы в положении 1) на АДФ с образованием АТФ и 3-фосфогли-цериновой кислоты (3-фосфоглицерат):

Таким образом, благодаря действию двух ферментов (глицеральде-гидфосфатдегидрогеназы и фосфоглицераткиназы) энергия, высвобождающаяся при окислении альдегидной группы глицеральдегид-3-фосфата до карбоксильной группы, запасается в форме энергии АТФ. В отличие от окислительного фосфорилирования образование АТФ из высокоэнергетических соединений называется субстратным фосфорилированием.
Восьмая реакция сопровождается внутримолекулярным переносом оставшейся фосфатной группы, и 3-фосфоглицериновая кислота превращается в 2-фосфоглицериновую кислоту (2-фосфоглицерат).
Реакция легкообратима, протекает в присутствии ионов Mg2+. Кофактором фермента является также 2,3-бисфосфоглицериновая кислота аналогично тому, как в фосфоглюкомутазной реакции роль кофактора выполняет глюкозо-1,6-бисфосфат:

Девятая реакция катализируется ферментом енолазой, при этом 2-фосфоглицериновая кислота в результате отщепления молекулы воды переходит в фосфоенолпировиноградную кислоту (фосфоенолпируват), а фосфатная связь в положении 2 становится высокоэргической:
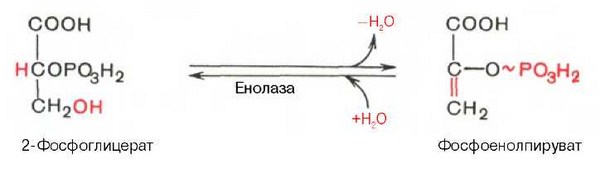
Енолаза активируется двухвалентными катионами Mg2+ или Мп2+ и ингибируется фторидом.
Десятая реакция характеризуется разрывом высокоэргической связи и переносом фосфатного остатка от фосфоенолпирувата на АДФ (субстратное фосфорилирование). Катализируется ферментом пируваткиназой:
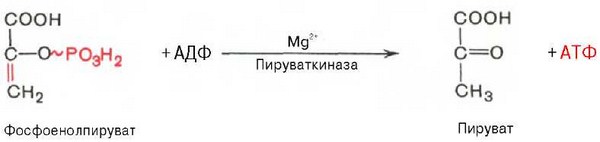
Для действия пируваткиназы необходимы ионы Mg2+, а также одновалентные катионы щелочных металлов (К+ или др.). Внутри клетки реакция является практически необратимой.
В результате одиннадцатой реакции происходит восстановление пировиноградной кислоты и образуется молочная кислота. Реакция протекает при участии фермента лактатдегидрогеназы и кофермента НАДН, образовавшегося в шестой реакции:

Реакция восстановления пирувата завершает внутренний окислительно-восстановительный цикл гликолиза. НАД+ при этом играет роль промежуточного переносчика водорода от глицеральдегид-3-фосфата (6-я реакция) на пировиноградную кислоту (11-я реакция), при этом сам он регенерируется и вновь может участвовать в циклическом процессе, получившем название гликолитический оксидоредукции. Биологическое значение процесса гликолиза заключается прежде всего в образовании богатых энергией фосфорных соединений. На первых стадиях гликолиза затрачиваются 2 молекулы АТФ (гексокиназная и фосфофрук-токиназная реакции). На последующих образуются 4 молекулы АТФ (фосфоглицераткиназная и пируваткиназная реакции). Таким образом, энергетическая эффективность гликолиза в анаэробных условиях составляет 2 молекулы АТФ на одну молекулу глюкозы.
Как отмечалось, основной реакцией, лимитирующей скорость гликолиза, является фосфофруктокиназная. Вторая реакция, лимитирующая скорость и регулирующая гликолиз – гексокиназная реакция. Кроме того, контроль гликолиза осуществляется также ЛДГ и ее изоферментами. В тканях с аэробным метаболизмом (ткани сердца, почек и др.) преобладают изоферменты ЛДГ! и ЛДГ2 (см. главу 4). Эти изоферменты ингибируются даже небольшими концентрациями пирувата, что препятствует образованию молочной кислоты и способствует более полному окислению пирувата (точнее, ацетил-КоА) в цикле трикарбоновых кислот.
В тканях человека, в значительной степени использующих энергию гликолиза (например, скелетные мышцы), главными изоферментами являются ЛДГ5 и ЛДГ4. Активность ЛДГ5 максимальна при тех концентрациях пирувата, которые ингибируют ЛДГ1. Преобладание изоферментов ЛДГ4 и ЛДГ5 обусловливает интенсивный анаэробный гликолиз с быстрым превращением пирувата в молочную кислоту.
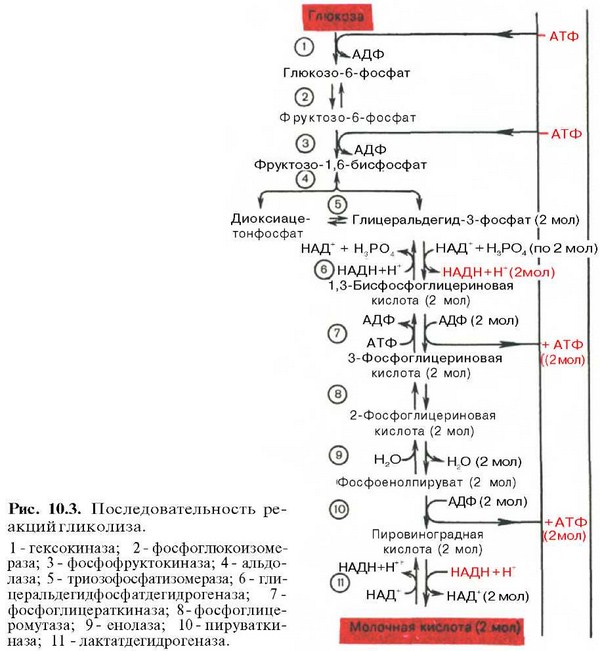
Последовательность протекающих при гликолизе реакций представлена на рис. 10.3.
Как отмечалось, процесс анаэробного распада гликогена получил название гликогенолиза. Вовлечение D-глюкозных единиц гликогена в процесс гликолиза происходит при участии 2 ферментов — фосфорилазы а и фосфо-глюкомутазы. Образовавшийся в результате фосфоглюкомутазной реакции глюкозо-6-фосфат может включаться в процесс гликолиза. После образования глюкозо-6-фосфата дальнейшие пути гликолиза и гликогенолиза полностью совпадают:
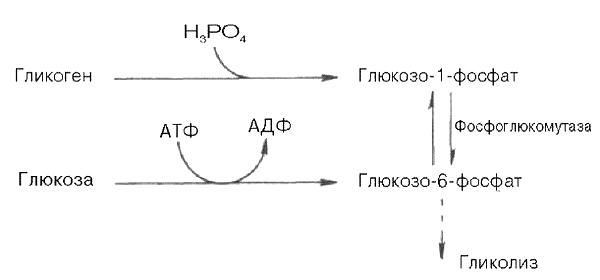
В процессе гликогенолиза в виде макроэргических соединений накапливаются не две, а три молекулы АТФ (АТФ не тратится на образование глюкозо-6-фосфата). Кажется, что энергетическая эффективность гликогенолиза выглядит несколько более высокой по сравнению с процессом гликолиза, но эта эффективность реализуется только при наличии активной фосфорилазы а. Следует иметь в виду, что в процессе активации фосфо-рилазы b расходуется АТФ (см. рис. 10.2).
Спиртовое брожение
Спиртовое брожение осуществляется так называемыми дрожжеподобными организмами, а также некоторыми плесневыми грибками. Суммарную реакцию спиртового брожения можно изобразить следующим образом:
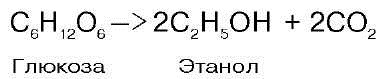
Механизм реакции спиртового брожения чрезвычайно близок к гликолизу. Расхождение начинается лишь после этапа образования пирувата. При гликолизе пируват при участии фермента ЛДГ и кофермента НАДН восстанавливается в лактат. При спиртовом брожении этот конечный этап заменен двумя другими ферментативными реакциями — пируватдекарбо-ксилазной и алкогольдегидрогеназной. В дрожжевых клетках (спиртовое брожение) пируват вначале подвергается декарбоксилированию, в результате чего образуется ацетальдегид. Данная реакция катализируется ферментом пируватдекарбоксилазой, который требует наличия ионов Mg и кофермента (ТПФ):

Образовавшийся ацетальдегид присоединяет к себе водород, отщепляемый от НАДН, восстанавливаясь при этом в этанол. Реакция катализируется ферментом алкогольдегидрогеназой:

Таким образом, конечными продуктами спиртового брожения являются этанол и СО2, а не молочная кислота, как при гликолизе.
Процесс молочнокислого брожения имеет большое сходство со спиртовым брожением. Отличие заключается лишь в том, что при молочнокислом брожении пировиноградная кислота не декарбоксилируется, а, как и при гликолизе в животных тканях, восстанавливается при участии ЛДГ за счет водорода НАДН.
Известны 2 группы молочно-кислых бактерий. Бактерии одной группы в процессе брожения углеводов образуют только молочную кислоту, а бактерии другой из каждой молекулы глюкозы «производят» по одной молекуле молочной кислоты, этанола и СО2.
Существуют и другие виды брожения, конечными продуктами которых могут являться пропионовая, масляная и янтарная кислоты, а также другие соединения.
Включение других углеводов в процесс гликолиза
Фруктоза. Установлено, что фруктоза, присутствующая в свободном виде во многих фруктах и образующаяся в тонкой кишке из сахарозы, всасываясь в тканях, может подвергаться фосфорилированию во фруктозо-6-фосфат при участии фермента гексокиназы и АТФ:
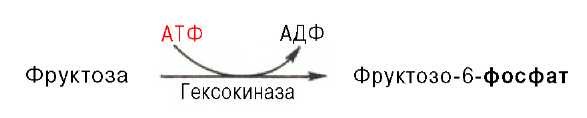

Эта реакция
ингибируется глюкозой. Образовавшийся
фруктозо-6-фос-фат либо превращается в
глюкозу через стадии образования
глюкозо-6-фосфата и последующего
отщепления фосфорной кислоты (рис.
10.4), либо подвергается дальнейшим
превращениям. Из фруктозо-6-фосфата под
влиянием 6-фосфофруктокиназы и АТФ
образуется фруктозо-1,6-бисфос-фат: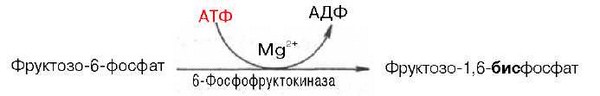
Далее фруктозо-1,6-бисфосфат может подвергаться дальнейшим превращением по пути гликолиза. Таков главный путь включения фруктозы в метаболизм мышечной ткани, почек, жировой ткани.
В печени, однако, для этого существует другой путь. В ней имеется фермент фруктокиназа, который катализирует фосфорилирование фруктозы не по 6-му, а по 1-му атому углерода:
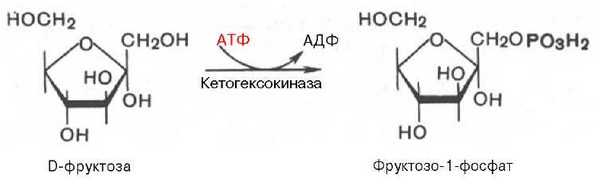
Образовавшийся D-глицеральдегид под влиянием соответствующей киназы (триокиназы) подвергается фосфорилированию до глицеральде-гид-3-фосфата. В этот же промежуточный продукт гликолиза переходит и дигидроксиацетонфосфат.
Существует врожденная аномалия обмена фруктозы, или эссенциальная фруктозурия, которая связана с врожденным недостатком фермента фрук-токиназы, т. е. в организме не образуется фруктозо-1-фосфат. В результате обмен фруктозы возможен только путем фосфорилирования до фрук-тозо-6-фосфата, но эта реакция тормозится глюкозой, вследствие чего фруктоза накапливается в крови. «Почечный порог» для фруктозы очень низок, поэтому фруктозурия обнаруживается уже при концентрации фруктозы в крови 0,73 ммоль/л.
Галактоза. Основным источником галактозы является лактоза пищи, которая в пищеварительном тракте расщепляется до галактозы и глюкозы (рис. 10.5).

Обмен галактозы начинается с превращения ее в галактозо-1-фосфат. Эта реакция катализируется галактокиназой с участием АТФ:
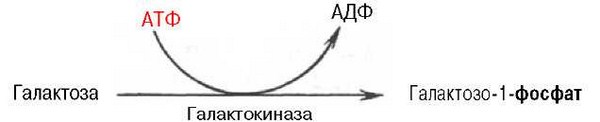
В следующей реакции в присутствии УДФ-глюкозы фермент гексо-зо-1-фосфатуридилилтрансфераза катализирует превращение галактозо-1-фосфата в глюкозо-1-фосфат, одновременно образуется уридиндифосфат-галактоза (УДФ-галактоза):

Образовавшийся глюкозо-1-фосфат в дальнейшем либо переходит в глюкозо-6-фосфат и далее подвергается уже известным превращениям, О дальнейших превращениях глюкозо-1-фосфата см. ранее.
Одно из патологических состояний, возникающих в результате нарушения обмена углеводов,— это рецессивно наследуемое заболевание га-лактоземия. При этом заболевании общее содержание моносахаридов в крови повышается главным образом за счет уровня галактозы, достигая 11,1—16,6 ммоль/л. Концентрация глюкозы в крови существенно не изменяется. Кроме галактозы, в крови накапливается также галактозо-1-фосфат. Галактоземия приводит к умственной отсталости и катаракте хрусталика. Возникновение данной болезни у новорожденных связано с недостатком фермента гексозо-1-фосфатуридилилтрансферазы. С возрастом наблюдается ослабление этого специфического нарушения обмена углеводов.
