
Карцев В.Г. - Избранные методы синтеза и модификации гетероциклов. Том 1 (2003)(ru)
.pdf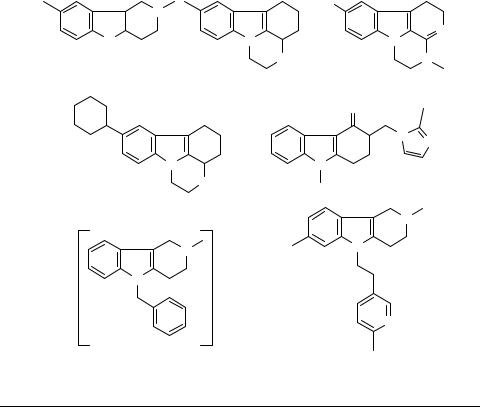
Гетероциклизация производных индоксила и оксиндола
Граник В.Г., Рябова С.Ю., Головко Т.В.
ФГУП Государственный Научный Центр " НИОПИК" 103787, Москва, ул. Б. Садовая 1, корп. 4
Введение
Хорошо известно, что значительная часть лекарственных препаратов по структуре относится к полициклическим соединениям и среди этих систем достойное место занимают три-, тетра- и пентациклические системы, содержащие индольный фрагмент [1, 2]. В качестве примеров можно привести такие известные лекарственные препараты, как нейролептик карбидин; антидепрессанты пиразидол, тетриндол и инказан; противорвотное средство ондансетрон; антигистаминные (противоаллергические) препараты димебон и диазолин и противоопухолевый антибиотик митомицин:
|
N |
|
|
|
MeO |
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
N |
|
N |
|
N |
2HCl |
|
|
|
|
|
|||
H |
|
HCl |
NH |
HCl |
|
N |
|
|
Карбидин |
|
Пиразидол |
|
Инказан |
|
|||
|
|
|
|
|
||||
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
N |
N |
|
|
|
|
|
|
|
|
|
|
|
HCl |
N |
|
|
N |
|
HCl |
|
|
|
NH |
|
|
|
|
||
|
|
|
Ондансетрон |
|
|
|||
Тетриндол |
|
|
|
|
||||
|
|
|
|
|
|
|
||
|
|
|
|
|
|
N |
|
|
|
|
|
N |
|
N |
2HCl |
|
|
|
N |
|
|
|
|
|
||
|
|
C10H6(SO3H)2 |
|
|
|
|
||
|
|
|
|
|
|
|
||
|
|
|
|
|
|
N |
|
|
|
Диазолин |
2 |
|
Димебон |
|
|
|
|
|
|
|
|
|
|
|||
Избранные методы синтеза и модификации гетероциклов, том 1 |
91 |
|
O |
NH2 |
|
|
|
O |
O |
|
H2N |
OMe |
|
N NH
NH
O
Митомицин
К числу наиболее привлекательных подходов к получению таких аннелированных индольных систем относятся синтезы, связанные с использованием в качестве исходных соединений индолинонов-3 и -2 (индоксила и оксиндола). Ранее нами были опубликованы обзоры, посвященные гетероциклизации этих оксопроизводных индола [3, 4]. Целью настоящего сообщения является рассмотрение новейших исследований в этой области.
1. Синтезы на основе производных индолинона-3
1.1 Замыкание пятичленных циклов
Удобный способ синтеза карбонильных соединений индоксильного ряда заключается в конденсации N-ацетилиндоксила 1 с амидацеталями с образованием енаминокетонов 2. Последние могут подвергаться переаминированию, гидролизу до соответствующих формилпроизводных 3a и взаимодействовать с соединениями, имеющими активное метиленовое звено – в последнем случае образуются производные 2-винилиндола 4а. В контексте этого раздела отметим синтез производных пирроло[1,2-a]индолов 5, 6 циклизацией соединений 4b [5] или диендиаминов индольного ряда 7 [6]:
O |
|
O |
H2O/H+ |
|
OH |
O |
|
R2NCH(OR1)2 |
|
|
|
|
|
||
N |
|
N |
NR2 |
|
N |
|
H |
Ac |
|
Ac |
|
|
Ac |
|
|
1 |
|
2 |
|
|
3a |
|
|
OAc |
|
|
OAc |
|
H |
|
|
Ac O |
O |
RCH CN |
|
|
R1 |
N |
R1 |
2 |
|
2 |
|
|
|
||
N |
H |
|
N |
|
CN |
|
|
Ac |
|
|
H |
R |
|
|
|
|
|
4a |
|
|
|||
3b |
|
|
|
|
|
|
|
92 |
Серия монографий InterBioScreen |
O |
+ |
O |
R12NH2 RCN |
R1 |
|
N R1
|
N |
CN |
|
N |
4b |
H |
R |
7 |
H NC NH2 |
|
O |
|
|
O |
|
N |
|
|
N |
|
|
R |
|
CN |
5 |
H2N |
|
6 |
H2N |
R = CO2Et, CONH2
Возможность пиррольных циклизаций подробно обсуждена в работе [7]. Соединение 3 вступает в реакцию с диэтилацеталем диметилформамида 8 по метильной группе N-ацетильного заместителя – весьма необычный процесс для ацетальных конденсаций – и далее следует циклизация с образованием енаминов пирролоиндольного ряда 9:
OAc |
N |
OEt |
OAc |
O |
OH |
O |
|
|
O |
8 |
OEt |
|
|
||
N |
H |
|
|
N |
H |
N |
H |
O |
3b |
|
|
O |
N |
O |
N |
|
|
|
O |
OH |
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
N |
N |
|
N |
N |
|
|
|
|
|
|
||
|
|
|
O |
|
|
9 O |
|
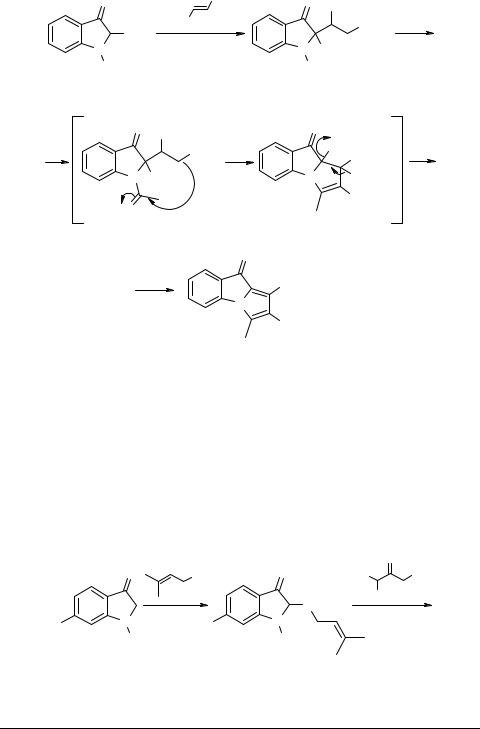
Метод синтеза пирроло[1,2-a]индолов, разработанный в [8], основан на присоединении производных индоксила к активированным этиленовым и ацетиленовым соединениям по Михаэлю. Установлено, например, что при взаимодействии диметилфумарата с 2-метоксииндоксилом 10 образуется аддукт 11, который при нагревании с триэтиламином трансформируется в 1,2-диметоксикарбонил-3- метилпирроло[1,2-a]индолинон-9 12. Предложенная авторами [8] схема процесса циклизации приведена ниже.
Избранные методы синтеза и модификации гетероциклов, том 1 |
93 |
O |
CO2Me |
O |
CO |
Me |
|
MeO2C |
|
|
2 |
CO |
Me |
|
|
|
|||
OMe |
|
|
|
2 |
|
|
N |
|
|
|
|
N |
|
OMe |
|
|
|
Ac |
|
Ac |
|
|
|
10 |
|
11 |
|
|
|
O |
CO |
Me |
O |
|
|
2 |
CO2Me |
|
OMe |
|
|
|
||
|
|
|
CO2Me |
|
|
|
|
|
|
N |
OMe |
|
N |
H |
CO2Me
O
O
CO2Me
N
CO2Me
12
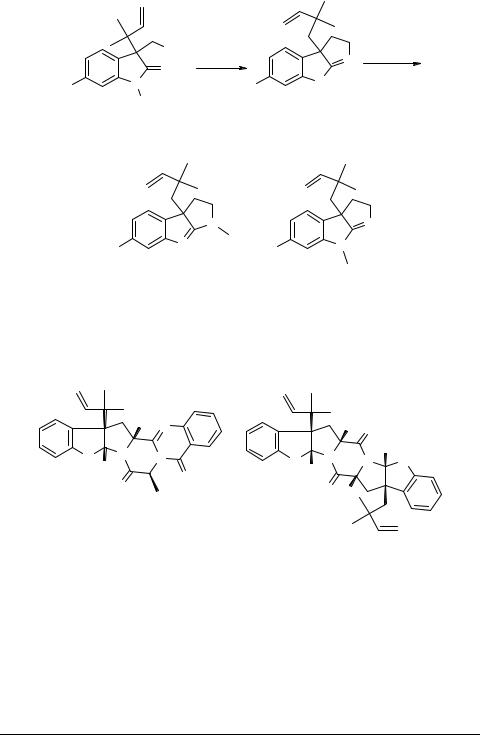
Удобный метод синтеза пирроло[2,3-b]индолов на основе N-ацетилиндоксила и его 6-бромпроизводного разработан с использованием тандема реакций олефинирования и Кляйзеновской перегруппировки. Суть метода [9] заключается в том, что N-ацетилиндоксил 1 или его производное 13 бромируют до 2-бромпроизвод- ного и последнее вводят в реакцию с диметилаллиловым спиртом в присутствии молекулярных сит. В результате образуется аллилоксипроизводное 14, из которого серией последовательных реакций получают соединение 15. Последнее циклизуют в целевое производное пирроло[2,3-b]индола 16. Ниже дана схема этого эффектного синтеза получения флюстрамина C.
|
O |
|
O |
|
O |
|
OH |
EtO |
CN |
||
|
|
|
|
O |
OEt |
|
N |
Br2 Br |
N |
t-BuOK |
|
Br |
|
||||
|
|
||||
|
Ac |
|
Ac |
|
|
|
13 |
|
14 |
|
|
94 |
Серия монографий InterBioScreen |
|
|
CN |
витрид |
|
N |
MeI |
|
|
O |
|
|
||
|
N |
|
N |
|
Na2CO3 |
|
Br |
|
Br |
|
|||
|
Ac |
|
|
H |
|
|
|
|
|
16 |
|
|
|
|
15 |
|
|
|
|
витрид = бис(2-метоксиэткси)алюмгидрид натрия
|
N |
+ |
|
N |
Br |
N |
|
Br |
N |
Флюстрамина C
Этот синтез весьма важен, потому что пирроло[2,3-b]индольная система, содержащая 1,1-диметилаллильный фрагмент в положении 3a, является ключевой субъединицей в целом ряде биологически активных природных веществ, таких как флюстрамин C, ардимин 17 и амауромин 18.
|
H |
N |
|
|
H |
O |
|
N |
N |
N |
|
N |
N |
H |
H |
|
N |
N |
|||||
H |
H |
|
O |
H |
H |
|
|
|
O |
|
|
O H |
|
|
|
|
|
|
|
|
|
||
|
17 |
|
|
18 |
|
|
|
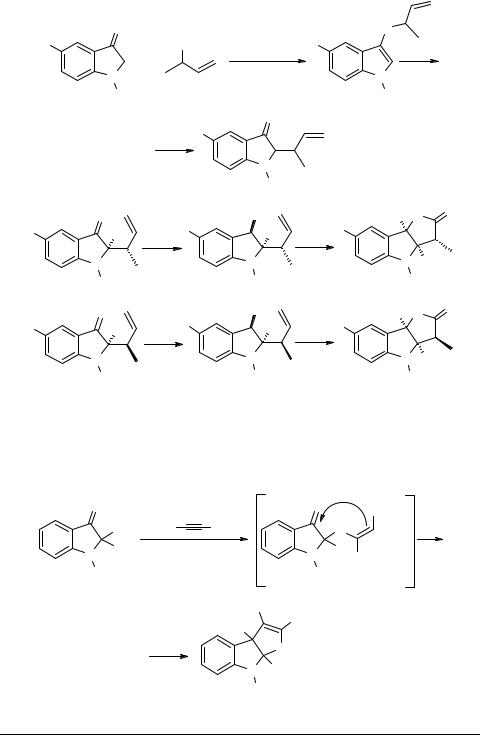
Построение конденсированного фуранового цикла удалось осуществить, используя следующий принцип: сначала реализована реакция замещенных индоксилов с аллиловыми спиртами в присутствии каталитических количеств п-TsOH и сульфата магния, приводящая к получению 2-аллилиндолинонов-3 19. Восстановление карбонильной группы с последующим озонированием, обработка диметилсульфидом (акцептором кислорода) и дальнейшее окисление промежуточного альдегида пиридинийхлорхроматом (PCC) приводит к фуро[3,2-b]индолам 20, 21, причем в зависимости от стереохимии исходного 19, достигается стереонаправленный синтез целевых аннелированных бициклов [10]:
Избранные методы синтеза и модификации гетероциклов, том 1 |
95 |
O
R |
OH |
+
N Ac
R
O
R |
H |
NaBH4 |
R |
|
N |
|
|
|
Ac |
|
|
R |
O |
|
R |
H |
NaBH4 |
||
|
N |
|
|
|
Ac |
|
|
H+, MgSO4
O
N
19 Ac
OH
H
N
Ac
OH
H
N
Ac
O
R
N
Ac
O3 |
R |
H |
O |
O |
|
||||
Me S |
|
|
|
|
2 |
|
|
|
|
PCC |
|
N |
H |
|
|
20 |
Ac |
|
|
|
|
|
|
|
O3 |
R |
H |
O O |
|
Me2S |
|
|
|
|
PCC |
|
N |
H |
|
|
21 |
Ac |
|
|
|
|
|
|
|
Другой путь к фуроиндолам – в этом случае к фуро[2,3-b]индолам – базируется на взаимодействии 2-гидрокси-2-фенилиндоксила 22 с ацетилендикарбоновым эфиром и получении индолил-2-виниловых эфиров 23, замыкающихся затем в трициклические производные 24 [11]:
O |
|
|
O |
CO2Me |
OH MeO2C |
CO2Me |
|
||
|
O |
|||
N Ph |
Na2CO3 |
|
N Ph CO2Me |
|
Ac |
|
|
Ac |
23 |
22 |
|
|
|
|
MeO2C
HO CO2Me
O
N Ph
24 Ac
96 |
Серия монографий InterBioScreen |
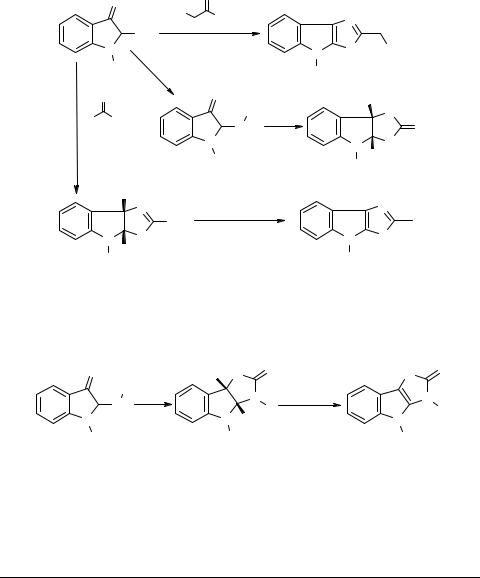
N-Ацетил-2-броминдоксил 25 оказался удобным исходным соединением для синтеза производных тиазоло[5,4-b]индолов и имидазо[4,5-b]индолов [12]. Взаимодействие соединения 25 с тиоамидами RCH2CSNH2 или R'CSNH2 приводит, в зависимости от природы R или R', либо сразу к ароматическим конденсированным тиазолам 26, либо к их гидрированным производным 27, которые могут быть дегидратированы при нагревании. 2-Аминопроизводные индоксила 28, полученные из бромида 25, способны реагировать с изоцианатом калия с образованием гидрированных имидазо[4,5-b]индолов 29.
|
O |
|
R |
S |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
NH2 |
|
N |
|
|
||
|
|
Br |
|
|
|
|
|||
|
N |
R = Ph, PhCH2, CN |
|
S |
|
R |
|||
|
|
N |
|
||||||
|
|
|
|
|
|
||||
25 |
Ac |
|
|
|
|
Ac |
26 |
|
|
S |
|
|
O |
R KNCO |
|
HO |
H |
||
R1 |
NH2 |
|
|
|
|
|
N |
||
|
|
N |
|
|
|
O |
|||
R1 = Me, Ph, |
|
N |
H |
|
N |
|
N |
||
|
пиридил |
28 |
Ac HCl |
29 |
H H |
||||
|
|
|
Ac |
|
|
||||
|
OH |
|
|
|
|
|
|
N |
|
|
|
N |
R1 |
|
|
|
|
|
|
|
N |
S |
для R1 = Me |
|
N |
|
S |
||
|
|
|
|
|
|
||||
27 |
AcH |
|
|
|
|
Ac |
|
|
|
Подобным же образом из аминов 28, но при взаимодействии с роданидом калия синтезированы тионы ряда имидазо[4,5-b]индолов 30 [13].
O |
HO |
H |
S |
Диглим |
H |
S |
N |
P2O5 |
N |
||||
R KNCS |
|
N |
|
85% H3PO4 |
|
N |
N |
|
R |
|
|
||
|
|
|
|
R |
||
N H |
N |
H |
N |
|
||
Ac HCl |
Ac |
|
Ac |
|
||
28 |
|
|
|
30 |
|
|
И в заключение этого раздела отметим исследования, связанные с гетероциклизацией боковых цепей производных индоксила. В упомянутой уже работе [8] производное 2-индолилпропионовой кислоты 31 используется для синтеза спиросоединений, содержащих индольный и фурановый циклы 32, 33:
Избранные методы синтеза и модификации гетероциклов, том 1 |
97 |
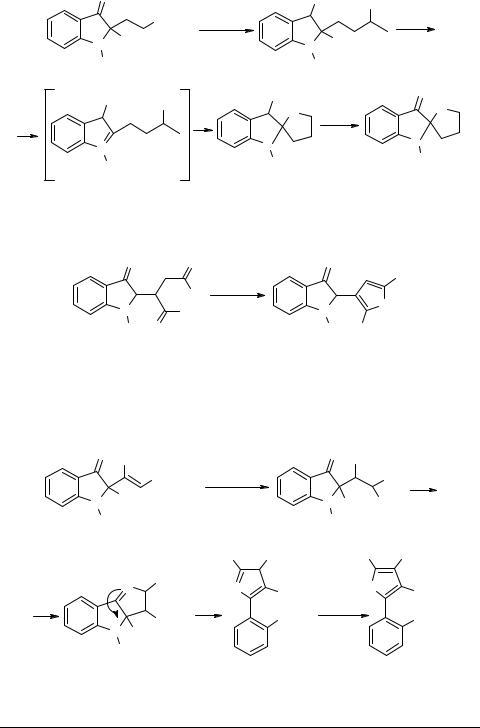
O |
OH |
OH |
|
|
|
COOMe NaBH4 |
|
SnCl4 |
N OMe |
N OMe |
|
31 Ac |
Ac |
|
OH |
OH |
OH |
|
O |
|
O |
ДМСО |
O |
|||
|
|||||
|
|
||||
+ |
|
N |
Ac2O |
N |
|
N |
OR− |
Ac |
|
Ac |
|
Ac |
|
||||
|
32 |
|
33 |
||
|
|
|
В той же работе [8] осуществлен синтез пирролилиндола 34, исходя из аддукта 35 при нагревании с ацетатом аммония.
O |
O |
|
O |
Ph |
|
|
|
NH4OAc |
|
||
|
Ph |
|
|
||
N |
AcOH, t° |
N |
NH |
||
Ph |
|||||
|
|
||||
35 Ac |
O |
|
34 Ac Ph |
|
И, наконец, когда соединение 36, полученное из 2-метоксииндоксила 10 и ацетилендикарбонового эфира, было обработано ацетатом аммония [8] цепь превращений, связанных с раскрытием индольного цикла, привела к замещенному арилпирролу 37:
O CO Me |
|
|
O CO Me |
|||
|
|
2 |
NH4OAc |
|
2 |
CO2Me |
|
|
CO2Me |
|
|
||
|
|
|
|
|
||
N |
OMe |
|
|
N OMe |
NH |
|
|
|
|
|
|||
36 Ac |
|
|
|
Ac |
2 |
|
|
|
|
|
|||
|
|
MeO2C |
CO2Me |
MeO2C |
CO2Me |
|
|
|
N CO2Me |
N |
OMe |
HN |
OMe |
|
|
|
|
|
||
|
N |
CO2Me |
|
NHAc |
|
NHAc |
|
OMe |
|
|
|
|
|
Ac
37
98 |
Серия монографий InterBioScreen |
1.2 Замыкание шестичленных циклов
Обработка соединения 31 при комнатной температуре ацетатом аммония в смеси метанола и уксусной кислоты приводит к гидрированному производному карбазола 38, которое при кипячении с AcONH4 в уксусной кислоте дает дикарбазолиламин 39. Последний может быть получен также непосредственно из 31, без выделения 38 [8]:
O |
CO2Me |
|
|
O |
|
NH4OAc, 20°C |
|
||
N |
OMe AcOH/MeOH |
N |
|
|
|
|
OMe |
||
Ac |
|
|
||
31 |
|
|
Ac |
38 |
|
NH4OAc |
|
NH4OAc |
|
|
|
|
||
|
AcOH |
|
AcOH |
|
|
кипячение |
H |
кипячение |
|
|
|
|
|
|
|
|
N |
|
|
|
N |
|
N |
|
|
Ac |
39 |
Ac |
|
|
|
|
|
|
Реакции Дильса–Альдера – хорошо разработанный метод получения разнообразных циклических систем, таких как, например, дигидропиридины. Такого типа реакции катализируются кислотами Льюиса и соединениями лантанидов [14]. В работе [15] исследованы реакции 2-бензилидениндоксилов 40 с такими олефинами как 1-алкоксиэтены, фенилвинилсульфид, 1,1-диэтоксиэтен. Циклоприсоединение проводят при 110°С при большом избытке диенофила. В качестве катализатора применен 5%-ный Yb(fod)3 – трис(6,7,7,8,8,8-гептафтор-2,2-диметил- 3,5-октандионат) иттербия [16]:
O |
|
O |
R1 |
|
O |
R2 |
R2 |
R1 |
|
||||
|
+ |
|
||||
|
R2 |
|
R1 |
|||
N |
|
N |
N |
|||
|
|
|
|
|||
Ac |
|
Ac |
|
|
Ac |
|
|
R |
|
|
|
|
|
|
|
R |
|
|
R |
|
40 |
|
41 |
|
|
42 |
|
Избранные методы синтеза и модификации гетероциклов, том 1 |
99 |

O |
OEt |
|
|
|
O |
OEt |
O |
O |
|
O |
|
|
|
O |
|||||
N |
m-ClC6H4SO3H |
N |
|
CrO3 |
|
N |
|
||
BF |
.Et |
O |
|
H SO |
4 |
|
|||
Ac |
3 |
2 |
|
Ac |
|
2 |
Ac |
|
|
|
|
|
|
|
|
|
|||
R |
|
|
|
|
R |
|
|
R |
|
45 |
|
|
|
43 |
|
|
44 |
|
|
|
|
|
|
|
|
|
|||
В результате циклоприсоединения получены изомерные пирано[3,2-b]индолы 41, 42. Установлено [15], что окисление соединений этого типа, например, трицикла 43 приводит к спиросоединениям 44, 45. Подобный подход использован в синтезе пентациклических систем 48–50, где в качестве исходных соединений были выбраны бензилидениндоксилы 46, 47, имеющие диметилаллилоксиили диметилаллиламиногруппу в орто-положении бензольного кольца бензилиденового фрагмента [17].
O |
толуол |
|
пиперидин |
+ O |
110°С |
|
N H O
Ac
толуол |
|
O |
|
|
H + |
||
140°C, |
N |
||
|
|||
зап. трубка |
|
||
AcH |
O |
||
|
|||
|
48 |
|
|
O |
|
|
|
N |
N |
|
|
R |
|
||
Ac |
|
|
|
|
47 |
|
O
O 
N Ac
46
O
H
N H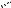
Ac O
|
49 |
|
|
|
O |
|
|
H |
N |
H |
N R |
Ac |
|
|
50 |
|
|
100 |
Серия монографий InterBioScreen |
