
Карцев В.Г. - Избранные методы синтеза и модификации гетероциклов. Том 1 (2003)(ru)
.pdf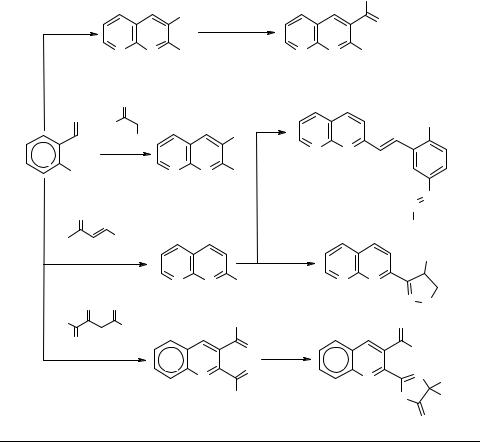
Соединения 13–15 имеют тот же спектр полезных свойств, что и нафтиридины 12, а также предложены в качестве антибиотиков для млекопитающих, добавок к кормам, консервантов и дезинфицирующих средств. Авторами работы [1] отмечено, что для проявления высокой бактерицидной активности характерно α-расположение кетонной и карбоксильной групп в молекуле нафтиридинов, причем эти группы по отношению к атому азота N1 должны находиться соответственно в γ-β-положениях.
Кроме того, тиазолонафтиридины 14 пригодны для лечения бактериальных инфекций у рыб [43], а бензонафтиридины 15 используют в лечении кожных стафилококковых инфекций в ветеринарии, для антибактериальной обработки злаков в сельском хозяйстве [45, 47].
3. Реакция Фридлендера
Данная реакция, основанная на конденсации вицинальных аминопиридинкарбальдегидов 16 с метиленактивными нитрилами 17 [49], кетонами 18, 19 [50–53] и кетодиэфирами 20 [54], использовалась для синтеза нафтиридиновых производных с различными видами пестицидной активности.
CH2(CN)2
17
N N
21
O
O
R
 H 18 R1
H 18 R1
N
NH2
16
O
Ar
19
O O
EtO OEt
O 20
CN NH2OH HCl |
|
NH2 |
|
|
|
|||
|
NOH |
|
|
|||||
|
|
|
|
|
|
|
||
NH2 |
|
N |
N |
NH2 |
|
|
|
|
|
|
|
22 |
|
|
|
|
|
|
|
R1 |
|
|
|
|
OH |
|
|
|
N |
N |
|
|
|
|
|
|
|
|
|
|
|
|
||
N |
N |
R |
+ − |
|
25 |
|
|
|
|
23 |
|
ArN2 Cl |
|
|
|
|
|
|
|
(Ar = 2-OHC6H4) |
|
|
N |
|
||
|
|
|
|
N |
|
|||
|
|
|
|
|
|
|
||
|
|
|
|
|
|
Ar |
|
|
|
|
|
CH2N2 |
|
|
|
Ar |
|
|
|
|
|
|
|
|
|
|
N |
N |
CH=CHAr |
N |
N |
|
|
|
|
|
24 |
|
|
|
26 |
N N |
|
|
|
|
OEt |
|
|
|
O |
H |
|
|
|
|
|
|
|
|
||
N |
|
O 6 стадий |
N |
|
R |
|
||
|
O |
|
|
N |
|
|||
|
N |
|
|
N |
R2 |
|||
|
|
|
|
|
|
|||
|
|
OEt |
|
|
|
HN |
|
R1 |
|
27 |
|
|
|
28 |
|
X |
|
Избранные методы синтеза и модификации гетероциклов, том 1 |
171 |
Так, енаминонитрил 21 и его оксим 22 применяют в качестве антидотов для селективной борьбы с сорняками в посевах ячменя, пшеницы, кукурузы, сорго и риса [49].
2,3-Замещенные нафтиридины 23, (R = R1 = алкил, алкенил, циклоалкил, галоалкил, алкоксиалкил, аминоалкил, арил, бензил, или R+R1 = (CH2)n, где n = 3–5) запатентованы как гербициды и регуляторы роста, а также как средства защиты растений от патогенных грибов [50]. Если в соединениях 23 R = незамещенный или замещенный арил, гетерил, а R1 = Н, то такие соединения являются бактерицидами и нематоцидами [51].
Фунгицидную активность проявляют производные стирилнафтиридинов 24 − продукты азосочетания 25 [52] и 1,3-диполярного циклоприсоединения 26 [53].
Полученные из диэфиров 27 в ходе многостадийного синтеза изомерные (2-имидазолин-2-ил)нафтиридины 28, их соли, N-окиси и конденсированные аналоги 29–31 находят применение в качестве гербицидных препаратов для борьбы с одно- и двудольными однолетними, многолетними и водными растениями [54–56].
|
R1 |
X |
|
R1 |
X |
|
X |
R2 |
|
R2 |
|
|
R2 |
|
|
|
R1 |
O |
N |
N |
O |
N |
NH |
O |
N |
N |
|
|
|
H |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
N |
|
|
N |
|
N |
|
|
N |
|
|
N |
|
|
29 |
|
|
30 |
|
|
31 |
|
28−31 R = Н, алкил; R1 = алкил; R2 = алкил, циклоалкил или
R1+R2 = циклоалкилен; X = O, S
4. Конденсация 2-аминопиридинов с β-дикарбонильными соединениями
Широкие возможности данного подхода для построения нафтиридиновых систем обусловлены большим набором исходных реагентов [4, 57].
Конденсация 2,6-диаминопиридина 32 с γ-хлорацетоуксусным эфиром 33 в условиях реакции Кнорра (85%-ная H3PO4, >100°С) дает замещенный 2-гидрокси- 1,8-нафтиридин 34, используемый для снижения фитотоксического действия гербицидов из класса циклогексенонов или феноксиуксусных кислот [58].
O O |
Cl |
|
Cl |
OEt |
|
33 |
||
|
||
H2N N NH2 |
H2N N N OH |
|
32 |
34 |
172 |
Серия монографий InterBioScreen |

По другому протекает конденсация 2-амино-6-метилпиридина 35 с β-кето- эфиром 36 в варианте метода Конрада–Лимпаха (инертный растворитель, высокая температура), приводя к производному 4-гидрокси-1,8-нафтиридина 37, дальнейшие модификации которого были использованы в многостадийном синтезе соединений 38, 39:
O O
|
OMe |
|
|
|
|
|
C8H17 |
|
∆ |
N |
POCl3 |
|
36 |
|
|||
|
|
|
N |
N |
|
N |
NH2 |
N |
O |
OH |
|
35 |
|
|
C8H17 |
|
C8H17 |
|
|
|
|
37 |
|
|
|
N |
Na2S2O4 |
|
|
N |
N2H4 H2O |
NaOH |
|
N |
|
|
|
N |
H |
|
NH2 |
N |
Cl |
N |
N |
||
|
|
|
NH2 |
|
|
|
C8H17 |
|
C8H17 |
|
C8H17 |
|
|
|
38 |
|
39 |
Нафтиридины 38, 39 в дозе 0.1–5 кг/га обладают фунгицидной активностью в отношении фитопатогенных грибов, особенно Phycomyceten, и эффективны против
Phytophthora infestans на томатах и картофеле, против Phytophthora cactorum на яблоках и против Pseudoperonospora cubensis на огурцах [59].
5. Синтез нафтиридинов, замещенных гетероциклическими функциями
Известно достаточно примеров, когда превращение ациклической функциональной группы в гетероциклическую функцию приводит к увеличению пестицидной активности образующегося нафтиридинового производного. Так, полученные из тиосемикарбазида 40, гидразида 41 и арилметилиденгидразидов 2-метил-1,8-наф- тиридин-3-карбоновой кислоты 42 соответствующие производные, содержащие в положении 3 нафтиридинового ядра фрагмент 1,3,4-тиадиазола-2 43, 4Н-1,2,4- триазола-3 44 [60] и 1,3,4-оксадиазола-2 45, 46 [61], показали более сильное фунги-
цидное действие против Drechslera rostrata и Fusarium oxysporum по сравнению с исходными веществами [62], а соединения 45, 46 приобрели также бактерицидные свойства [61].
Избранные методы синтеза и модификации гетероциклов, том 1 |
173 |

ArNCS
N N
41
ArCO2H
∆
H2SO4
|
|
N |
N |
|
|
H |
43 |
|
O S |
|
|
|
N Ar |
||
|
N |
NH NaOH |
|
|
H |
|
|
N |
N |
|
|
|
40 |
|
|
O |
I2−KI |
|
|
|
NaOH |
|
|
|
NH |
|
|
|
NH2 |
N |
N |
|
|
|
45 |
|
N |
N |
|
|
|
Ar |
FeCl3 |
|
|
O |
|
AcOH
N N
46
N N |
H |
|
S |
N |
|
Ar |
|
|
|
N |
N |
|
|
SH |
|
|
N |
N |
N |
Ar |
|
||
44 |
|
|
N N |
H |
|
O |
N |
|
Ar |
|
Ar
O
 N N H
N N H
N N
42
Аналогично, конденсация 7-аминобензо[f][1,7]нафтиридина 47 с ароматическими альдегидами 48 приводит к продуктам бензимидазо[4,3-fg]-[1,7]нафтириди- нового ряда (49, R = H, Cl, CH3, NO2), которые в отличие от исходного амина 47, обладают бактерицидной и фунгицидной активностью [63].
|
O |
|
N |
R |
N |
H |
||
|
48 |
|
N |
|
N |
NH2 |
|
N |
47 |
|
49 |
|
|
R |
174 |
Серия монографий InterBioScreen |
6. Замещение галогена в нафтиридиновом ядре
Одним из важнейших направлений модификации нафтиридинов является замещение атомов галогенов в реакциях с первичными, вторичными или третичными аминами, которые широко используются для получения аналогов ряда антималярийных [3, 4] и противомикробных препаратов [1, 8, 64], например производных 12 и др. В последнее десятилетие эти методы нашли применение и в синтезе пестицидных средств 50–52, представленных на нижеследующих схемах. Замещение галогена осуществляли соответственно в присутствии оснований (NaH или K2CO3) [65], либо высокотемпературным синтезом без растворителя [66, 67]. Известен пример кросс-сочетания 4-бром(иод)-1,5-нафтиридинов 53 (Hal = Br, I) с элементорганическими производными аренов 54 [Q = Sn(CH3)3, Si(CH3)3, B(OH)2] в апротонном растворителе при катализе солями палладия [68].
|
|
HX |
O |
O R1 |
|
|
|
|
R |
N |
|
|
O |
R |
N |
|
|
|
NaH или K2CO3 |
|
|
|||||
|
N |
Cl |
|
|
N |
X |
||
|
|
|
|
|
||||
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
R1 O |
|
O |
|
|
|
|
|
|
|
50 |
|
|
|
Cl |
|
|
|
X-Y-R |
|
|
|
|
N |
H-X-Y-R |
|
|
|
|
|
|
|
∆ |
N |
|
|
|
|
|
|
|
N |
|
|
N |
|
|
|
|
|
|
|
51 |
|
|
||
|
R4 |
|
OH |
|
|
R4 |
||
|
|
|
|
|
||||
R |
N |
R3 |
|
Pd(PPh3)4 |
R N |
|
R3 |
|
|
N |
+ R5 |
|
|
R1 |
N |
R2 |
|
R1 |
R2 |
R6 |
|
|
||||
|
Hal |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
53 |
|
54 |
|
R5 |
|
|
|
|
|
|
|
|
|
52 |
R6 |
|
50:R = H, Cl, CH3; R1 = Н, алкил; X = O или S
51:R = фенил, 4-FC6H4, циклоалкил (4-фенилциклогексил и др.), гетероарил; X = O, S, S(O), SO2, CH2, =N–; Y = простая связь или алкилен, который может содержать гетероатом
52:R−R6 = Н, галоген, алкил, алкенил, алкинил, галогеналкил, галогеналкенил, галогеналкинил, галогеналкокси, алкокси, алкилтио, алкоксиалкил, замещенная аминогруппа, CN, OR, S(O)nR, где n = 0–2
Избранные методы синтеза и модификации гетероциклов, том 1 |
175 |
Полученные эфиры 50 обладают гербицидными и фунгицидными свойствами, они эффективны в посевах хлопчатника, сои и сахарного тростника [65].
Нафтиридиновые производные 51 активны против насекомых, паукообразных, гельминтов, моллюсков, а также грибов. Заявлены способы их применения в сельском хозяйстве, лесоводстве, для борьбы с экзо- и эндопаразитами в животноводстве, для защиты древесины и других материалов [66, 67].
Соединения 52 пригодны для использования в качестве пред- и послевсходовых гербицидов как самостоятельно, так и в смеси с другими гербицидами и вспомогательными веществами [68]. Аналоги 1,5-нафтиридинов 52, содержащие в положении 4 цикла радикал фторированного бензодиоксола или бензодиоксана 55 (R = замещенный 1,5-нафтиридин-4-ил, n = 1, 2), их N-окиси и соли также приемлемы для сельского хозяйства как гербициды [69].
O
R (CF2 )n O
55
Из реакций замещения другого типа следует отметить синтез сульфонамида 56, являющегося гербицидом и регулятором роста [70].
Cl
SO2Cl
H2N N N |
HN N N |
O S O
S O
Cl
56
7. Производные нафтиридина, выделенные из морских организмов
Отдельную группу фунгицидов составляют алкалоиды 57–61, которые содержат 2,7-нафтиридиновый остов, и их синтетические аналоги 62.
N |
|
N |
|
N |
N |
N |
|
R |
|
S X Y z |
S |
N |
N |
N |
R |
|
|
|
O |
|
|
|
|
|
|
|
HN |
|
R1 |
57 |
|
58 |
|
59 |
176 |
Серия монографий InterBioScreen |

N |
|
|
|
N |
R |
|
|
|
|
||
R |
OH |
N |
|
|
R1 |
|
|
|
|
||
N |
N |
|
|
|
N R2 |
|
H |
|
|
O |
|
R |
N |
|
N |
|
|
|
|
|
|||
|
|
O |
|
|
|
60 |
|
61 |
|
62 |
|
57: R = (CH2)2NHCOR4, где R4 = алкил, изо-алкил или R + R1 = O; R1 + R2, R2 + R3 = химическая связь или R3 = Н
59, 60: R = O, S, NOX, где X = H, алкил или арил; R1 = Н, алкил, алкенил, арил, бензил, ацил, бензоил или щелочной металл
62: R, R1, R2= Н, алкил, циклоалкил, алкокси, галоген или R1+R2 = CH=CHCH=CH
Из мантии хищных моллюсков Chelynotus semperi выделены алкалоиды куанониамины A–D общей формулы 57. С ними структурно коррелируют дерцитин 58 и родственные соединения из глубоководных морских губок семейства
Pachastrellidae (Dercitus sp., Stelletta sp.). Алкалоиды 57, 58 проявляют фунгицид-
ную и цитотоксическую активность [71].
Соединения 59 и 60, обладающие высокой противоопухолевой, фунгицидной активностью и используемые для лечения онкологических и грибковых заболеваний, получают экстракцией губок класса Demonspongiae, обитающих у Багамских островов [72].
Природное вещество меридин 61 из морской губки Corticium sp. является ингибитором роста грибов Candida albicans, Cryptococcus neoformans и Trichophyton mentagraphytes [73]. Противогрибковой активностью в отношении перечисленных грибов, а также против Aspergillus fumigatus, обладают сампангин и его производные 62, получаемые циклоконденсацией бензо[2,3]клеистофалина с диацеталями ДМФА [74, 75].
Проведенный анализ литературы за последние 15 лет свидетельствует о все возрастающем внимании к нафтиридиновым производным (прежде всего к представителям 1,8-нафтиридинового ряда), как средствам защиты растений и животных. Это позволяет ожидать обнаружения среди этих соединений еще не одного продукта первостепенной значимости.
Литература
1.Норавян А.С., Пароникян Е.Г., Вартанян С.А., Хим.-фарм. журн. 1985 19
(7) 790.
2.Литвинов В.П., Роман С.В., Дяченко В.Д., Успехи химии 2000 69 (3) 218.
3.Литвинов В.П., Роман С.В., Дяченко В.Д., Успехи химии 2001 70 (4) 345.
4.Гетероциклические соединения, под ред. Яшунского В.Г., М.: Мир, 1965,
т. 7, с. 155.
5.Matusiak G., Sliwa W., Acta Сhim. Hung. 1988 125 (2) 267.
Избранные методы синтеза и модификации гетероциклов, том 1 |
177 |

6.Bachowska B., Sliwa W., Патент ПНР 149 212; РЖХим. 1991 10Н113П.
7.Radzikowska T., Sliwa W., Патент ПНР 149 332; РЖХим. 1991 10Н112П.
8.Miyamoto T., Egawa H., Matsumoto J., Chem. Pharm. Bull. 1987 35 (6) 2280.
9.Танака, Ацуми Х., Заявка Японии 5 993 080; РЖХим. 1985 8О136П.
10.Хиросэ Т., Нисимура Й., Окада Х. и др., Заявка Японии 1 156 961; РЖХим.
1990 20О60П.
11.Vetter O., Lohr R., Kuhn M., et al., Заявка Германии 19 633 480; РЖХим. 1999 9О265П.
12.Petersen U., Grohe K., Zeiler H.-J., Metzger K.G., Заявка ФРГ 3 508 816; РЖХим. 1987 7О111П.
13.Мацумото Д., Накано Д., Тиба К., Накамура С., Заявка Японии 61 243 081;
РЖХим. 1988 8О121П.
14.Culbertson T.P., Doma J.M., Mich T.F., Nichols J.B., Патент США 4 777 175; РЖХим. 1989 16О88П.
15.Weber A., Bouzard D., Essiz M., et al., Патент США 4 954 507; РЖХим. 1991 22О45П.
16.Petersen U., Krebs A., Schenke T., et al., Заявка ФРГ 3 918 544; РЖХим. 1991 22О115П.
17.Grohe K., Dummer W., Kai R., Paessens A., Заявка ФРГ 3 934 082; РЖХим. 1992 9О140П.
18.Petersen U., Krebs A., Schenke T., et al., Заявка ФРГ 4 120 646; РЖХим.
1994 6О96П.
19.Rast H., Scheer M., Hellenbach W., Заявка Германии 19 519 822; РЖХим. 1998 22О167П.
20.Имосэ Д., Тобитака С., Огата С., Заявка Японии 3 218 312; РЖХим. 1994
21О39П.
21.Remuzon P., Bouzard D., Guiol C., Jacquet J.-P., J. Med. Chem. 1992 35 (15) 2898.
22.Remuzon P., Bouzard D., Clemencin C., et al., Eur. J. Med. Chem. 1993 28 (6) 455.
23.Lange P.M., Mitschker A.N.A., Rast H., et al., Заявка ФРГ 3719764; РЖХим. 1989 23О89П.
24.Petersen U., Schenke T., Grohe K., et al., Заявка ФРГ 3 814 517; РЖХим. 1990 22О151П.
25.Petersen U., Schenke T., Krebs A., et al., Заявка ФРГ 3 906 365; РЖХим. 1992 3О153П.
26.Petersen U., Schenke T., Schriewer M., et al., Заявка ФРГ 3 910 920; РЖХим. 1992 1О111П.
27.Phillips T., Bartel S., Krebs A., et al., Заявка ФРГ 4 230 804; РЖХим. 1995 12О103П.
28.Bartel S., Krebs A., Kunisch F., et al., Заявка ФРГ 4 301 246; РЖХим. 1995 22О127П.
29.Himmler T., Petersen U., Bremm K.-D., et al., Заявка ФРГ 4 408 212; РЖХим. 1997 12О45П.
30.Хаякава И., Заявка Японии 60 172 981; РЖХим. 1986 19О115П.
31.Petersen U., Krebs A., Schenke T., et al., Заявка ФРГ 4 121 214; РЖХим. 1993 19О89П.
32.Petersen U., Schenke T., Grohe K., et al., Заявка ФРГ 4 232 172; РЖХим. 1995 12О104П.
178 |
Серия монографий InterBioScreen |

33.Petersen U., Schrock W., Habich D., et al., Заявка ФРГ 4 234 330; РЖХим. 1995 20О114П.
34.Petersen U., Schenke T., Bohm S., et al., Заявка ФРГ 4 339 134; РЖХим. 1997 20О107П.
35.Мацумото Д., Миямото М.Х., Накамура С., Заявка Японии 60 126 284;
РЖХим. 1986 14О100П.
36.Мацумото Д., Накано Д., Тиба К., Накамура С., Заявка Японии 61 189 281;
РЖХим. 1988 5О110П.
37.Кодзима К., Мотоеси М., Заявка Японии 1 110 603; РЖХим. 1990 9О412П.
38.Soler J.E., Заявка Франции 2 548 664; РЖХим. 1985 20О138П.
39.Hubner H., Brunner H., Zeiler H.-J., Заявка ФРГ 3 617 803; РЖХим. 1988 15О84П.
40.Grohe K., Заявка ФРГ 3 632 222; РЖХим. 1989 4О246П.
41.Pollinger N., Serno P., Hofmann W., Burmann D., Заявка ФРГ 3 902 079; РЖХим. 1990 14О199П.
42.Bartel S., Grohe K., Hagemann H., et al., Заявка Германии 19 506 535; РЖХим. 1998 2О376П.
43.Jaetsch T., Hallenbach W., Himmler T., et al., Заявка ФРГ 4 431 122; РЖХим.
1998 1О91П.
44.Antoine M., Barreau M., Desconclois J.-F., et al., Заявка Франции 2 641 783; РЖХим. 1991 10О61П.
45.Antoine M., Barreau M., Desconclois J.-F., et al., Заявка Франции 2 642 070;
РЖХим. 1991 8О59П.
46.Antoine M., Barreau M., Desconclois J.-F., et al., Заявка Франции 2 642 071; РЖХим. 1991 10О62П.
47.Antoine M., Barreau M., Desconclois J.-F., et al., Заявка Франции 2 650 276; РЖХим. 1991 23О114П.
48.Antoine M., Barreau M., Desconclois J.-F., et al., Заявка Франции 2 650 277; РЖХим. 1991 23О115П.
49.Hagen H., Pfister J., Ziegler H., et al., Заявка ФРГ 3 907 938; РЖХим. 1992 3О451П.
50.Bratz M., Meyer N., Konig H., et al., Заявка ФРГ 4 405 712; РЖХим. 1997 17О399П.
51.Reddy K.R., Mogilaiah K., Sreenivasulu B., J. Indian Chem. Soc. 1986 63 (4) 443.
52.Rama R.G., Mogilaiah K., Sreenivasulu B., Indian J. Pharm. Sci. 1989 51 (5) 182.
53.Rama R.G., Mogilaiah K., Sreenivasulu B., Collect. Czech. Chem. Commun. 1989 54 (6) 1716.
54.Nordhoff E., Franke W., Arndt F., et al., Заявка ФРГ 3 601 688; РЖХим. 1988 5О447.
55.Cross B., Los M., Doehner R.F., et al., Патент США 5 252 538; РЖХим. 1995 9О310П.
56.Cross B., Los M., Doehner R.F., et al., Патент США 5 622 913; РЖХим. 1998 24О794П.
57.Чуба В., ХГС 1979 (1) 3.
58.Saupe T., Schaefer P., Wuerzer B., Westphalen K.-O., Заявка ФРГ 3 907 937; РЖХим. 1991 12О440П.
Избранные методы синтеза и модификации гетероциклов, том 1 |
179 |

59.Graf H., Franz L., Ammermann E., Pommer E.-H., Заявка ФРГ 3 644 825; РЖХим. 1989 6О370П.
60.Reddy K.R., Mogilaiah K., Swamy B., Sreenivasulu B., Acta Chim. Hung. 1990 127 (1) 45.
61.Chary M.T., Mogilaiah K., Rama R.G., Sreenivasulu B., J. Indian Chem. Soc. 1990 67 (8) 691.
62.Reddy K.R., Mogilaiah K., Sreenivasulu B., Nat. Acad. Sci. Lett. 1989 12 (6) 193.
63.Paluszewski M., Sliwa W., Патент Польши 167 956; РЖХим. 1996 20О46П.
64.Общая органическая химия, под ред. Бартона Д., Уоллиса У.Д., М.: Химия, 1985, т. 8, с. 300.
65.Turner J.A., Патент США 4 536 208; РЖХим. 1986 13О485П.
66.Caley B.A., Coghlan M.J., Davis L.N., Dreikorn B.A., Патент США 5 240 916; РЖХим. 1995 13О285П.
67.Schaper W., Markl M., Preub R., et al., Заявка ФРГ 4 308 014; РЖХим. 1996 17О267П.
68.Selby T., Патент США 5 110 347; РЖХим. 1994 3О274П.
69.Spedding D.L., Stevenson T.M., Патент США 5 633 218; РЖХим. 1998 23О437П.
70.Saupe T., Klebe G., Schirmer U., et al., Заявка ФРГ 3 804 990; РЖХим. 1990 16О445П.
71.Gunawardana G.P., Koehn F.E., Lee A.Y., et al., J. Org. Chem. 1992 57 (5) 1523.
72.Gunawardana G., McCarthy P.J., Borres N.S., Патент США 5 182 287; РЖХим. 1994 9О158П.
73.McCarthy P.J., Pitts T.P., Gunawardana G.P., et al., J. Natur. Prod. 1992 55 (11) 1664.
74.Clark A.M., Hufford C.D., Liu S., et al., Патент США 5 128 344; РЖХим.
1994 3О86П.
75.Clark A.M., Hufford C.D., Liu S., et al., Патент США 5 227 383; РЖХим. 1994 22О74П.
180 |
Серия монографий InterBioScreen |
