
Карцев В.Г. - Избранные методы синтеза и модификации гетероциклов. Том 1 (2003)(ru)
.pdf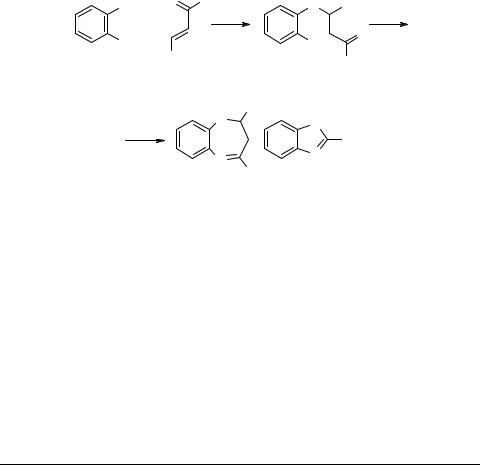
2. Синтез 1,5-дигидродиазепинов
Первое сообщение о взаимодействии о-фенилендиамина (ФДА) с алифатическим α,β-непредельным кетоном – окисью мезитила – появилось еще в 1905 г. [1], хотя лишь в 50-е годы ХХ века удалось убедительно показать, что продукт реакции имеет дигидробензодиазепиновое строение [2, 3]. В то же время, ароматические непредельные кетоны долго оставались малоизученными в конденсациях с о-ди- аминами ароматического и гетероциклического рядов. Одной из причин этого было высказанное в литературе мнение о том, что при взаимодействии ФДА 1 с халконом невозможно образование дигидродиазепинового цикла [2, 4]. По данным этих авторов, в зависимости от условий, такая реакция либо вообще не идет [4], либо приводит к соответствующему β-аминоаддукту 2 или 2-фенил-бензимидазолу 4 [2]. Эти результаты трактовались в [2] как общее правило взаимодействия ФДА с халконами. При этом, невозможность образования ароматических замещенных дигидробензодиазепинов обьяснялась тем, что реакционная способность группы С=О в молекулах халконов существенно ниже, чем С=С связи.
O |
Ph |
H |
Ph |
|
N |
||||
NH2 |
|
NH2 |
+ |
O |
Ph |
NH2 |
|
|
Ph |
|
1 |
|
|
|
2 |
|
|
H Ph |
H |
|
N |
|
|
N |
|
|
, |
|
|
Ph |
|
|
N |
N |
|
Ph |
|
|
3 |
4 |
Первое достоверное сообщение о синтезе 2,4-дифенил-2,3-дигидро-1Н-1,5- бензодиазепина 3 реакцией ФДА с халконом опубликовано в 1977 г. [5].
В ходе более подробных исследований данной реакции [6] убедительно показано, что ее первой стадией является β-аминирование непредельного кетона и образование аддукта 2. В дальнейшем установлен общий характер взаимодействия ФДА с замещенными халконами и их винилогами [7, 8]. В [7] отмечены и неудачные попытки синтеза ароматических замещенных дигидробензодиазепинов, исходя из 1,2-диаминоантрахинона, 4-нитро-, 4-циано-4,6-дихлор- и N-фенил- замещенных о-фенилендиаминов. Не приводит к диазепиновым производным и конденсация ФДА с гидроксифенилхалконами. Единственным выделенным продуктом взаимодействия оказался 2-(2-гидроксифенил)бензимидазол 5. Однако имеются данные о взаимодействии ФДА со сходным по строению о-гидрокси- бензальацетоном, приводящем к образованию бензодиазепина 6 [9]. Взаимодействие сопровождается внутримолекулярной циклизацией с участием гидроксильной группы и C=N связи:
Избранные методы синтеза и модификации гетероциклов, том 1 |
141 |
O
HO
|
OH |
|
N |
|
|
|
|
|
−PhCOMe |
|
N |
|
NH2 |
|
H |
|
O |
5 |
|
|
|
|
|
|
NH2 |
|
H |
|
|
N |
|
1 |
OH |
|
|
|
|
|
O |
|
|
|
N |
|
|
|
6 H |
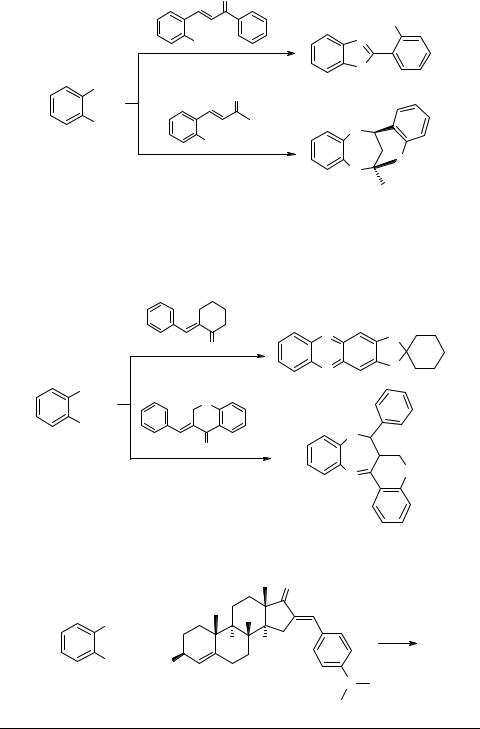
Интересным является и тот факт, что реакция ФДА с бензальциклогексаноном приводит лишь к феноксазину 7, а не к ожидаемому дигидродиазепину [7]. В то же время бензоаннелированные циклические непредельные кетоны в тех же условиях достаточно легко реагируют с ФДА с образованием семичленного дигидроцикла 8 [10].
|
|
|
N |
|
H |
|
|
O |
|
N |
|
|
|
|
|
|
|
|
|
/O/, −PhCHO |
N |
|
N |
|
NH2 |
|
|
|
H |
|
X |
|
7 |
|
|
|
|
|
|
|
|
|
NH2 |
|
|
H |
|
1 |
O |
|
N |
|
|
|
|
|
|
||
|
|
X = CH2 , S, O |
|
N |
X |
|
|
|
|
||
|
|
|
|
8 |
|
По данным [11, 12] циклоконденсация с образованием бензодиазепинов возможна и при использовании более сложных циклических непредельных кетонов:
|
O |
NH2 |
H |
|
|
+ |
H H |
NH2 |
HO |
1 |
N |
142 |
Серия монографий InterBioScreen |
|
|
N |
|
|
|
H |
NH |
|
|
|
|
|
H |
H |
|
|
HO |
|
|
|
|
|
N |
|
|
H |
|
NH2 |
O |
N |
O |
+ |
O |
|
|
|
|
||
NH2 |
O N |
N |
N |
1 |
|
H |
|
|
|
O |
|
|
|
|
Однако, в работе [13] показана несостоятельность выводов [11] о формировании семичленного гетероцикла в первой из указанных выше реакций.
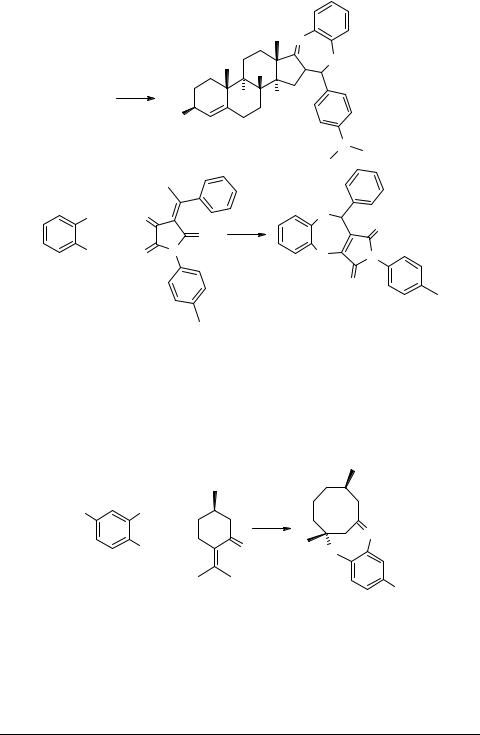
В реакции (R)-(+)-пулегона 9 с замещенными ФДА описана возможность раскрытия цикла непредельного кетона. При этом образуется бензодиазепин 10, аннелированный восьмичленным циклом, имеющим краун-конформацию [14]:
R |
NH2 |
+ |
|
|
|
N |
|
|
NH2 |
O |
HN |
|
|
9 |
R |
|
R = H, Me, Cl |
10 |
|
|
|
|
Помимо ароматических 1,2-диаминов для синтеза 1,5-дигидродиазепинов используют и алифатические диамины – этилендиамин и его производные 11
[15, 16]:
Избранные методы синтеза и модификации гетероциклов, том 1 |
143 |
|
|
O |
R1 |
R2 |
R1 |
R NH2 |
|
|
|
||
+ |
|
R3 |
N |
||
|
|
|
|||
NH2 |
|
R2 |
|
HN |
|
|
R3 |
|
|
||
|
|
|
|
||
11 |
|
|
|
|
|
R = H, Me;
R1 = Me, Ph, 4-CNC6H4, i-Pr, t-Bu, C4H4O;
R2 = H, Me, Ph
Реакция при этом протекает либо при комнатной температуре [16], либо при непродолжительном кипячении в гексане с поташом [15].
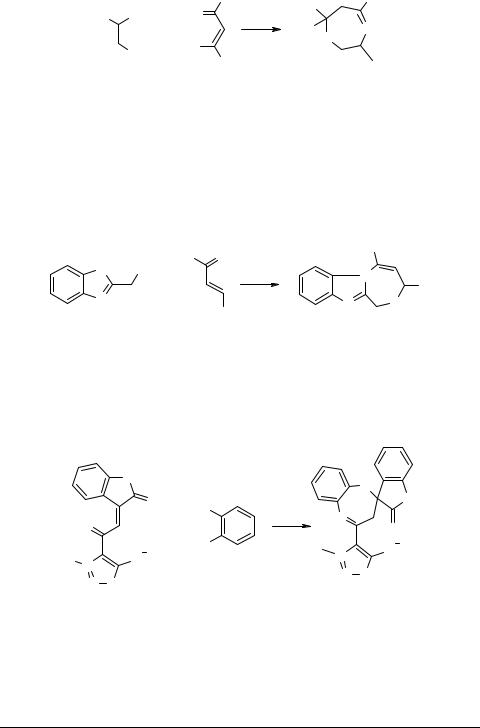
В случае, когда одна из аминогрупп диамина является эндоциклической в составе гетероцикла, в реакциях с непредельными кетонами также могут быть получены дигидродиазепины [17]:
H |
|
Ph O |
|
R |
|
NH2 |
|
|
|
||
N |
+ |
|
N |
Ph |
|
N |
|
|
|
||
|
R |
N |
|
N |
|
|
|
|
|
H |
R = Ph, 2-тиенил
Взаимодействие протекает в достаточно жестких условиях – при длительном нагревании в диметилформамиде.
Интересный пример использования сиднонов 12 в синтезе 1,5-дигидроди- азепинов описан индийскими авторами [18]:
|
|
H |
|
H |
|
|
|
N |
|
|
|
|
|
O |
|
N |
NH |
|
|
H2N |
N |
||
|
|
|
|
||
|
O |
|
+ |
O |
|
|
|
|
|||
|
+ |
|
H2N |
+ |
O |
R |
O |
|
N |
|
|
N |
|
N O |
|
||
|
N O |
|
|
|
|
|
|
|
|
|
|
|
12 |
|
1 |
13 |
|
R= Ph, 4-MeC6H4, 4-MeOC6H4, 4-MeO2CC6H4, 4-ClC6H4, 2-MeO-4-ClC6H4
Впоследние годы в качестве компонентов конденсации с α,β-непредельными кетонами интенсивно изучали диамины гетероциклического ряда – производные
144 |
Серия монографий InterBioScreen |
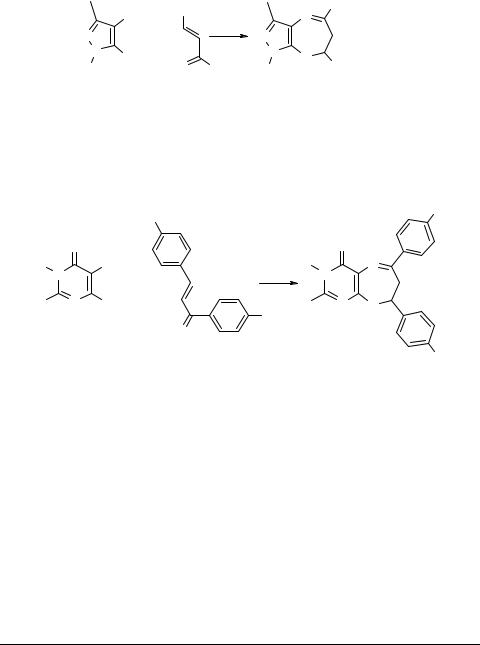
пиразола [19, 20], имидазола [21], тетразола [22], пиридина [23, 24] и пиримидина
[25, 26, 27, 28].
Так, в работах [19, 20] приведены достоверные данные об образовании дигидродиазепиновых систем при взаимодействии 5-метил-2-фенил-2H-пиразол- 3,4-диамина с халконами и диарилиденацетонами:
|
NH2 |
R |
|
N |
R1 |
|
|
|
|
||||
|
|
|
|
|||
N |
+ |
|
N |
|
|
|
N |
NH2 |
O R1 |
N |
N |
R |
|
Ph |
Ph |
|||||
|
H |
R = Ph, 4-ClC6H4, 4-BrC6H4, 4-MeC6H4, 4-MeOC6H4, 4-PhC6H4;
R1 = H, Ph, 4-ClC6H4, 4-BrC6H4, 4-MeC6H4, 4-MeOC6H4, 4-PhC6H4, 4-BrC6H4CH=CH, 4-ClC6H4CH=CH, 4-MeC6H4CH=CH, 4-MeOC6H4CH=CH
Взаимодействие халконов с некоторыми диаминами ряда пиримидина также может приводить к образованию диазепинов [27, 28]:
|
|
|
R4 |
|
|
R3 |
|
|
|
|
|
|
|
|
|
O |
|
|
|
O |
R1 |
N |
NH2 |
+ |
R1 |
N |
N |
|
|
|
|
|||
R2 |
|
N NH2 |
|
|
N N |
|
|
R3 |
R2 |
|
|||
|
|
|
|
|
H |
14 |
O |
|
|
||
|
|
R4 |
R1 |
= H, Me; R2 = OMe, SMe; |
|
R3 |
= H, Cl, OMe, NO2; R4 = H, Me |
|
Что касается имеющихся в литературе сообщений о синтезе дигидроди- и дигидротриазепиновых производных реакцией халконов с такими диаминами, как 1,3-диметил-5,6-диаминоурацил и диаминотетразол [22, 25, 26], то предлагаемая структура продуктов этих взаимодействий оказалась ошибочной [29–32]. Анализ действительнореализующихсяприэтомнаправленийреакциидан нами в разделе5.
Синтез аннелированных диазепинов на основе ароматических непредельных кетонов может включать предварительное превращение халконов в соответствующие 1,3-диарил-2,3-дибром-пропан-3-оны (халкондибромиды). Взаимодействие ФДА и ряда его замещенных с халкондибромидами приводит к образованию производных азиридина 16 [33]. Однако в случае 4-нитро-ФДА, в зависимости от условий, могут быть получены как азиридинохиноксалины 16 (R = NO2), так и производные бензодиазепина 17 [34]. К диазепиновым производным 18 приводит конденсация халкондибромидов с 5,6-диамино-1,3-диметилурацилом 15 [29], азиридиновые производные в этой реакции выделены не были. Отметим, что
Избранные методы синтеза и модификации гетероциклов, том 1 |
145 |
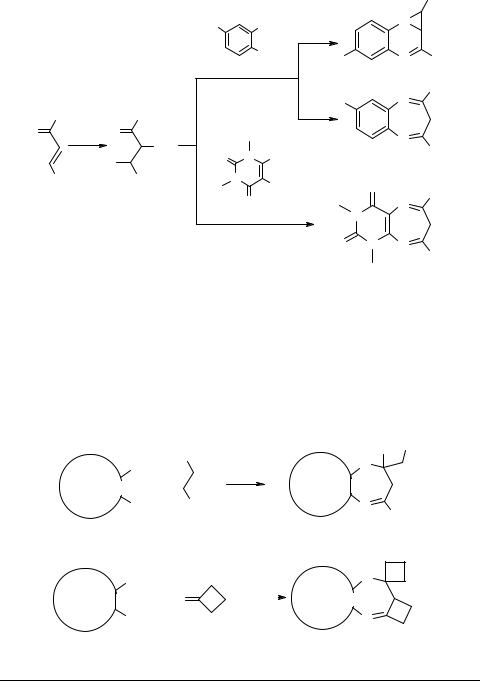
образование соединений 17 и 18 происходит в результате циклизации промежуточных β-енаминокетонов [34, 35], легко выделяемых из реакционной смеси.
|
|
|
|
|
|
|
|
|
|
|
Ar |
|
|
|
|
R |
|
NH2 |
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
16 |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NH2 |
R |
|
|
N Ar' |
|
|
|
|
|
−2HBr, −H2O |
R |
|
|
N |
Ar |
||
|
|
|
|
|
|
|
|||||
|
Ar' |
|
Ar' |
|
|
|
|
|
|
||
O |
O |
|
|
|
|
|
|
|
17 |
||
Br2 |
Br |
|
|
|
|
|
|
N |
Ar' |
||
|
|
|
O |
|
N NH2 |
|
|
|
|||
|
|
Br |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|||
|
Ar |
Ar |
|
N |
|
|
|
|
|
|
|
|
|
|
NH2 |
|
|
O |
|
Ar |
|||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
O |
|
|
|
N |
|
|
|
|
|
|
|
|
N |
|
|
||
|
|
|
|
|
|
15 |
|
|
|
18 |
|
|
|
|
|
−2HBr, −H2O |
|
|
|
|
|||
|
|
|
|
O |
|
N N |
|
||||
|
|
|
|
|
|
|
|
Ar' |
|||
|
|
|
|
|
|
|
|
|
|
|
|
3. Трехкомпонентная конденсация 1,2-диаминов с кетонами
В литературе известны реакции образования гетероциклов при взаимодействии 1,2-диаминов непосредственно с синтетическими предшественниками непредельных кетонов – кетонами, содержащими активированную метильную, либо метиленовую группу. Такого рода циклоконденсации имеют очевидную взаимосвязь с гетероциклизациями на основе непредельных кетонов, что определяет целесообразность их рассмотрения в рамках данного обзора.
|
R1 |
|
|
|
|
|
H |
R1 R2 |
||
|
NH2 |
|
|
O |
|
|
N |
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
Ar, Het |
|
|
|
|||
Ar, Het |
+ 2 |
R2 |
|
|
|
R2 |
||||
|
|
|||||||||
|
NH2 |
|
|
N |
R1 |
|||||
R1 = Alk, Ar, Het |
|
|
|
|||||||
|
|
|
|
|
|
|||||
R2 = H, Alk |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
( )n |
|
|
NH2 |
|
|
|
|
|
N |
|
|
|
Ar, Het |
+ 2 O |
|
|
( )n |
|
Ar, Het |
|
|
( )n |
|
|
|
|
|
|||||||
|
NH2 |
|
|
|
|
|
N |
|
||
|
|
|
|
|
|
|
|
|
||
n = 1, 2, 3 |
|
|
|
|
|
|
|
|
|
|
146 |
Серия монографий InterBioScreen |
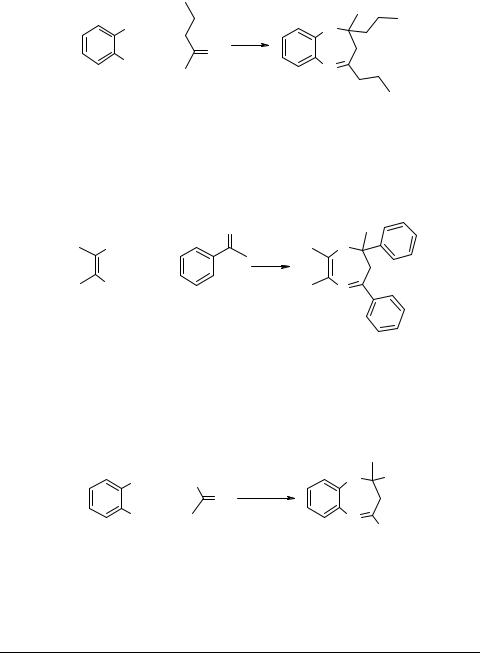
Первое упоминание о реакции диамина с двумя молями кетона с образованием дигидробензодиазепиновой системы относится к 1951 г. [36]. Публикация посвящена взаимодействию ФДА с различными алифатическими кетонами, в частности, с пентан-2-оном:
NH2 |
|
H |
C6H6 |
N |
|
+ 2 |
O |
|
NH2 |
|
N |
В дальнейшем исследованию взаимодействий такого типа было посвящено большое количество работ. Циклоконденсация обычно протекает в условиях кислотного катализа и носит достаточно общий характер. Этим методом получены разнообразные производные как бензо-, так и гетероаннелированных дигидродиазепинов. Имеется пример синтеза и на основе диаминомалеонитрила [37]:
|
|
O |
H |
|
NH2 |
|
|
NC |
NC |
N |
|
NC |
+ |
2 |
|
NH2 |
NC |
N |
Реакция применима как для алифатических (ациклических и циклических) [36, 38–41, 42, 43], так и для ароматических кетонов [41, 44, 45, 46].
В качестве катализатора используют минеральные и органические кислоты. Так, реакции ФДА с насыщенными ациклическими кетонами (например, ацетоном) проводят в присутствии полифосфорной [41] и трифторуксусной [43] кислот:
NH |
R |
|
H |
R |
F3CCO2H |
N |
|||
2 |
2 |
|
|
|
+ |
O |
|
|
|
NH2 |
|
|
N |
R |
|
|
|
|
|
R = Me, Ph |
|
|
|
|
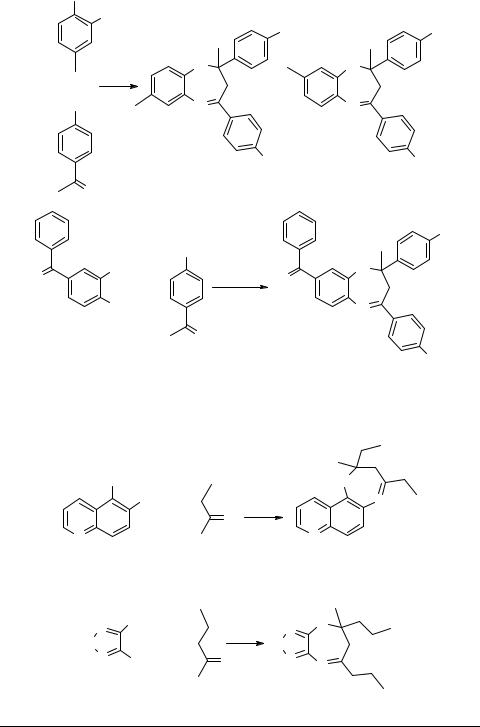
Полифосфорная кислота может быть также использована и во взаимодействии диаминов с ароматическими кетонами [41]. Однако в этом случае лучшие выходы наблюдаются при катализе серной [23, 44, 46] и уксусной [45] кислотами:
Избранные методы синтеза и модификации гетероциклов, том 1 |
147 |
NH2 |
NH2 |
|
|
|
R |
R |
|
|
|
||
|
|
H |
H |
|
H2SO4 |
N |
N |
+ |
+ |
|
|
|
|
||
R |
|
N |
N |
2 |
|
|
|
|
|
R |
R |
O
R
|
R |
|
H |
O |
NH2 |
AcOH |
N |
+ 2 |
O |
||
|
|
|
|
|
NH2 |
|
N |
O
R
R = H, Me, Cl, Br, OMe
Уксусная кислота используется и в реакциях алифатических кетонов с конденсированными ароматическими диаминами [47]:
NH2 |
|
HN |
NH2 |
AcOH |
N |
+ 2 |
O |
N |
N |
|
Пара-толуолсульфокислота может катализировать взаимодействие алифатических кетонов с диаминофуразаном 19 [42]:
|
NH2 |
|
|
H |
N |
TsOH |
N |
N |
|
O |
+ 2 |
|
O |
|
N |
NH2 |
O |
N |
N |
|
19 |
|
|
|
148 |
Серия монографий InterBioScreen |
Взаимодействие хлоргидратов о-диаминов с кетонами проводят без участия катализаторов. Такой метод обычно применяют в реакциях с алифатическими кетонами [40]. Однако при этом требуется более длительное нагревание реакционной смеси, а выходы конечных продуктов ниже, чем при кислотном катализе. В то же время, данный способ позволяет получать тетрагидробензодиазепины 20 без выделения соответствующих дигидродиазепинов введением непосредственно в реакционную смесь боргидрида натрия [39]:
NH2 |
|
H |
NaBH |
N |
|
+ 2 |
4 |
|
O |
|
|
NH2 |
|
N |
2HCl |
|
H |
|
|
20 |
В ряде работ описано применение других типов катализаторов. Например, достаточно высокие выходы дигидродиазепинов (80–90%) наблюдаются при проведении реакции на поверхности MgO в присутствии хлорокиси фосфора [48]. Таким образом получен ряд производных дигидробензодиазепинов с алкильными заместителями:
|
NH2 |
R |
|
N |
R |
|
MgO/POCl3 |
|
|||
|
+ |
O |
|
|
|
|
NH2 |
|
|
N |
|
|
R = Me, Et, Ph |
|
H R |
|
|
|
|
|
|
||
|
|
( )n |
|
H |
( )n |
NH2 |
+ 2 |
MgO/POCl3 |
N |
|
|
|
|
|
|
( )n |
|
NH2 |
|
O |
|
N |
|
|
|
|
|
|
|
n = 1, 2, 3 |
|
|
|
|
|
Хорошие выходы конечных продуктов отмечены и в случае реакции ФДА с циклическими кетонами (циклопентанон, циклогексанон и циклогептанон), что не характерно для обычного кислотного катализа [49, 50].
Использование в качестве катализатора в реакции ФДА с алифатическими кетонами MoO2Cl2 позволяет выделять с удовлетворительными выходами хлоргидраты дигидродиазепинов 21 [38]:
Избранные методы синтеза и модификации гетероциклов, том 1 |
149 |
|
|
|
H |
R |
NH2 |
R |
MoO2Cl2 |
N |
|
|
+ 2 |
O |
|
HCl |
NH2 |
|
MeCN |
N |
|
|
|
R |
||
|
|
|
21 |
|
R = Me, Et, Ar |
|
|
||
|
|
|
||
В реакциях метиленактивных кетонов с несимметричными о-диаминами возникает вопрос о направленности процесса формирования дигидродиазепинового цикла. Взаимодействие несимметричных замещенных о-фенилендиаминов с метиларилкетонами, в которых возможно образование изомерных продуктов A и B, исследовали в работах [23, 34, 44, 46].
|
|
|
|
R |
|
|
|
R2 |
|
|
|
|
N |
|
R2 |
O |
R1 |
N |
R |
|
||||
|
NH2 |
|
H |
|
|
|
A |
|
|
|
+ 2 |
|
|
|
R1 |
|
R2 H |
|
|
NH2 |
|
|
||
|
R |
|
N |
R |
|
|
|
||
|
|
R1 |
N |
|
R = H, MeO, Cl, NO2, EtO; |
|
B |
|
|
R1 = Cl, CN, Br, EtO, Me; |
|
|
R |
|
R2 = Cl, CN, Br, EtO, Me |
|
|
||
Авторами показано, что изомерный состав продуктов реакции зависит от электронного характера заместителей R, R1 и R2.. Усиление электронодонорного характера заместителя R ускоряет процесс образования дигидробензодиазепинов, но при этом усредняется вероятность образования обоих изомеров. Влияние заместителей R1 и R2 также существенно: введение в ФДА сильных электронодонорных или электроноакцепторных групп увеличивает селективность процесса. При этом азометиновая связь в конечном дигидробензодиазепине преимущественно образуется с участием атома азота более нуклеофильной группы исходного диамина.
Та же закономерность обнаружена в [51] при изучении взаимодействия ацетофенонов с гетероциклическими аминами 22 в условиях кислотного катализа:
150 |
Серия монографий InterBioScreen |
