
Карцев В.Г. - Избранные методы синтеза и модификации гетероциклов. Том 1 (2003)(ru)
.pdf
филов. Мы восстанавливали как соединение 15а, так и четвертичные соли 16a и 27 с помощью боргидрида натрия в метаноле.
O |
|
O |
O H1 |
|
|
N H 3 |
H2 |
NH |
3 |
N |
|
H |
|
N |
N 3H |
N |
|
||
1H |
|
1H |
|
2H |
|
2 H |
|
34 |
|
35 |
36 |
Интересной особенностью полученных соединений 34–36 является наблюдаемое в их ПМР спектрах дальнее спин-спиновое взаимодействие между протонами Н-1 и Н-3, находящимися в W-конформации по отношению друг к другу.
Ряд солей изоиндолохиназолинонов прошел биологический скрининг, показав различную степень нейротропной активности по аналептическому типу действия. Наиболее перспективными оказались соли типа 16, обладающие достаточно высокой биологической активностью, хорошей растворимостью и относительно низкой токсичностью. Сравнительное их исследование с коразолом и бемегридом, применяющимися в клинике в качестве аналептических средств, показало, что они по эффективности возбуждение дыхания в 5 раз превышают стандарты, стимулируют биоэлектрическую активность мозга при отсутствии преcсорного эффекта и характеризуются более чем в 10 раз меньшей токсичностью [16].
3. Изохинохиназолины
3.1 Синтез изохино[2,3-a]хиназолинов
Дальнейшее развитие разрабатываемый нами подход к синтезу конденсированных хиназолинов, основанный на конденсации ω-галогензамещенных нитрилов с антраниловыми кислотами и их эфирами, получил с введением в синтетическую практику о-(бромметил)фенилацетонитрила 37 [40]. Было найдено, что при конденсации 37 с эфирами антраниловой кислоты 38a (R = Me, Et) образуется гидробромид 7,12-дигидро-5Н-изохино[2,3-а]хиназолин-5-она 39а с выходом 86% в пропаноле-2 [41] и 91% при сплавлении (110–120°С) [42]. Позже было показано, что эфиры могут быть заменены антраниловой кислотой, но выходы при этом существенно понижаются [43]. Синтез изохинохиназолинонов 39b–g из соответствующих замещенных в бензольном ядре антраниловых кислот 3b–d, f (R = H) или их эфиров 38e, g (R = Me) протекает с выходом от 10% (f) до 60% (e).
Избранные методы синтеза и модификации гетероциклов, том 1 |
241 |

CN |
O |
|
O |
R3 |
O R |
R3 |
N |
+ |
NH2 |
|
|
R2 |
R2 |
N |
|
Br |
R1 |
|
R1 |
37 |
38 |
|
|
|
|
|
39 |
38a−e, 39a−e R1 = H; 38a, c, d, f, g, 39a, c, d, f, g R2 = H; 38a, b, e, 39a, b, e R3 = H; 38b, 39b R2 = Cl;
38c, 39c R3 = Br; 38d, 39d R3 = Me; 38e, 39e R2 = CO2Me;
38f, 39f R1 = R3 = Cl; 38g, 39g R1 = R3 = Br
Взаимодействием соединения 37 с антранилонитрилом был синтезирован 7,12-дигидро-5Н-изохино[2,3-а]хиназолин-5-имин 40 с выходом 70% [44, 45], который под действием кислот гидролизуется в хиназолинон 39а.
CN |
B: |
N |
|
+ |
|
||
37 |
H |
CN |
|
NH2 |
|
|
|
|
CN |
|
|
∆ |
HBr, ∆ |
41 |
|
|
HBr |
|
|
NH |
|
|
|
N |
HBr, ∆ |
CN |
|
|
|
|
|
N |
|
N |
|
HBr |
|
HN |
HBr |
|
|
|
|
40 |
|
42 |
|
При этом, варьируя условия проведения реакции между бромнитрилом 37 и антранилонитрилом, удалось выделить и идентифицировать промежуточно образующиеся аминонитрил 41 и изохинолинимин 42, а также найти условия их превращения в целевой тетрацикл 40.
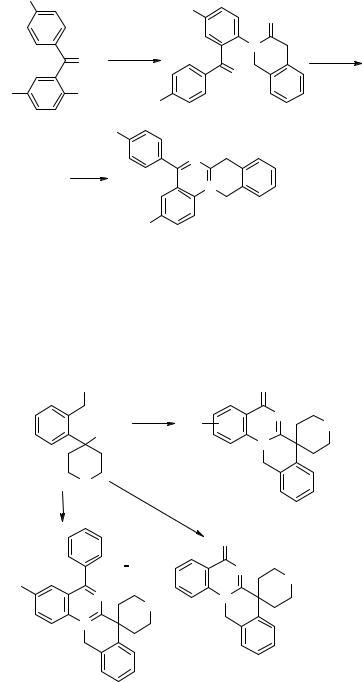
Взаимодействие бромнитрила 37 с о-аминобензофенонами останавливается на стадии образования гидробромидов изохинолиниминов 43, которые при нагревании в уксусной кислоте в присутствии HClO4, претерпевают дальнейшую циклизацию в 5-арил-7H,12H-изохино[2,3-a]хиназолин-13-ий перхлораты 44 с суммарным выходом по двум стадиям до 62% [46].
242 |
Серия монографий InterBioScreen |
R2
|
|
R1 |
|
NH |
|
|
|
|
|
||
|
|
∆ , i-PrOH |
N |
HBr |
|
37 + |
O |
∆ , AcOH |
|||
|
|
||||
O |
|
HClO4 |
|||
|
NH2 |
|
|||
R1 |
R2 |
|
|
||
|
|
|
|
||
|
|
43 |
|
|
|
|
R2 |
|
|
||
N
N+
ClO−4
R1
44
Интересные результаты получены при использовании недавно полученных синтонов, таких как 4-[2-(бромметил)фенил]тетрагидропиран-4-карбонитрил 45 и 1-[2-(бромметил)фенил]-1-циклопентанкарбонитрил 46 [46]. Их конденсация с о-аминокарбонильными соединениями бензольного ряда приводит с выходами 50–80% к производным новых спироциклических систем – спиро[5H-изохино- [2,3-а]иназолин-7(12Н),4'-2Н-пиран]а 47–49 (Х = О) [47] и спиро[5Н-изохино- [2,3-а]хиназолин-7(12Н),1'-циклопентан]а 50–52 (Х = связь) [48].
|
Br |
|
O |
|
|
|
|
R |
|
N |
X |
|
CN |
|
|
||
|
|
N |
|
|
|
|
|
|
|
|
|
|
X |
|
|
|
|
|
45, 46 |
|
47, 50 |
|
|
|
|
|
NH HBr |
|
|
Cl |
Br |
|
N |
|
X |
N |
|
|
|
||
|
N |
|
|
||
|
X |
|
|
||
|
+ |
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
49, 52 |
48, 51 |
|
|
|
|
Избранные методы синтеза и модификации гетероциклов, том 1 |
243 |
|
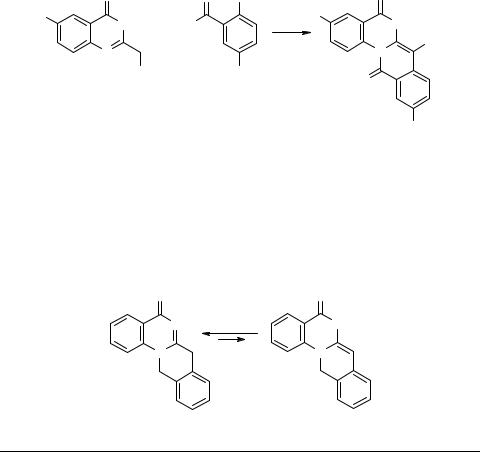
Следует заметить, что первая работа, в которой имеется упоминание о изохинохиназолиновой системе, относится к 1969 году [49]. В ней исследовано взаимодействие о-цианметилбензойной кислоты с различными 1,3-диаминами, но без однозначного доказательства строения продуктов. Позже полученным соединениям было приписано линейное строение изохино[3,2-b]хиназолина [50]. На наш взгляд, это отнесение является предпочтительным. Такой же точки зрения придерживаются авторы работы [51], в которой описан первый достоверный пример синтеза производного изохино[2,3-а]хиназолиновой гетероциклической системы. Использованный ими метод заключается во внутримолекулярном алкилировании соединения Рейссерта, получаемого из 4-фенилхиназолина и о-хлорметилбензоилхлорида. Реакция сопровождается дегидроцианированием и приводит к 5-фенил-12Н-изохино[2,3-а]хиназолин-12-ону. Если положение 4 исходного хиназолина свободно, то аннелирование изохинолинового цикла приводит к образованию 8Н-изохино[3,2-с]хиназолин-8-она [52, 53]. Еще один подход к синтезу изохино[2,3-а]хиназолинов, предложенный в работе [54], основан на циклоконденсации 2-цианметилхиназолин-4(3Н)-онов с метил 2-хлор-5-нитро- бензоатом в присутствии оснований.
|
O |
O Cl |
R |
O |
|
R |
NH + |
MeO |
|
NH |
|
|
|
|
|||
|
|
N |
CN |
||
|
N |
|
|
||
|
|
|
|
||
|
CN |
NO2 |
|
O |
|
|
R = H, Cl |
|
|
|
NO2 |
3.2 Строение и свойства изохино[2,3-a]хиназолинов
Для изохино[2,3-а]хиназолинона 39а, равно как и для других соединений этой серии [55, 56], можно допустить возможность таутомерного превращения в енаминную форму 53. Специально проведенными спектральными исследованиями установлено, что, как в кристаллическом состоянии, так и в растворах (CHCl3, DMSO, спирты), это соединение существует исключительно в иминной форме 39а [57].
O |
O |
N |
NH |
N |
N |
39a |
53 |
244 |
Серия монографий InterBioScreen |
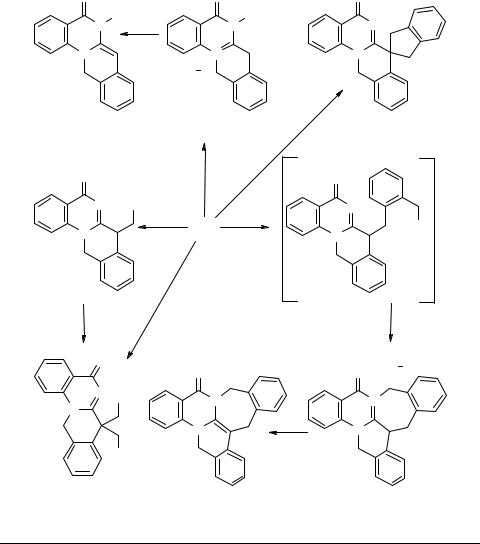
Тем не менее, в химических реакциях это соединение ведет себя как типичный енамин. Именно наличием равновесия 39а 53 можно объяснить легкий дейтерообмен протонов при атоме С(7), наблюдаемый в спектрах ЯМР 1Н в присутствии D2O или CF3CO2D. Алкилирование изохинохиназолинона 39а протекает по N(6) или С(7) в зависимости от природы алкилирующего агента и условий проведения реакции. Так, при алкилировании метилтозилатом [58] и этилиодидом [57] с выходами 31 и 40% соответственно выделены продукты N(6)-алкилирования 54, которые действием триэтиламином превращены в 6-алкил-6,12-дигидро-5H- изохино[2,3-a]хиназолин-5-оны 55. Взаимодействие соединения 39а с бензилгалогенидами или фенацилбромидами приводит к образованию продуктов С(7)-алки-
53 можно объяснить легкий дейтерообмен протонов при атоме С(7), наблюдаемый в спектрах ЯМР 1Н в присутствии D2O или CF3CO2D. Алкилирование изохинохиназолинона 39а протекает по N(6) или С(7) в зависимости от природы алкилирующего агента и условий проведения реакции. Так, при алкилировании метилтозилатом [58] и этилиодидом [57] с выходами 31 и 40% соответственно выделены продукты N(6)-алкилирования 54, которые действием триэтиламином превращены в 6-алкил-6,12-дигидро-5H- изохино[2,3-a]хиназолин-5-оны 55. Взаимодействие соединения 39а с бензилгалогенидами или фенацилбромидами приводит к образованию продуктов С(7)-алки-
лирования 56 (R = Ar, COAr) [57, 59, 60].
O |
O |
|
O |
N R |
N R |
|
N |
N |
+ |
|
N |
N |
|
||
|
X |
|
|
55 |
54 |
|
61 |
O |
|
O |
|
N |
R |
|
N |
N |
39a |
N |
Br |
|
|
58 56
O |
O |
O |
Br |
|
|||
N R |
N |
+ |
|
N |
|
||
N |
|
|
|
|
N |
N |
|
R1 |
|
|
|
57 |
60 |
59 |
|
Избранные методы синтеза и модификации гетероциклов, том 1 |
245 |
||
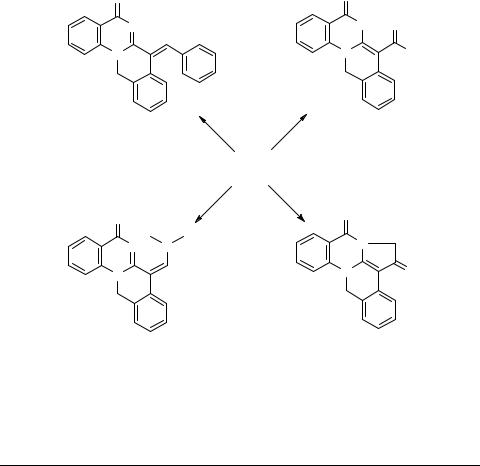
Алкилирование аниона, генерируемого из изохинохиназолина 39а действием сильных оснований, всегда протекает по атому углерода С7, независимо от природы алкилирующего агента, причем остановить реакцию на стадии моноалкилирования не удается. Так, взаимодействие изохинохиназолина 39а в присутствии изопропилата натрия в изопропаноле с небольшим избытком метил- и этилиодида, бензилхлорида приводит к смеси соответствующего 7,7-диалкилпроизводного 57 и исходного вещества.
Алкилирование изохинохиназолина 39 о-ксилилендибромидом в условиях сплавления при 110–120°С сопровождается внутримолекулярным N(5)-алкилиро- ванием с образованием бромида 11-оксо-4b,5,10,16-тетрагидро-11Н-10а-азониа- 15b-азадибенз[a,е]плеядена (59) с выходом 75%.
Принципиально иначе протекает взаимодействие этих же реагентов в присутствии сильных оснований. В этом случае реакция между изохинохиназолином 39а и о-ксилилендибромидом приводит с выходом 80% к спиро[5Н-изохино[2,3-а]- хиназолин-7(12Н), 2'-индан]-5-ону (61). Таким образом, в этих условиях реализуется внутримолекулярное С(7)-алкилирование в интермедиате 58.
O |
O |
|
N |
NH |
O |
N |
N |
R |
62 |
|
64 |
|
39a |
|
O |
O |
|
N N |
|
N |
N |
N |
O |
63 |
65 |
Метиленовая группа при атоме С(7) в 7,12-дигидроизохинохиназолинах проявляет высокую активность в реакциях с карбонильными соединениями. Так, гидробромид изохинохиназолинона 39а.НВr и четвертичная соль 54 (R = Ме) вступают в цианиновые конденсации с п-диметиламинобензальдегидом [61]. Свободное основание 39а при нагревании в спиртовых растворах с ароматическими
246 |
Серия монографий InterBioScreen |

альдегидами в присутствии пиперидина превращается в 7-(1-арилметилиден)-7,12- дигидро-5Н-изохино[2,3-a]хиназолин-5-оны 62 с выходами 75–98% [62]. Арилизоцианаты легко взаимодействуют с изохинохиназолиноном 39а при непродолжительном нагревании в бензоле с образованием N-арил-5-оксо-6,12-дигидро-5H- изохино[2,3-a]хиназолин-7-карбоксамидов 64 (R = NHC6H5, NHC6H4Cl-p) с выхо-
дами ~75%.
При попытке провести формилирование изохинохиназолинона 39а в условиях реакции Вильсмайера (ДМФА–POCl3) был получен 7-(1-диметиламинометил- иден)-7,12-дигидро-5Н-изохино[2,3-a]хиназолин-5-он 63 с выходом 56% [61]. Лишь с низким выходом (29%) удалось получить 5-оксо-6,12-дигидро-5H-изо- хино[2,3-a]хиназолин-7-карбальдегид 64 (R = Н) в результате конденсации изохинохиназолинона 39а с этилформиатом в присутствии метилата натрия. В то же время ацилирование изохинохиназолинона 39а хлорангидридами уксусной и бензойных кислот проходит гладко, позволяя синтезировать 7-ацил-6,12-дигидро- 5H-изохино[2,3-a]хиназолин-5-оны 64 (R = Me, Ar) с выходами 55–60%.
В случае использования хлорацетилхлорида реакция не останавливалась на стадии продукта ацилирования 64 (R = CH2Cl), а сопровождалась циклизацией в 7H,12H-6a,11b-диазабензо[e]ацеантрилен-5,7(6H)-дион 65.
Еще более необычно протекает ацилирование изохинохиназолинона 39a изоникотиноилхлоридом в среде безводного пиридина [63]. Промежуточный 7-изо- никотиноил-6,12-дигидро-5H-изохино[2,3-a]хиназолин-5-он 67 способен вступать в реакцию внутримолекулярного присоединения с образованием производных новой гетероспирановой системы 1'-ацил-спиро[7H,12H-6a,11b-диазабензо[e]аце-
антрилен-6,4'(1'Н)-пиридин]-5,7-дионов 68 (R = СOMe, COC6H4OMe, COPy-4) с
выходами около 70%.
O |
|
O |
NH O |
|
NH O |
N |
|
N |
|
N |
N+ R |
67 |
|
69 |
|
R |
R |
O |
N+ |
N |
|
O |
|
|
N |
N |
N |
O |
O |
N |
|
|
70 |
|
68 |
|
|
|
|
|
|
|
Избранные методы синтеза и модификации гетероциклов, том 1 |
247 |
||||
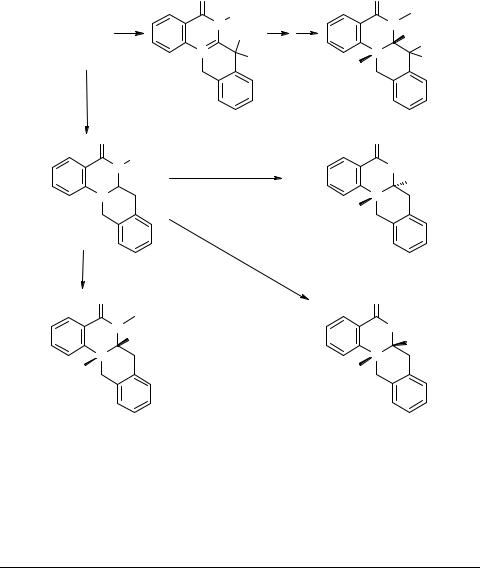
Свободное основание 39а и четвертичная соль 54 (R = Me, X = TosO–) легко подвергаются восстановлению боргидридом натрия с образованием 6,6а,7,12- тетрагидро-5Н-изохино[2,3-а]хиназолин-5-онов 71 (R = H, Me) с выходами 89 и 63% соответственно [59]. Эти соединения могут быть алкилированы по узловому атому азота N(13). Интересными оказались различия в стереохимии этих реакции в зависимости от природы R при N(6). В случае R = Me кватернизация метилтозилатом проходит стереоселективно с образованием с выходом 70% тозилата 6,13-диметил-5-оксо-6,6a,7,12-тетрагидро-5H-изохино[2,3-a]хиназолин-13-ия 72 с цис-ориентацией метильной группы при N(13) и метинного протона при С(6а).
|
O |
|
|
39a, 54 |
N |
R |
|
+ |
D |
||
|
N |
D |
|
ClO |
− |
||
|
|||
|
4 |
|
|
54-7,7-D2 |
|
||
O
N R
N
71
O
+ N H N
TosO−
72
O |
|
|
+ |
N H D |
|
N |
D |
|
TosO− |
||
|
||
72-7,7-D2 |
|
|
O |
|
|
|
NH |
|
+ |
H |
|
N |
|
|
TosO− |
|
|
|
74 |
|
O |
|
|
|
NH |
|
+ |
H |
|
N |
|
|
TosO− |
|
|
|
73 |
В то же время продукт алкилирования производного 71 (R = H) оказался смесью примерно равных количеств цис- и транс-изомеров 73 и 74, каждый из которых выделен в индивидуальном состоянии дробной кристаллизацией.
Строение соединений 72, 73, 74 было установлено на основании спектров ЯМР 1Н с использованием данных NOESY, а также на основе синтеза и исследования дейтерированного аналога 72 (7,7-D2).
248 |
Серия монографий InterBioScreen |
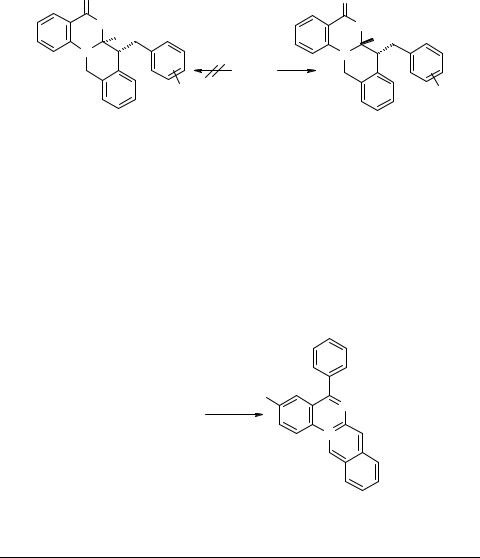
7-Ацилзамещенные изохинохиназолиноны 64 при обработке боргидридом натрия претерпевают дезацилирование с последущим восстановлением промежуточного соединения 39а и образованием в итоге тетрагидропроизводного 71
(R = Н) [62].
Восстановление 7-бензил- и 7-арилиденовых производных 56, 62 происходит высокостереоселективно [62]. Издвухвозможных изомеров, стрео- (75) иэритро- конфигурацией (76), образуются только эритро-изомеры 76 с выходами, близкими к количественным. Очевидно, это связано со стерической предпочтительностью атаки боргидридного аниона с менее экранированной стороны в 7-бензильных интермедиатах.
O |
O |
NH |
NH |
H |
H |
N |
N |
|
56, 62 |
R |
R |
75 |
76 |
Оказались неудачными все попытки провести боргидридное восстановление 7,7-дибензил-замещенных изохинохиназолинонов 57. Лишь спироциклическое соединение 61, в котором стерическое влияние заместителей в положении 7 сведено к минимуму, удалось восстановить в системе спирт–ДМФА кипячением в течение 1ч с пятикратным избытком NaBH4.
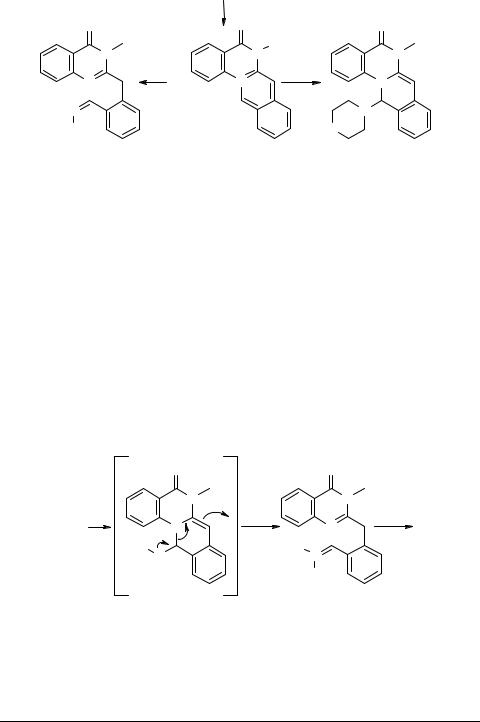
Интересной с теоретической точки зрения представляется ароматизация изохинохиназолиновой системы. Этот процесс был осуществлен при попытке провести конденсацию четвертичной соли 54 (R = Me, X = ClO4–) с п-бром- бензальдегидом в среде уксусного ангидрида. Единственным выделенным с 15% выходомпродуктомреакцииоказался6-метил-5-оксо-5H-изохино[2,3-a]хиназолин- 6-ий перхлорат 77 (R = Me) [61].
|
|
Cl |
N |
44 |
(R1 = Cl, R2 = H) |
|
|
|
+ |
||
|
|
|
|
|
|
|
N |
ClO4−
78
Избранные методы синтеза и модификации гетероциклов, том 1 |
249 |
|
54 |
|
O |
O |
O |
N |
N R |
N |
|
+ |
|
N |
− N |
N |
N |
ClO4 |
N |
|
||
R |
|
X |
80 |
77 |
79 |
Позже [64] был предложен препаративный способ реализации этого превращения, заключающийся в непродолжительном нагревании исходной соли в нитробензоле. Выход дегидрированного производного 77 достигает при этом 90%. В этих же условиях происходит дегидрирование солей соединений 54 (R = Et, X = I–) и 44 (R1 = Cl, R2 = H) с образованием производного 77 (R = Et) и 78.
При изучении соединения 77 (R = Me) показаны выраженные электрофильные свойства изохинохиназолиниевой ароматической системы и установлено, что катион 77 присоединяет нуклеофилы по атому С(12). При действии на 77 NaBH4 в спирте образуется продукт 55 (R = Me), а в спиртово-уксуснокислой среде восстановление проходит глубже до тетрагидропроизводного 71.
Взаимодействие изохинохиназолина 77 с вторичными аминами (морфолин, пиперидин) приводит к аддуктам 79 с выходами около 40%. Реакция с первичными аминами сопрвождается расщеплением изохинолинового цикла и приводит с альдиминам 80. Спектральными методами показано, что на первой стадии этого превращения происходит образование аддуктов 81.
|
O |
|
O |
|
|
|
N |
|
N |
77 |
N |
BH |
N |
B: |
80 |
||||
(R = Me) |
R N |
|
R N |
|
|
|
|
+ |
|
|
H |
|
H |
|
|
|
|
|
|
|
81 |
|
|
82 |
Предложенный механизм аминолиза подтверждается образованием монодейтерированного по метиленовой группе хиназолинона 83 при осуществлении реакции 77 с изопропиламином в D2O.
250 |
Серия монографий InterBioScreen |
