
Карцев В.Г. - Избранные методы синтеза и модификации гетероциклов. Том 1 (2003)(ru)
.pdf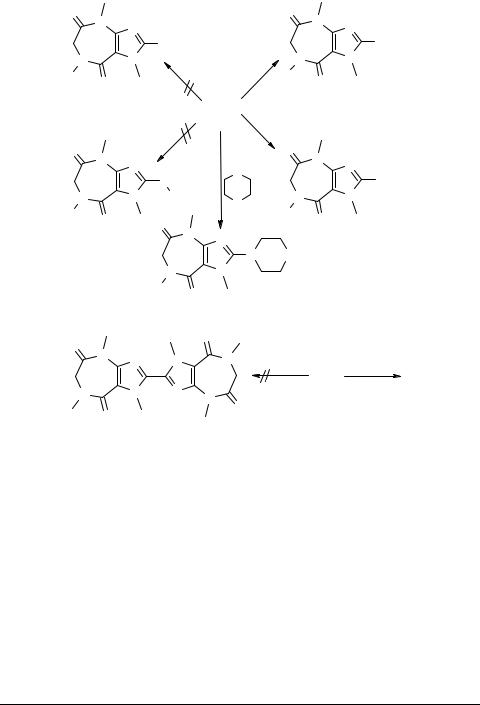
Схема 18
O |
N |
N |
|
|
|
O |
N |
N |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|||
|
|
|
CN |
|
|
|
|
OMe |
|
|
N |
N |
NaCN |
MeONa |
N |
|
N |
||
R |
O |
|
|
|
R |
O 62 R = H |
|||
|
ДМФА, |
|
|
||||||
|
|
|
25, |
MeOH |
|||||
|
|
|
t° |
|
|
|
63 R = Me |
||
|
|
NaSCN |
26, 28 |
C5H11SH |
|
|
|||
|
|
|
KOH |
|
|
||||
O |
|
|
O |
|
|
||||
N |
N |
ДМФА, |
H |
N |
N |
||||
|
|
||||||||
|
|
|
t° |
|
|
||||
|
|
|
S |
N |
|
|
SC5H11 |
||
|
|
|
|
|
|
|
|||
R |
N |
N |
CN |
X |
N |
|
N |
||
O |
|
O |
|
|
R |
O |
64 |
||
|
|
N |
N |
|
|
||||
|
|
|
|
|
65 R = H, X = CH2; |
||||
|
|
|
|
|
X |
||||
|
|
|
|
|
N |
66 R = H, X = O; |
|||
|
|
|
N |
|
N |
|
67 R = H, X = NH; |
||
|
|
|
R |
O |
|
|
68 R = Me, X = CH2; |
||
|
|
|
65−69 |
|
69 R = Me, X = O |
||||
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
||
O |
|
|
|
O |
|
|
|
N |
N |
N |
N |
|
|
|
|
|
Cu, t° |
Cu, t° |
1 |
||||
|
N |
N |
N |
N |
ДМФА |
25 ДМФА |
|
|
O |
|
|
||||
|
|
|
|
|
|
|
O |
70 |
|
По результатам исследований физиологической активности установлено, что некоторые имидазо[4,5-е]-1,4-диазепины рассматриваемого типа проявляют высокую инотропную и гипотензивную активность.
Литература
1.Богатский А.В., Иванов Э.И., Укр. хим. журн. 1980 46 (10) 1074.
2.Иванов Э.И., Богатский А.В., Захаров К.С., Докл. АН СССР 1980 255 (3) 591.
3.Богатский А.В., Андронати С.А., Успехи химии 1970 39 2217.
4.Schulze E., Deutsche Apotheker Zeitung 1975 115 (34) 1253.
5.Nawoiski A., Wiad. Chem. 1977 34 (12) 753.
6.Chimirci A., Gitto R., Grasso S., et al., Heterocycles 1993 36 (3) 601.
7.Chulam M., Podala R., Khalil A., et al., Heterocycles 1986 24 (12) 3489.
8.Schneller S.W., Thompson R.D., Cory J.G., et al., Heterocycles 1984 27 924.
Избранные методы синтеза и модификации гетероциклов, том 1 |
211 |

9.Chu C.K., Cutler S., J. Heterocycl. Chem. 1986 23 289.
10.Huryn D.M., Okabe M., Chem. Rev. 1992 1745.
11.Fujii T., Saito T., Fujisama T., Heterocycles 1988 27 (5) 1163.
12.Isshiki K., Takahashi Y., et al., J. Antibiot. 1987 40 (10) 1461.
13.Bridson P.K., Heterocycles 1994 38 (5) 1007.
14.Bridson P.K., Weirich T.P., J. Heterocycl. Chem. 1988 25 1179.
15.Daly J.W., Hide I., Bridson P.K., J. Med. Chem. 1990 33 (10) 2818.
16.ИвановЭ.И., ЯрощенкоИ.М., КалаяновГ.Д., ХГС1989 (12) 1699.
17.Иванов Э.И., Ярощенко И.М., Калаянов Г.Д., Укр. хим. журн. 1990 56
(12)1316.
18.Иванов Э.И., КалаяновГ.Д., ЯрощенкоИ.М., Геращенко В.В., А. с. СССР
1 684 283, Бюлл. изобрет. 1991 (38) 115.
19.Ohsaki T., Kuviki T., et al., Chem. Pharm. Bull. 1986 34 (9) 3573.
20.КулевЛ.П., ГиреваР.Н., Журн. прикл. хим. 1957 (7) 811.
21.Иванов Э.И., Калаянов Г.Д., Ярощенко И.М., ХГС 1990 (7) 997.
22.Sen A.K., Ray S., Indian J. Chem., Sect. B 1976 14 346.
23.Иванов Э.И., Калаянов Г.Д., ХГС 1992 (4) 511.
24.Иванов Э.И., Калаянов Г.Д., Ярощенко И.М., ХГС 1992 (7) 955.
25.ИвановЭ.И., ХГС 1998 (6) 824.
26.Химия гетероциклических соединений, под ред. Иванского В.И., М.: Высшая школа, 1978, т. 3, с. 424.
27.ИвановЭ.И., ШапироЮ.Е., КалаяновГ.Д. идр., ХГС 1992 (3) 385.
28.Общая органическая химия, под ред. Бартона С.Д., Оллиса У.Д., М.: Химия, 1985, т. 8, с. 588.
29.Калаянов Г.Д., Иванов Э.И., Грищук Л.В., ХГС 1993 (9) 1203.
30.Иванов Э.И., ХГС 1998 (5) 701.
31.ИвановЭ.И., КалаяновГ.Д., ЯрощенкоИ.М., СтепановД.Е., ХГС1989 (11) 1570.
32.ИвановЭ.И., КонупИ.П., КонупЛ.А. идр., Хим.-фарм. журн. 1993 (7) 37.
33.Montgomery J.A., Holum L.B., J. Am. Chem. Soc. 1958 (80) 404.
34.ИвановЭ.И., КалаяновГ.Д., ГрищукЛ.В. идр., Журн. структ. хим. 1993 34 (3) 86.
35.Гетероциклические соединения, под ред. Эльдерфильда Р., М.: Мир, 1969,
т. 8, с. 245.
36.Резниченко Л.А., Кочергин П.М., ХГС 1990 (8) 1140.
37.Гетероциклические соединения, под ред. Эльдерфильда Р., М.: Мир, 1969,
т. 5, с. 302.
38.ИвановЭ.И., КалаяновГ.Д., ЯрощенкоИ.М., ЖОрХ1989 25 (9) 1975.
39.Иванов Э.И., Калаянов Г.Д., Грищук Л.В. и др., Журн. структ. хим. 1993 34
(3)86.
40.Дворкин А.А., Симонов Ю.А., Малиновский А.А. и др., ЖОХ 1993 63
(10)2329.
41.Грень А.И., Калишевич В.С., Мазепа А.В. и др., ЖОХ 1992 62 (12) 2739.
212 |
Серия монографий InterBioScreen |

Пергидроазолы и пергидроазины: Синтез и области применения
Клочкова И.Н., Семенова Н.Н.
Саратовский государственный университет им. Н.Г. Чернышевского 410600, Саратов, ул. Астраханская, 83
Введение
Производные пергидроазинового и пергидроазольного ряда представляют научный и практический интерес вследствие структурной близости к природным соединениям, разнообразной биологической активности и высокой реакционной способности, определяющей их широкие синтетические возможности в плане создания новых практически полезных гетероциклических систем [1–11].
Обзор посвящен анализу методов синтеза пергидроазолов и -азинов, содержащих два или три гетероатома, в частности, имидазолидинового, пиперазинового и гексагидротриазиновых рядов.
1. Конденсация диаминов с монокарбонильными соединениями
При взаимодействии 1,2-диаминов с карбонильными соединениями образуются насыщенные пятичленные гетероциклы с двумя атомами азота.
Получение имидазолидинов 1, исходя из N,N'-дизамещенных этилендиаминов и альдегидов описано в работах [1, 12–29]. Эти реакции протекают обычно в мягких условиях. Выходы циклических продуктов составляют 20–85%, а в некоторых случаях близки к количественным.
|
H |
|
O |
|
|
|
|
R |
R |
||
R |
N R1 |
R2 |
|||
H |
|
||||
R |
N R1 |
|
R1 N |
N R1 |
|
|
H |
|
|
R2 |
|
|
|
|
|
||
|
|
|
|
1 |
R = H, Ph; R1 = Me, Et, CH2 = CH, Pr, i-Pr, Bu, i-Bu, C6H11,
Ph, CH2Ph, p-EtOC6H4, CH(CN)C6H5; R2 = H, Me, Bu, Ph,
p-MeCO2NHC6H4, Het
Конденсация 1,2-диаминов, содержащих одну первичную и одну вторичную аминогруппы этого типа с альдегидами может приводить к ациклическим продуктам – изомерным имидазолидинам основаниям Шиффа [30, 31].
Особенностью реакций алифатических 1,2-диаминов, содержащих первичные аминогруппы, с альдегидами является образование бис-азометинов [1], которые
Избранные методы синтеза и модификации гетероциклов, том 1 |
213 |
могут быть восстановлены натрием в этиловом спирте, амальгамой натрия [12–14, 23], а также каталитическим гидрированием [12, 14] до соответствующих N,N'-ди- замещенных этилендиаминов, которые, в свою очередь, могут быть использованы для синтеза имидазолидинов.
При взаимодействиии этилендиамина с 6-хлоргексаналем создаются условия для внутримолекулярного алкилирования и образования соответствующего конденсированного производного 2 [32].
NH2 |
O |
|
|
|
|
H |
||
|
CH Cl |
2 |
N |
|||||
+ |
|
|
|
2 |
|
|
||
|
|
|
Cl |
|
|
|
N |
|
H |
K CO |
3 |
||||||
NH2 |
|
|
|
2 |
|
|||
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
Циклизация пирролидил-пиперидинов с формальдегидом приводит к пер- гидропиридо[1,2-c]-пирроло[2,1-е]имидазолам 3 структурно близких природным алкалоидным системам [33].
H |
H |
|
|
N |
N HCHO |
|
N |
|
25°C |
N |
|
|
|
||
R |
|
R |
|
R = H, Me |
3 |
|
|
|
|
||
|
|
|
При конденсации 1,2-диаминов с циклогексаноном образуются спироциклические системы 4 [34–37].
|
R R |
R |
H R R |
R NH2 |
|
N |
|
+ O |
|
||
|
|
N |
|
NH2 |
|
|
|
R = H, Me |
|
H |
|
|
|
4 (40%) |
Использование в этой реакции ароматического диамина привело к имидазолидиновым производным с выходами 64–77% [38].
Конденсация N,N'-дизамещенных этилендиаминов с циклогексанонами также приводит к образованию спироциклических имидазолидинов [28]. Так, в случае применения в качестве аминирующего агента N,N'-диметилэтилендиамина в отсутствие кислотного катализатора [39] получен N,N'-диметил-2,2-пентаметилен- имидазолидин с выходом 50%.
2. Конденсация 1,2-диаминов с дикарбонильными соединениями
Для введения карбонилсодержащих функций в имидазолидиновое кольцо в качестве субстратов в реакциях с алифатическими 1,2-диаминами, содержащими две первичные аминогруппы, были использованы 1,3- и 1,4-дикарбонильные соедине-
214 |
Серия монографий InterBioScreen |
ния. Эти реакции характеризуются меньшей селективностью, часто сопровождаются образованием нескольких гетероциклических продуктов [37, 40], либо дальнейшим внутримолекулярным ацилированием функционализированных имидазолидинов, что приводит к образованию конденсированных гетероциклов [41]. Так, при взаимодействии этилендиамина, 1,2-диаминопропана и 2,3-диамино- бутана со сложными эфирами полифторалкилзамещенных 3-кетокарбоновых кислот, наряду тетрагидро-1,4-диазепин-5-онами 6, получены 2-перфторалкилими- дазолидинил-2-ацетаты 5 [37, 40]:
|
|
R1 |
|
|
|
|
|
|
|
R3 |
R2 |
|
Rf |
|||
|
|
O |
O |
|
|
|
|
|
O |
|||||||
|
|
|
|
|
|
|
|
NHR1 + |
|
|
||||||
R2 |
|
|
|
NH2 + Rf |
|
|
|
O |
|
|
HN |
|
NH |
|||
|
|
|
|
|
|
|
HN |
|
||||||||
|
|
|
|
|
|
C6H6 |
|
|||||||||
R3 |
|
|
NH2 |
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
R4 |
Rf |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
O R4 |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
6 |
|||
|
|
|
|
|
|
|
|
|
|
|
|
5 (25−81%) |
|
|||
R1 = R2 = R3 = H, Me; R4 = Et, t-Bu; Rf = CF3, C2F5
Показано, что соотношение продуктов реакции определяется порядком смешения реагентов и характером растворителя. Прибавление диамина к кетоэфиру и кислая среда благоприятствуют образованию имидазолидинов (кинетический контроль); выход диазепинона увеличивается с повышением температуры (термодинамический контроль) и основности среды. В неполярных растворителях повышается выход как имидазолидина, так и диазепинона [40].
При взаимодействии этилендиамина с этиловыми эфирами 4-кетокарбоновых кислот с участием обеих карбонильных групп различной активности реакция не останавливается на стадии образования имидазолидинов; продуктами ее являются 5-алкил-1,4-диазабицикло[3,3,0]октан-8-оны 7 [41]:
R |
O |
H |
|
O |
|
|
|
||||
NH2 |
|
N |
R |
N |
|
+ |
C6H6 |
N |
|
N |
|
NH2 |
O |
||||
OEt |
H |
R H |
|||
O |
|
OEt |
7 |
||
|
|
|
|||
|
|
|
|
R = Pr, Bu, i-Bu, C5H11, i-C5H11, C6H13, i-C6H13
Взаимодействие N,N'-диацилированных производных этилендиамина с алкиленирующими реагентами, такими как диметилацетали формальдегида, ацетальдегида и бензальдегида, триоксан, диацетилформаль, диацетоксидиметиловый и хлордиметиловый эфир в различных растворителях в присутствии эфирата трехфтористого бора приводит к функционализированным имидазолидинам 8 [42].
Избранные методы синтеза и модификации гетероциклов, том 1 |
215 |

H |
|
R2 + |
|
|
AcOH |
R1 N N |
R2 |
|
R1 N |
N |
X |
Y |
|
|
|||
BF Et O |
||||||||
|
H |
|
|
3 2 |
|
8 |
|
|
|
|
|
|
|
|
|
|
|
XCH2Y = MeOCH2OMe, (CH2O)3, AcOCH2OAc, ClCH2OAc;
R1 = PhCH2, PhSO2, p-MeC6H4CO, Ts;
R2 = PhCH2, PhSO2, p-MeC6H4CO, EtCO, Mes
Метиленирующими агентами могут являться также N,N-бис-(хлорметил)- амиды [43]. Установлено, что в реакциях N,N'-бис(хлорметил)ацетамида с N,N-ди- ацилированными производными этилендиамина и о-фенилендиамина в присутствии как основания (триэтиламина), так и кислоты (BF3) независимо от характера ацильного заместителя образуются N,N'-диацилированные имидазолидины 9,
10 [43].
H |
N R2 |
R1 N |
|
|
H |
|
|
Et3N, диоксан |
R1 |
N N R2 |
|
|
|
|
|
Cl |
O |
|
|
9 (34−80%) |
|
|
|
||
|
N |
NHMes |
|
|
Cl |
Me |
|
Mes |
|
|
|
NHMes |
|
|
|
|
|
N |
|
|
|
Et3N, диоксан |
|
N |
|
|
|
|
Mes |
10 (23%)
R1 = R2 = Ts, m-MeC6H4CH2, R2 = PhCH2
3. Конденсация аминов, аминоалкилгидразинов, гидразидов α-аминокислот
с карбонилсодержащими соединениями
Первичные амины по аналогии с аммиаком легко образуют циклические тримеры оснований Шиффа 11 с выходами, близкими к количественным, при взаимодействии с формальдегидом. Последний образуется in situ при термическом разложении параформа в инертном растворителе (толуол, гептан) [44–48]. Возможно использование и водного раствора формальдегида [48]:
216 |
Серия монографий InterBioScreen |
HCOH |
R |
N |
N |
R |
RNH2 |
|
|
||
|
|
N |
|
|
|
|
|
|
R
11
R = Ph, 2-MeC6H4, 3-MeC6H4, 2-MeOC6H4, 4-FC6H4, 3-ClC6H4,
4-BrC6H4, 4-CNC6H4, MeOCH2CH2, 3,4,5-(MeO)3C6H2
Конденсация солей сульфаминовой кислоты приводит к 1R-3,5-динитро-1,3,5- пергидротриазинам 12 с побочным образованием триаза(диаза)нитроалканов 13 и гексогена 14 [49]:
|
|
RNH2 |
|
|
R |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
NH2SO3M |
|
|
N |
|
|
|
Ac2O, HNO3 |
|
|||||
HCHO |
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
MO S N |
N SO M |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
3 |
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
|
NO2 |
|
||
R N ( |
|
N )n OAc |
|
|
N |
|
|
|
|
N |
|
||||
|
+ |
|
|
|
|
+ |
|
|
|
|
|
||||
|
N |
N |
O N N N |
|
|||||||||||
NO |
2 |
NO |
2 |
|
O N |
NO |
NO |
||||||||
|
|
|
2 |
|
|
|
|
2 |
2 |
|
|
2 |
|||
|
13 |
|
|
|
12 |
|
|
14 |
|
|
|||||
n = 1, 2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
R = Me, Et, Bu, CH2OH; M = Na, K
Ацилирование гексаметилентетрамина алифатическими ангидридами является удобным методом получения 1,3,5-триацилпергидро-1,3,5-триазинов 15 [50] с выходами до 63%.
|
|
|
O |
R |
|
N |
(RCO)2O |
|
N |
|
|
|
|
|
N |
|
N |
O N |
N O |
N |
|
100°C |
|
|
|
|
|
R |
R |
|
R = Me, Et, Pr |
|
15 |
|
|
|
|
||
Общим методом синтеза несимметричных 1,2,4-пергидротриазинов 16 является взамодействие аминоалкилгидразинов с алифатическими альдегидами и кетонами [51].
Избранные методы синтеза и модификации гетероциклов, том 1 |
217 |
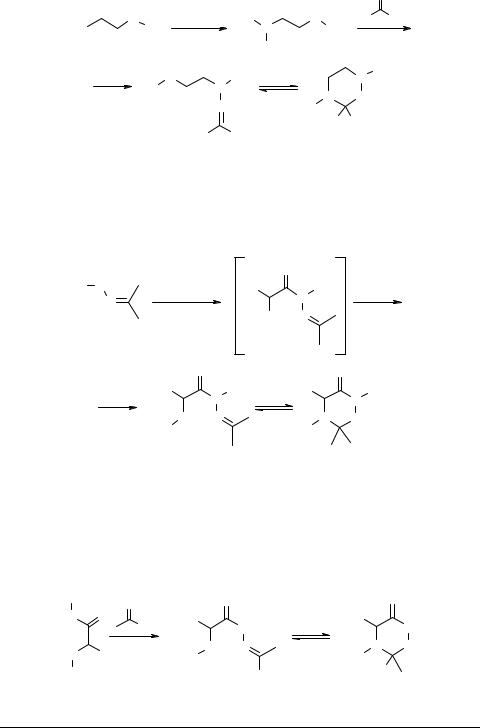
|
H |
|
|
|
|
H |
|
O |
|
|
R2NHNH2 |
|
|
R3 R4 |
|||||
Hal |
N |
R2 |
N |
N R1 |
|||||
R1 |
|
|
|
||||||
|
HBr |
H |
|
|
NH2 |
|
|
|
|
|
|
|
|
|
|
|
R2 |
||
|
|
R1 N |
N |
R2 |
|
R1 N |
N |
|
|
|
|
|
N |
|
|
NH |
|||
|
|
|
R4 |
R3 |
|
R3 |
R4 |
|
|
|
|
|
|
16 |
|
|
|||
R, R1, R2, R3 = H, Me, Et
Авторами [52, 53] предложен метод построения 1,2,4-гексагидротриазинового цикла на основе 1-алкил-1-(2-аминоацил)гидразонов по схеме:
H |
RCHBrCOBr R1 |
O |
|
|
||
R N |
N |
R2 |
R2NH2 |
|||
|
N |
|
|
|
|
|
|
|
Br |
N |
|
|
|
|
|
|
|
|
||
|
|
O |
|
|
|
O |
|
R1 |
|
N R2 |
R1 |
|
N R2 |
|
R3 |
NH |
N |
R3 N |
NH |
|
|
|
17a |
|
|
|
17b |
Выход изопропилиденовых производных 17a, b составил 30–50% в расчете на исходный алкилгидразон.
Гексагидро-1,2,4-триазин-6-оны 18 могут быть получены взаимодействием соответствующих гидразидов α-аминокислот с алифатическими альдегидами и кетонами [54].
NH2 |
O |
|
O |
|
O |
HN |
O |
R1 |
NH |
R1 |
NH |
|
R3 |
|
|
||
HN |
R1 |
R2 |
NH N |
R2 |
N NH |
R2 |
|
|
R3 |
|
R3 |
|
|
|
|
|
18 |
218 |
Серия монографий InterBioScreen |
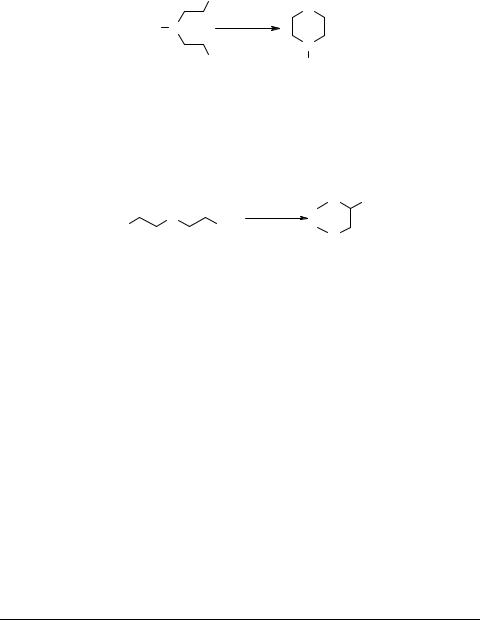
4. Гетероциклизация диаминов и β-аминоспиртов
В результате циклодегидратации или аминирования аминоспиртов, алкандиолов, 1,2-дигалогеноалканов могут быть получены соединения пиперазинового ряда [55]. Наибольшее число работ в этой области посвящено каталитической межмолекулярной циклизации моно- и диэтаноламинов [56–58].
OH |
H |
|
N |
|
NH3 |
R N
H2, cat. N
OH R
19
R = H, CnH2n+1, n = 1−14
С-замещенные пиперазины 20 могут быть получены парофазным методом из соответствующих оксиэтилендиаминов с выходами до 80% [61]. Так, из N-(β-oкси- пропил)-этилендиамина получен 2-метилпиперазин с выходами до 80% [59–61]:
|
R |
|
|
|
|
H |
R |
|
|
H |
|
Ni/Ra |
|
N |
|||
|
|
|
|
|
|
|
||
HO |
|
|
N |
NH2 |
200−300°C |
|
N |
|
|
|
|
|
|||||
|
|
|
|
|
||||
|
|
|
|
|
|
|
H |
|
|
|
|
R = H, Me, Ph |
|
20 |
|
||
|
|
|
|
|
|
|
||
При нагревании 5-амино-2,2,5-триметил-3-азагексанола-1 до 200°С в присутствии никелевого катализатора образуется 2,2,5,5-тетраметилпиперазин с выходом 68% [59]. Модификация этого метода с использованием метанола в качестве растворителя позволяет получить 1,2,2,2,5,5-гексаметилпиперазин с выходом 42% [60]. N,N'-Дизамещенные пиперазины могут быть получены обработкой свободного основания избытком соответствующего алкилирющего агента [61]. Для получения монопроизводных используют ацильную защиту одной аминогруппы с последующим ее элиминированием после введения требуемого радикала [62].
5. Синтезы на основе карбамидов
При взаимодействии мочевин с бифункциональными амино- и оксосоединениями, а также при внутримолекулярной циклизации замещенных мочевин образуются производные имидазолидина, называемые циклическими мочевинами [7].
Так, при конденсации карбамида с этилендиамином имидазолидин-2-он образуется с выходом до 98% [7, 63–65]. Замещенные имидазолидин-2-оны получают взаимодействием алкилированных 1,2-диаминов с мочевиной [63, 66, 68]. Выходы достигают 80%:
Избранные методы синтеза и модификации гетероциклов, том 1 |
219 |

|
H |
|
O |
|
O |
|||||
|
|
− |
|
|
||||||
R1 N |
N |
R + |
200 260°С |
|
|
|||||
|
|
|
R N |
|
N R1 |
|||||
|
|
|
|
|||||||
H |
|
H2N |
|
|
|
NH2 |
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
21 |
|
|||
R = H, Me; R1 = Me, CnH2n+1NH(CH2)2, n = 10−16
При использовании диаминов, содержащих аминогруппы, связанные с гетерокольцом, удается получить конденсированные бициклические имидазолидин-2- оны 22, но синтез подобных систем представлен единичным примером [69]:
|
H |
|
|
|
|
|
N |
O |
|
∆ |
N |
N |
|
+ H N NH |
2 |
N |
O |
|
NH2 |
2 |
|
N |
|
|
|
|
|
H |
|
|
|
|
|
|
22 |
Взаимодействие этиленгликоля с мочевиной в жестких условиях приводит к имидазолидин-2-ону 23 (47%) [70]. По оптимизации этого процесса имеются патентные данные [71–73].
|
|
|
O |
|
275°С |
|
O |
|||||
|
OH |
+ |
|
|
|
|
|
|
||||
HO |
|
|
|
|
|
HN NH |
||||||
|
|
|
|
400 атм |
||||||||
|
|
|
|
|
||||||||
|
|
H2N |
|
|
|
NH2 |
|
|
|
|
|
|
|
|
|
|
|
23 |
|
||||||
|
|
|
|
|
|
|
|
|
||||
Замещенные имидазолидин-2-оны 24 могут быть получены при взаимодействии мочевин с диальдегидами и дикетонами [74–78]:
|
|
|
|
|
|
|
|
|
O |
|||
O |
+ |
|
O |
|
|
H+ или HO− R N |
|
|
|
N R |
||
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
HN |
|
|
|
NH |
HO |
|
|
|
OH |
||
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|||
R |
|
|
|
R |
24 |
|||||||
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|||
Синтез несимметрично замещенных имидазолидин-2-онов в литературе представлен единичными публикациями, в которых рассматриваются реакции внутримолекулярной циклизации замещенных мочевин, например циклизация аллилмочевин, инициируемая N-бромсукцинимидом [7] или карбонилирование аллилмочевин [7].
Синтез соединений пергидротриазинового ряда с участием мочевин ограничен единичными примерами получения пергидро-1,3,5-триазин-2-онов 25 при кипячении смеси замеченной мочевины, формальдегида и глицилглицина в ДМФА [79].
220 |
Серия монографий InterBioScreen |
