
Карцев В.Г. - Избранные методы синтеза и модификации гетероциклов. Том 1 (2003)(ru)
.pdf
Другого типа реакция была применена в работе [18]. При исследовании взаимодействия N-ацетилиндоксила с 2-фенил-4-этоксиметилен-оксазолидоном-5 51 было установлено, что основным продуктом этой конденсации является 2-оксо- 3-бензоиламино-5-ацетилпирано[3,2-b]индол 52:
O |
|
O |
|
|
O |
O |
+ EtO |
|
|
|
|
||
N |
O |
|
|
|
|
|
N |
|
N |
|
|
NH |
|
|
Ph |
|
|
|||
Ac |
|
Ac |
|
O |
Ph |
|
1 |
51 |
|
|
52 |
||
|
|
|
|
Аналогичная циклизация была использована в двухстадийном синтезе δ-кар- болинов 53 [19]:
O |
|
O |
OEt |
|
OEt |
||
|
|
|
|
N |
Yb(fod)3 |
N |
|
100°C |
|
||
Ac |
Ac |
|
|
R |
|
||
|
|
||
40 |
|
R |
|
|
|
||
|
|
N |
|
|
NH2OH HCl |
N |
|
|
MeCN, 82°C |
|
|
|
Ac |
|
|
|
|
|
R
53
Вообще, синтез производных карболинов занимает заметное место в химии, связанной с гетероциклизацией производных индоксила [3]. В этом плане особенный интерес вызывает путь, связанный с превращением индоксила в 3-ариламино- индолы 54 [3, 20]. Установлено [21], что 3-п-нитрофениламино-2-формилиндол 55 гладко реагирует с соединениями, имеющими активную метиленовую группу с образованием соответствующих 2-винилпроизводных 56, которые являются удобными синтонами для получения δ-карболинов 57–60:
O |
NHC6H4NO2-p |
NHC6H4NO2-p |
|
|
|
|
O |
N |
N |
N |
H |
Ac |
Ac |
H |
|
|
|
||
1 |
54 |
55 |
|
Избранные методы синтеза и модификации гетероциклов, том 1 |
101 |
|
NHC |
H |
NO |
-p |
|
C6H4NO2-p |
|||||
|
|
6 |
4 |
2 |
|
|
N |
|
NH |
|
|
|
|
|
|
|
|
ДМФА/MeOH, t° |
|
|
|
||
55 |
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
CN |
для R = CN |
|
|
|
|
|
||
|
R |
N |
|
|
CN |
|
|||||
56 |
H |
|
|
|
H |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
этиленгликоль, t° |
|
57 |
|
|
|
|
|||||
|
|
C H NO -p |
|||||||||
для R = CO2Et |
|
C6H4NO2-p |
|
||||||||
|
|
|
|
|
|
|
6 |
4 |
2 |
|
|
|
|
|
|
|
|
|
|
|
|||
CF3CO2H |
|
|
|
|
|
N O |
|
N |
|
NH |
2 |
для |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
R = CONH2 |
|
|
|
|
|
|
N |
|
|
CN |
|
CO2Et |
|
|
|
N |
|
CN |
|
|
|
||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
H |
|
58 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C6H4NO2-p |
|
HO− |
C6H4NO2-p |
|
||||||
|
N |
NH2 |
|
N |
NH2 |
|
|
||||
|
+ |
|
|
|
|
|
|
|
|
|
|
N |
|
|
R |
− |
|
|
N |
R |
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
59 |
|
CF3COO |
|
|
60 |
|
|
|
|
||
В другой работе соединение 58 применили для синтеза большой группы δ-карболинов [22]. Взаимодействие 58 с хлорокисью фосфора приводит к образованию комплекса 61, который легко вступает в реакции с различными аминами. С вторичными аминами образуются 2-амино-1Н-δ-карболины 62, которые после метилирования и реакции с ацетоном превращают в производные 1,4-дигидро-δ- карболина 63.
|
C6H4NO2-p |
|
C6H4NO2-p |
||
|
N |
O POCl3 |
|
N |
OPOCl2 |
|
|
|
|
+ |
|
|
N |
CN |
N |
|
CN |
58 |
H |
|
H |
Cl |
|
|
|
|
|
||
|
C H |
NO |
-p |
|
|
C H |
NO |
-p |
||||||
|
|
6 |
4 |
2 |
|
|
|
|
6 |
4 |
2 |
|
|
|
|
N |
|
Cl |
|
|
|
N |
|
|
Cl R NH |
||||
|
+ |
|
|
|
|
|
+ |
|
|
|
2 |
|||
N |
− |
|
CN |
|
|
N |
|
|
|
|
CN |
|
|
|
H |
OPOCl |
|
61 |
H |
Cl |
|
|
|
|
|
||||
|
|
|
|
|
|
|||||||||
|
|
|
|
2 |
|
|
|
|
|
|
|
|||
102 |
Серия монографий InterBioScreen |

C |
H |
NO |
-p |
|
|
C H |
NO |
-p |
|
6 |
4 |
2 |
|
|
|
6 |
4 |
2 |
|
N |
|
NR2 |
MeI |
|
N |
|
N |
|
|
|
|
|
|
|
+ |
|
|
||
N |
|
CN |
|
|
|
N |
|
CN |
|
62 |
|
|
|
|
|
I |
|
|
|
|
|
|
|
C H NO -p |
|
|
|
||
K2CO3 , |
|
|
|
6 |
4 |
2 |
|
|
|
|
|
|
N |
|
|
|
|
|
|
ацетон |
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
||
∆ |
|
|
|
N |
|
CN |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
63 |
|
|
|
|
|
|
|
R2 = Me2, (CH2)5 O
В том случае, когда комплекс 61 реагирует с первичными ароматическими аминами, образуются 2-арилимино-5Н-δ-карболины 64, которые при нагревании при высокой температуре (выше 200°С) или при обработке сильным основанием (t-BuOK) претерпевают реакцию типа перегруппировки Чепмена с образованием производных 2-диариламино-δ-карболинов 65:
|
C6H4NO2-p |
C H NO -p |
|||||||||
|
N |
Cl |
|
|
6 |
4 |
2 |
|
|||
|
p-RC6H4NH2 |
N |
|
NC H R-p |
|||||||
|
+ |
|
|
|
|
|
|
6 4 |
|
||
N |
|
|
|
CN |
|
|
|
|
|
|
|
|
|
|
|
N |
|
CN |
|||||
H |
|
|
|
|
|
H |
|
|
|
|
|
Cl |
|
|
|
|
|
|
|||||
61 |
|
|
64 |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
||
NO2
∆ или t-BuOK |
N |
N |
|
|
|
|
|
|
N |
CN |
R |
|
H |
|
|
R = H, Cl |
65 |
|
|
|
|
|
В реакции Вильсмеера 3-ариламиноиндолы 54 трансформируются в производные индоло[3,2-b]хинолина 66. Интересно, что этой циклизации подвергаются промежуточные иммониевые соли 67, а не альдегиды 68 (это было показано специальными независимыми экспериментами [23]).
Избранные методы синтеза и модификации гетероциклов, том 1 |
103 |

H |
R |
H |
R |
N |
N |
||
|
POCl3 |
/ДМФА |
Cl |
|
|
|
|
N |
|
N |
+ |
|
N |
||
Ac |
|
Ac |
|
54 |
|
67 |
|
|
H |
H2O |
|
|
R |
|
|
|
N |
N |
|
|
|
|
|
|
CHO |
|
|
|
N |
N |
R |
|
Ac |
Ac |
66 |
|
68 |
|
|
В работе [24] изучены превращения индолохинолинов: N-алкилирование, восстановление 2-нитрогруппы и трансформация в 11-оксопроизводные 69:
N |
|
|
N |
|
N |
NO2 |
N |
|
NO2 |
H |
|
R |
|
|
|
|
|
|
|
N |
|
|
N |
|
N |
NH2 |
N |
|
NH |
H |
|
H |
|
|
|
|
|
|
O |
N+ I |
NaOH |
|
N |
|
|
ДМСО |
|
|
|
N |
NH |
N |
|
NH |
H |
|
H |
O |
|
|
O |
|
O |
|
|
|
69 |
||
|
|
|
|
Для получения оксосоединений, не содержащих в положении 5 метильную группу, которая ограничивает область синтетического использования индолохинолинов, была предпринята попытка выхода к такого типа системам через N-окись 70 и соответствующее 11-хлорпроизводное 71 [25]. В результате удалось получить ряд тризамещенных соединений 72–74 по приведенной ниже схеме.
104 |
Серия монографий InterBioScreen |
N
N
R
H
N
N
R O
N
N
72 R R N R1
N
N  74 R NH2
74 R NH2
|
|
|
|
O |
|
H2O2 /AcOH |
|
|
N |
|
|
NO2 |
|
70 |
N |
|
NO2 |
|
|
R |
|
|
|
|
|
|
|
|
|
POCl3 |
|
|
N |
|
|
|
|
|
|
||
NO2 |
71 |
N |
Cl |
NO2 |
|
|
|
R |
Py |
||
|
|
|
|
|
|
|
|
|
|
N |
|
NO |
2 |
|
N |
N+ |
NO2 |
|
|
R |
|
||
|
|
73 |
Cl |
||
|
R2NH |
|
|
|
|
|
|
|
|
CH2(CN)2, Et3N |
|
|
|
NC |
|
CN |
|
NO2 |
74 + |
|
|
− |
|
|
CN |
Et3N+H CN |
|||
|
|
|
|||
Дальнейшее исследование реакций N-ацетилиндоксила 1 с первичными аминами привело к интересным и неожиданным результатам [26]. Так, при взаимодействии 1 с эфиром антраниловой кислоты получен о-этоксикарбонилфенил- аминоиндол 75, который при нагревании в этиленгликоле превращается в 11-оксо- индолохинолин 76.
EtO2C
H
O N H
N
t°
|
N |
N |
N |
1 |
Ac |
Ac |
Ac O |
75 |
76 |
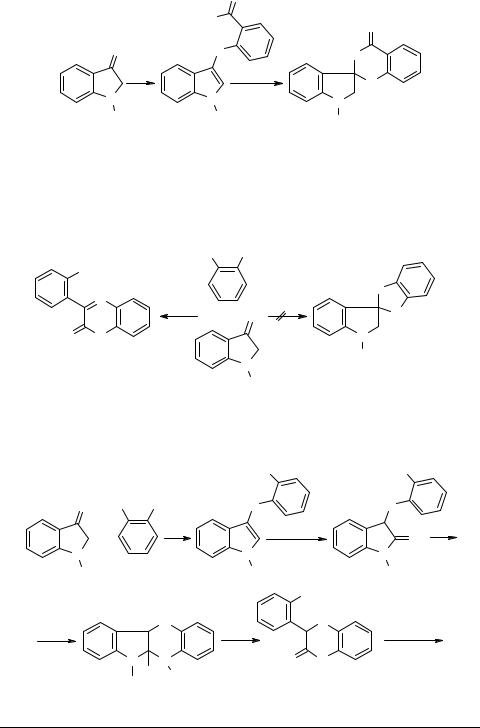
Реакция индоксила 1 с антраниламидом приводит к спирохиназолининдолину 77.
Избранные методы синтеза и модификации гетероциклов, том 1 |
105 |
|
O |
|
|
|
H2N |
|
O |
O |
H |
|
|
N |
HN |
|
|
|
|
|
|
|
|
|
N |
N |
N |
N |
H |
|
|||
Ac |
Ac |
Ac |
|
1 |
77 |
|
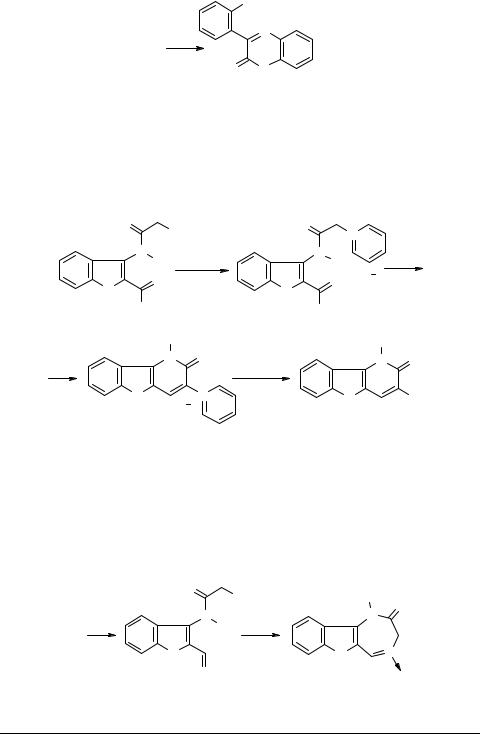
Взаимодействие соединения 1 c о-фенилендиамином рассмотрено в работе [27], в которой полученному соединению было приписано строение спиробензимидазолиндолина 78. Дальнейшее изучение этого продукта показало, что в действительности образуется другое соединение – 3-(о-ацетиламинофенил)хино- ксалинон-2 79.
NHAc |
H2N |
NH2 |
|
|
|
|
|
N |
|
|
HN |
+ |
|
N |
|
|
O |
||
O N |
|
|
H |
|
|
N |
|
H |
|
|
Ac |
|
|
N |
|
|
|
|
|
79 |
1 |
Ac |
78 |
|
Промежуточным продуктом реакции является индолохиноксалин 80, который трансформируется далее в бицикл 79 по следующей схеме [26]:
|
|
H2N |
|
H2N |
O H2N |
NH2 |
H |
|
H |
N |
|
N |
||
+ |
|
окисление |
O |
|
|
|
|
||
N |
|
N |
|
N |
1 Ac |
|
Ac |
NHAc |
Ac |
|
|
|
|
|
|
H |
|
H |
дегидри- |
|
N |
t° |
N |
|
|
|
|
рование |
|
N |
N |
|
O N |
|
80 Ac |
OH H |
|
H |
|
|
|
|
|
|
106 |
Серия монографий InterBioScreen |
NHAc
N
ON H
79
2-Формил-3(N-арил-N-хлорацетил)аминоиндолы 81, полученные из 2-формил- 3-ариламиноиндолов типа 55, гладко реагируют с пиридином с образованием сначала пиридиниевых солей 82, которые уже в процессе реакции претерпевают циклизацию в четвертичные соли 83 [28]. Обработка последних бензиламином приводит к 1-арил-3-амино-δ-карболинонам-2 84.
|
O |
Cl |
|
|
O |
+ |
|
|
|
|
|
|
N |
|
|
|
N Ar |
|
|
N Ar |
|
||
N |
|
O |
|
N |
O |
Cl |
|
|
|
|
|
|
|
||
H |
H |
|
|
H |
H |
|
|
81 |
|
|
82 |
|
|
||
|
|
|
|
|
|
||
|
|
Ar |
|
|
|
Ar |
|
|
|
N |
O |
|
|
N |
O |
|
|
|
+ |
|
|
|
|
|
N |
Cl |
N |
|
|
N |
NH2 |
|
H |
|
|
|
H |
|
|
|
83 |
|
|
|
|
84 |
|
Ar = Ph, p-ClC6H4
1.3 Замыкание семичленных циклов
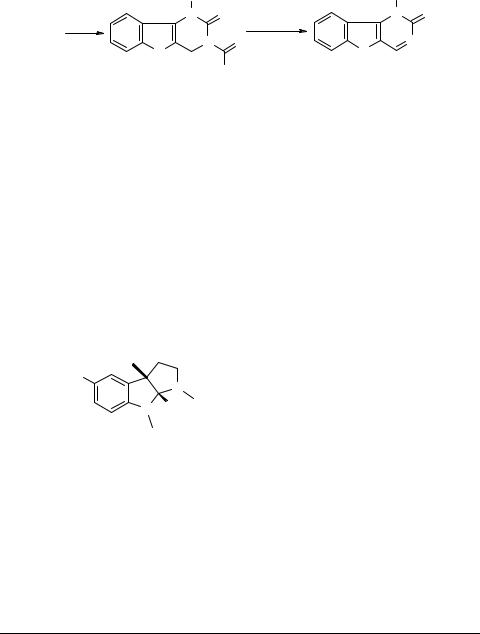
Реакция ациламиноиндолов 81 с гидрохлоридом гидроксиламина приводит к оксимам 85, которые далее циклизуются в N-окиси диазепино[6,5-b]индолы 86 [28].
|
O |
Cl |
|
Ar |
O |
|
|
|
|||
|
N |
|
|
N |
|
|
Ar |
|
|
||
81 |
|
|
|
||
|
|
|
|
|
|
N |
|
|
N |
|
N |
H |
NOH |
H |
|
O |
|
85 |
86 |
|
|||
|
|
|
|||
|
|
|
|
||
Избранные методы синтеза и модификации гетероциклов, том 1 |
107 |
Пример подобного превращения всего один за рассмотренный в обзоре период. При этом следует отметить, что N-окиси 86 оказались удобными исходными соединениями для синтеза пиримидо[5,4-b]индолов 87, 88. Не вдаваясь в подробности механизма этой необычной реакции, укажем, что она гладко протекает при обработке N-окисей 86 треххлористым фосфором [28].
|
|
Ar |
|
|
Ar |
PCl3 |
|
N |
O пиперидин |
|
N O |
86 |
|
N |
O |
|
N |
|
N |
N |
|||
|
|
|
|
||
|
H |
|
H |
H |
|
|
87 |
|
88 |
|
|
|
|
|
|
2. Синтезы на основе производных индолинона-2
2.1 Замыкание пятичленных циклов
Большинство новейших исследований, проводимых на основе производных оксиндола и направленных на синтез замещенных пирроло[2,3-b]индолов преследуют своей целью синтез биологически активных соединений. Здесь, прежде всего, выделяются работы по получению таких важных соединений, как физостигмин и его аналоги. Физостигмин – высокоактивный ингибитор холинэстеразы, использующийся для лечения глаукомы и в качестве антидота при отравлении фосфорорганическими соединениями. Имеются сведения, что физостигмин может оказывать лечебный эффект при болезни Альцгеймера [1, 2]. Эзеролин – главный метаболит физостигмина, обладает морфиноподобным анальгетическим действием.
R |
R = OCONHMe |
Физостигмин |
|
|
|
N |
R = OH |
(−)-Эзеролин |
N H |
R = H |
(−)-Дезоксиэзеролин |
|
Целью работы [29] является изыскание подхода к соединениям этого типа. В качестве исходного вещества был выбран 1-метоксикарбонил-3-фенил-тио- 3-метилоксиндол 89 (синтезированный в этой же работе в 5 стадий из фенилгидроксиламина). Десульфуризация этого соединения с помощью гидрида олова, последующее взаимодействие с нитроэтиленом в присутствии тетраметилпиперидида лития и восстановление β-нитроэтильного производного 90 приводит к производному пирролидона-2 91. Далее следует метилирование соединения 91, рециклизация полученного триметилпроизводного 92 и восстановление образовавшегося при этом 1,3-диметил-3-N-метиламиноэтилоксиндола 93. Таким образом осуществлен синтез рацемического дезоксиэзеролина 94:
108 |
Серия монографий InterBioScreen |

|
|
|
NO2 |
SPh |
|
|
H2 /Pd |
O |
O |
|
|
|
O |
||
N |
N |
|
N |
CO2Me |
CO2Me |
90 |
CO2Me |
89 |
|
|
|
|
O |
O |
|
|
NH MeI/NaH |
N |
конц. HCl |
NH |
|
N |
|
MeO2C |
MeO2C |
92 |
|
91 |
|
|
|
|
H |
|
|
|
N |
|
|
|
O |
|
N |
|
N |
H |
|
|
N |
||
|
93 |
94 |
|
Похожая схема синтеза использована в работе [30]. Здесь синтезированы не только пирроло-, но и фуро-[2,3-b]индолы. Как исходные реагенты, в данной работе применены 3-цианометил, этоксикарбонилметил и карбамидометил производные оксиндола:
X
|
|
при X = CN, Y = NH |
O |
витрид |
Y при X = CO2Et, Y = O |
|
||
N |
|
N H |
|
|
при X = CONHR, Y = NR |
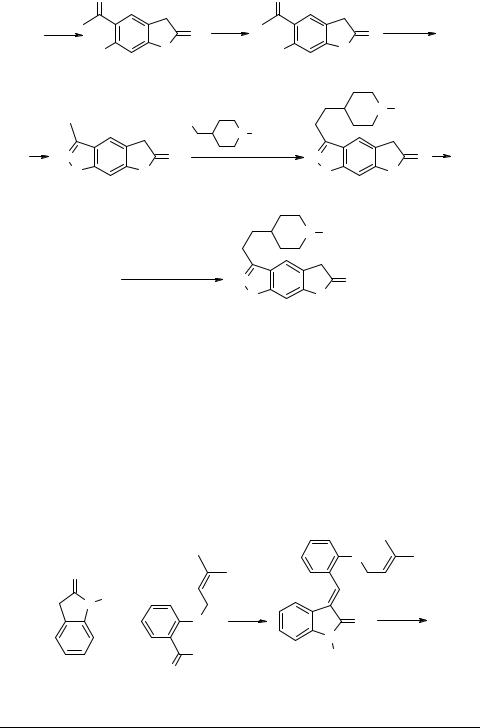
Среди исследований, направленных на синтез антихолинэстеразных препаратов, следует отметить поиск гетероциклов, фрагментом которых является оксиндольная бициклическая система. Ниже приведен синтез наиболее активного в этом отношении соединения 95 в ряду пирроло[3,2-f]бензизоксазолонов [31].
O
|
|
O |
AcCl |
|
|
NH2OH HCl |
|
|
AlCl3 |
|
|
O |
|
MeO |
N |
|
HO |
N |
AcONa |
|
|
|
|
||||
|
H |
|
|
|
H |
|
Избранные методы синтеза и модификации гетероциклов, том 1 |
109 |
NOH |
|
NOAc |
|
|
Py, |
|
Ac2O |
|
|
|
|
|
|
|
O |
ДМФА |
|
|
O |
|
|
130°C |
|
HO |
N |
HO |
N |
|
|
|
|
||||
|
H |
|
H |
|
|
|
|
|
|
|
N |
CO Bu -t |
|
|
|
I |
|
|
|
|
2 |
|
|
|
N CO2Bu -t |
|
|
|
|
|
|
|
|
|
|
|
|
NO |
N |
O |
Li-диизопропиламид |
NO |
N |
O |
|
|
H |
|
|
|
|
H |
|
|
|
|
|
|
N CH2Ph |
|
|
|
CF3CO2H |
|
N |
O |
|
|
|
|
PhCH2Br, Na2CO3 |
|
|
||||
|
O |
N |
|
|
|||
|
|
|
|
95 |
H |
|
|
|
|
|
|
|
|
|
|
2.2 Замыкание шестичленных циклов
При обсуждении проблем гетероциклизации производных индоксила и оксиндола весьма большое внимание уделяют диеновому синтезу. В работе [32], с использованием в качестве модели производного оксиндола 96, были изучены закономерности внутримолекулярной реакции Дильса–Альдера. Соединение 96 количественно превращается в пентациклические системы 97, 98 при нагревании в бензоле в запаянной трубке при 110°С.
O |
|
|
O |
|
|
|
|
N Ac |
Et3N |
|
бензол |
+ |
O |
|
O |
|
|
N |
110°C |
|
H |
Ac |
|
|
O |
96 |
|
110 |
Серия монографий InterBioScreen |
