
Карцев В.Г. - Избранные методы синтеза и модификации гетероциклов. Том 1 (2003)(ru)
.pdf
|
|
|
|
N N |
R1 |
|
|
|
|
|
|
|
|
|
N |
N |
R1 |
|
|
|
|
H |
|
|
|
|
|
|
|
|
NH2 |
R |
A |
|
|
|
N |
|
|
H |
|
|
+ 2 |
O |
|
R1 |
|
N |
|
N N |
|||
NH2 R1 |
|
|
|
||
R |
|
|
N |
N |
R1 |
22 |
|
|
|
|
|
|
R |
|
|
|
|
|
|
B |
|
|
|
|
|
|
|
|
R = H, Me, Cl;
R1 = Me, 4-MeC6H4, 4-ClC6H4, 4-BrC6H4, 4-NO2C6H4, 2-тиенил, 2-фурил
Неэквивалентность аминогрупп в исходном диамине обусловливает два возможных направления реакции, из которых реализуется только путь А.
Вопросы механизма конденсации рассмотрены в работах [49, 50, 52–54]. Теоретически возможны три основных пути формирования диазепинового цикла, отличающихся последовательностью стадий конденсации трех ее компонентов (реакции a–c):
|
|
R1 |
|
|
|
|
|
|
|
|
|
R |
|
R1 |
|
|
R |
R1 |
|
|
|
|
|
|
|
|
|
||
NH2 |
|
N |
|
|
|
|
N |
|
|
а + b |
+ |
O |
|
a |
|
|
|||
NH2 |
|
|
|
|
|
B |
|
||
|
NH2 |
|
R |
|
|
|
N |
|
|
+ |
|
А |
|
|
|
b |
R |
R1 |
|
R1 |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
R1 |
O |
|
NH2 |
|
R1 |
|
|
|
H |
R1 |
R |
c |
+ R |
|
|
c |
|
N |
R |
|
|
|
|
|
|
R1 |
|
R |
||
|
|
NH2 |
|
O |
R |
|
|
NH2 |
O |
|
|
|
|
C |
|
|
|
|
D |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H R |
|
|
|
|
|
|
|
|
|
N |
|
R1 |
|
|
|
|
|
|
|
|
|
R1 |
|
|
|
N |
R |
|
Избранные методы синтеза и модификации гетероциклов, том 1 |
151 |
Однозначные доказательства реализации того или иного пути реакции в литературе отсутствуют. Тем не менее, приведенные в [49, 50, 52–54] экспериментальные факты свидетельствуют о том, что реакции бинуклеофилов с метиленактивными кетонами, с одной стороны, и непредельными кетонами, с другой, имеют независимый характер. Т.е. гетероциклизация не сводится к самоконденсации двух молекул кетона в непредельное карбонильное соединение с последующей циклоконденсацией "обычным" путем (путь с не реализуется).
В заключении надо отметить, что реакции с двумя молями кетона, приводящие к дигидродиазепинам, характерны не только для 1,2-диаминов. Так, в литературе описано взаимодействие о-нитрофенилазида 23 с алифатическими и ароматическими кетонами в присутствии SmI2, позволяющее выделять дигидробензодиазепины с высокими выходами [55]:
|
|
|
H R |
N3 |
R |
SmI2 |
N |
+ |
2 |
O |
|
NO2 |
|
|
N |
23 |
|
|
R |
R= Et, Ph, 4-MeOC6H4, 3-NO2C6H4
4.Реакции дигидробензодиазепинов
Химические свойства продуктов циклоконденсации халконов с о-диаминами – аннелированных дигидродиазепиновых систем – в литературе освещены достаточно слабо. Наиболее полный, но отнюдь не исчерпывающий, анализ химических свойств 2,4-дифенил- и 2-метил-2,4-дифенилзамещенных 2,3-дигидро- 1Н-1,5-бензодиазепинов дан в работах [56, 57].
Окисление 2,3-дигидробензодиазепинов разнообразными реагентами (H2O2, SeO2, надкислоты и т.д.) обычно приводит к смолистым трудноидентифицируемым продуктам реакции. Однако, описано окисление N-бензоилпроизводных бензодиазепинов m-хлорпербензойной кислотой в присутствии бикарбоната натрия и межфазного катализатора – триэтилбензиламмонийхлорида (ТЭБАХ) [58]:
O |
|
O |
R |
|
R |
|
|||
N |
N |
|||
|
||||
|
|
|||
|
a |
|
||
|
|
|
||
N |
R1 |
N |
R1 |
|
|
|
O |
||
|
|
|
a - m-хлорпербензойная к-та, NaHCO3, ТЭБАХ, CH2Cl2;
R = Me, C6H5, 4-NO2C6H4;
R1 = Ph, 4-MeC6H4, 4-MeOC6H4
152 |
Серия монографий InterBioScreen |
Действие тех же реагентов на незамещенные по аминогруппе бензодиазепины приводит к образованию гидроксипроизводных или сопровождается дегидратированием:
|
|
|
O |
H |
|
|
H OH |
N |
O |
a |
N |
|
|
||
N |
|
|
N |
H |
Cl |
|
Cl |
|
|
N |
|
N |
|
a |
|
|
|
|
|
N |
|
|
N |
a - m-chloroperbenzoic acid, NaHCO3, ТЭБАХ, CH2Cl2
Получить с удовлетворительным выходом 3Н-1,5-бензодиазепин 25 удается также при использовании более мягкого окислителя – K2S2O5 [56].
При восстановлении 2,4-дифенил-2,3-дигидро-1Н-1,5-бензодиазепина 24 (R = H, Ar = Ph) боргидридом натрия образуется к эквимолекулярная смесь диастереомерных тетрагидропроизводных 26 [56]; напротив, восстановление 2-метил- 2,4-диарилзамещенных этого бицикла в аналогичных условиях приводит только к одному из возможных изомеров 26 (R = CH3), конфигурация которого, однако, не установлена [57].
|
|
|
Ar |
Ar |
|
|
|
Ar |
Ar |
||
|
|
R |
|
|
|
R |
|
|
|||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
N |
N |
K2S2O5 HN |
N |
NaBH4 |
HN |
NH |
|||||
|
|
R = H |
|
|
R = H, Me |
|
|
|
|
||
|
25 |
|
|
|
24 |
|
|
|
|
|
26 |
Ar = Ph, 4-MeC6H4, 4-MeC6H4, 4-ClC6H4, 4-BrC6H4 |
|
|
|
|
|||||||
Избранные методы синтеза и модификации гетероциклов, том 1 |
153 |

Из реакций, характеризующих замещенные дигидробензодиазепины 24 как циклические аминопроизводные, изучены их ацилирование и нитрозирование. Отметим различное направление этих реакций для 2,4-ди- и 2,2,4-тризамещенных: в первом случае во взаимодействии участвует NH-группа [56], во втором – азометиновый атом азота [50, 57].
Ac2O
R1 |
|
R1 |
|
R |
|
R = H |
|
HN |
N |
||
R1 = Ph |
|||
|
|
24 |
HNO2 |
|
|
|
|
Ac2O |
R1 |
|
R1 |
R1 = Me, Ph |
|
|
||
R |
|
|
|
HN |
|
N R = Me |
|
|
24 |
|
HNO2 |
|
|
|
R1 = Ph
R1
R
N
O
R1
R 
ONN
R1
R
HN
R1
R 
HN
R1
N
R1
N
R1
N
O
R1
NNO
В работе [59] достаточно подробно была исследована реакция N-ароилиро- вания 2,3-дигидробензодиазепинов ароилхлоридами в присутствии K2CO3.
R
O
Cl K2CO3
HN N +
R1
R2
154 |
Серия монографий InterBioScreen |
R1
|
|
|
R |
|
|
|
|
O |
R2 |
|
|
|
|
|
R1 |
|
|
+ |
NH |
N |
N |
NH |
||
R2 |
|
|
|
|
O |
|
O |
R2 |
|
|
|
|
|
|
|
27 |
|
|
R1 |
|
|
|
28 |
R = H, Br, Cl, Me, MeO;
R1 = H, Me, Cl; R2 = H, NO2
Было показано, что введение как донорных, так и акцепторных заместителей в 2-фенильный радикал препятствует протеканию реакции. Наряду с целевыми продуктами ароилирования 27 были выделены N,N'-диароил-1,2-фенилендиамины 28.
Ряд публикаций посвящен модификации 2,3-дигидродиазепинов по C=N связи. Окисление, затрагивающее азометиновую связь с образованием эпоксида [58], уже упоминалось выше.
В работе [60] описано взаимодействие 2,2,4-триметил-2,3-дигидробензоди- азепина с 2-(фенилиминоокси)-1-фенилэтаноном 29. Реакцию проводят в бензоле при комнатной температуре. При этом затрагивается помимо С=N связи и 4-метильная группа (соединение 30):
|
O |
O |
HN |
|
N |
NH |
N+ |
||
|
||||
|
+ |
|
O |
N NH
OH
29 |
30 |
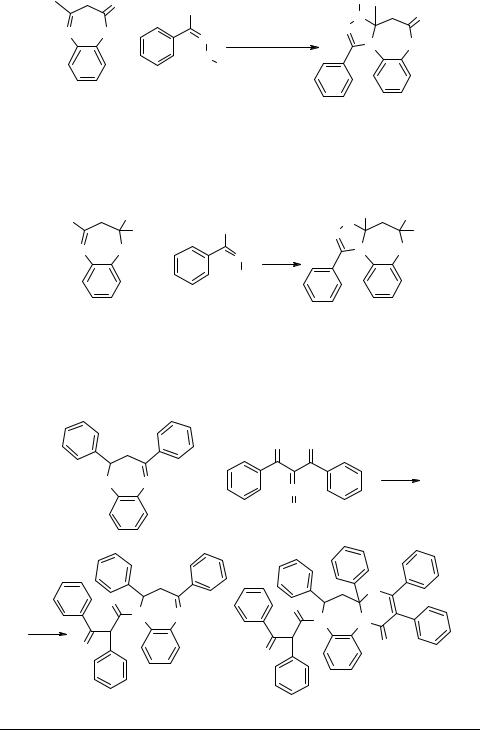
Известно также 1,3-диполярное циклоприсоединение ряда нитрилиминов, генерируемых из 31, протекающее с хорошими выходами при нагревании исходных реагентов в тетрагидрофуране в присутствии триэтиламина [61]:
Избранные методы синтеза и модификации гетероциклов, том 1 |
155 |
|
Y |
Cl |
|
R |
Y |
|
|
|
|
N N |
|||
|
|
|
|
|||
N |
NH |
N |
ТГФ, Et3N, ∆ |
|
||
N |
NH |
|||||
|
+ |
HN R |
|
|||
|
|
|
|
|
||
|
31 |
|
|
|
|
|
|
R = Ph, CO2Et; |
|
|
|
||
|
Y = 2Me, O |
|
|
|
|
|
Авторы другой работы исследовали сходное 1,3-диполярное циклоприсоединение с участием бензонитрилоксида 32 [62]. Реакция протекает в мягких условиях при комнатной температуре в метиленхлориде:
R2 |
R1 |
Cl |
|
N O |
R2 |
R1 |
R |
|
|
R |
|||
|
|
|
||||
N |
NH |
+ |
N |
|
N |
NH |
|
|
|
|
|
||
|
|
OH |
|
|
|
|
|
|
|
|
|
|
32
R = H, Me, Ph; R1 = H, Me, Ph; R2 = Me, Ph
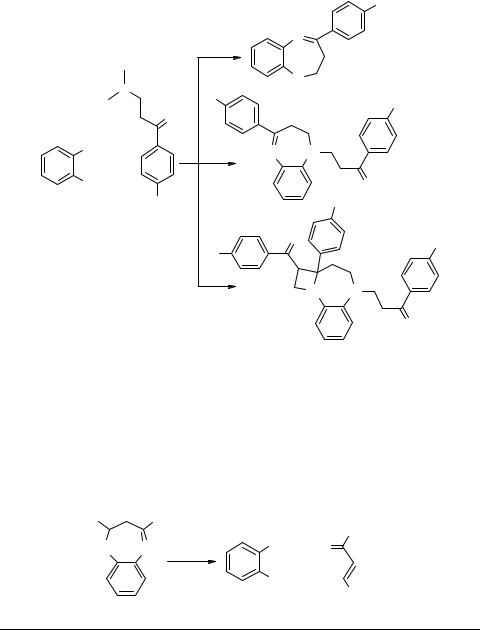
Интересные результаты получены при взаимодействии 2,3-дигидродиазе- пинов с 2-диазо-1,3-дифенилпропан-1,3-дионом 33. Реакция затрагивает как вторичную аминогруппу, так и азометиновую связь, что приводит к образованию соединений 34 и 35 [63]:
|
|
|
|
O |
O |
|
HN |
N |
|
+ |
N |
+ |
|
|
|
|
|
− |
|
|
|
|
|
|
N |
|
|
|
|
|
|
33 |
|
|
O |
|
|
|
O |
|
O |
N |
N |
|
|
|
||
|
|
|
|
|||
|
|
+ |
N |
N |
||
O |
|
|
|
O |
|
O |
|
|
|
|
|
|
|
|
34 |
|
|
|
|
35 |
156 |
Серия монографий InterBioScreen |
Похожие реакции описаны в работе [64], посвященной взаимодействию 1,2- фенилендиамина с основаниями Манниха. Авторы показали, что при соотношении исходных компонентов 1 : 1 образуются 2,3-дигидробензодиазепины 36. Введение в реакцию второго моля основания Манниха позволяет выделить N-замещенные производные бензодиазепинов 37. При мольном соотношении диамина и кетона 1 : 3 реакция затрагивает и азометиновую связь 38:
|
|
|
|
|
R |
|
|
n = 1 |
|
N |
|
|
|
|
|
|
|
|
|
|
|
N |
36 |
|
HCl |
|
|
|
|
N |
R |
|
H |
|
|
|
|
R |
|||
|
|
|
|
||
|
O |
|
|
|
|
|
|
|
|
|
|
NH2 |
|
n = 2 |
N |
N |
|
+ n |
|
|
|
|
O 37 |
NH |
|
|
|
|
|
2 |
R |
|
|
|
R |
|
|
|
|
||
|
|
R |
|
O |
R |
|
|
|
|
||
|
|
|
|
|
|
|
|
n = 3 |
|
N |
N |
|
|
|
|
||
R = H, MeO, Cl, Br, NO2 |
|
|
|
O |
|
|
|
|
38 |
||
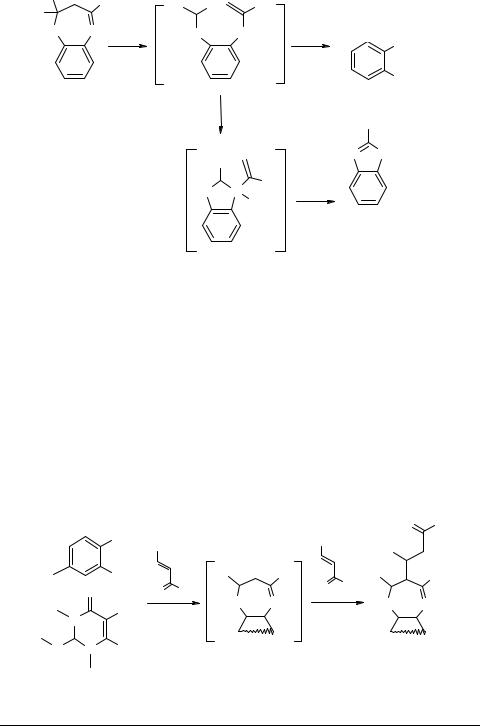
Имеются сообщения о неудачных попытках алкилирования (MeJ, Me2SO4), галогенирования (трет-бутилгипохлорид) и нитрования производных дигидробензодиазепина [7, 56], приводящих обычно лишь к деструкции семичленного гетероцикла. Деструктивные процессы вообще весьма характерны для дигидродиазепиновых систем и часто проявляются как при синтезе, так и при исследовании свойств этих соединений. При этом наиболее распространены два направления разрушения семичленного гетероцикла: распад на о-диамин и карбонильное соединение (реакции а и b) [56, 57] и бензимидазольная перегруппировка с отщеплением молекулы метиларилкетона (реакция c) [65]:
Ar |
Ar' |
|
Ar' |
|
N H2O, H+ |
NH2 |
|
HN |
O |
||
|
20°C |
+ |
а |
|
NH2 |
|
|
|
|
Ar |
|
|
|
|
Избранные методы синтеза и модификации гетероциклов, том 1 |
157 |
Ar |
Ar' |
Ar + R |
Ar' |
|
2ArCOMe |
|
R |
|
|||||
|
|
|||||
HN |
N H+ |
HN |
NH |
|
H2O |
+ |
|
|
|
|
|
|
NH2 |
|
|
|
|
|
R = Me |
b |
|
|
|
|
|
Ar = Ar' |
NH2 |
|
|
|
|
|
|
|
|
|
|
R = H |
|
|
Ar |
|
|
|
|
|
|
|
|
|
Ar |
|
|
|
N NH |
|
|
|
|
|
39 |
|
|
|
|
+ |
Ar' |
H2O, /O/ |
|
|
|
HN |
|
|||
|
|
N |
|
c |
||
|
|
|
H |
|
|
|
+
Ar'COMe
Аналогично представленному выше кислотно-катализируемому превращению в бензимидазолы 39 протекают термические перегруппировки дигидробензодиазепинов и процессы их фрагментации под действием электронного удара (через соответствующие радикальные и ион-радикальные интермедиаты) [65]. На способность перегруппировываться в имидазолы существенным образом влияют как заместители в дигидроцикле, так и характер аннелированого ядра. При этом некоторые гетероаннелированные ди- и триазепиновые системы часто оказываются достаточно устойчивыми, что позволяет осуществлять их синтез в присутствии кислот и/или при высоких температурах.
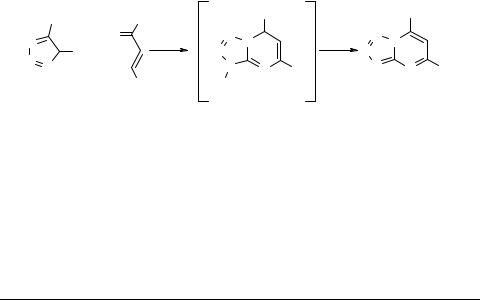
СН-Кислотныесвойстваметиленовогозвенадигидробензодиазепинов иллюстрируют данные работ [66, 67], посвященных реакциям халконов с 4-нитро-1,2- фенилендиамином и 4,5-диамино-1,3-диметил-2-метокси-1,6-дигидропиримидо- ном-6. В этих случаях образующиеся первоначально дигидродиазепины взаимодействуют со второй молекулой кетона, превращаясь, в конечном итоге, в аддукты 40.
|
NH2 |
|
|
|
|
O |
Ar' |
|
Ar |
|
|
Ar |
Ar |
|
|
|
|
|
|
|
|
||
O2N |
NH2 |
|
Ar |
Ar' |
O Ar' |
Ar |
Ar' |
O |
|
O |
Ar' |
|
|
|
|
|
N |
|
HN |
N |
|||
N |
NH2 |
|
HN |
|
|||
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
O N |
NH2 |
|
|
|
|
40 |
|
Ar, Ar' = Ph, 4-MeC6H4, 4-MeOC6H4, 4-ClC6H4, 4-BrC6H4
158 |
Серия монографий InterBioScreen |
Иные реакции активной метиленовой группы, весьма характерные, например, для 3-Н-1,5-бензодиазепинов [68], для аннелированных дигидро-1,5-диазепинов, в литературе не описаны.
5. Пяти- и шестичленные гетероциклы на основе о-диаминов и непредельных кетонов
Как уже отмечалось, реакции α,β-непредельных кетонов с о-диаминами часто сопровождаются различными перегруппировочными и побочными процессами. Так, при осуществлении конденсации ФДА с халконом в присутствии кислотного катализатора, либо при перегревании реакционной смеси, конечным продуктом реакции оказывается 2-фенилбензимидазол [2, 7]; аналогичное явление наблюдается и для 2,3-диаминопиридина [23]. Учитывая наличие значительно более удобных синтетических подходов к 2-арилзамещенным бензимидазолам и их гетероаннелированным аналогам (например, исходя из диаминов и кислот, либо альдегидов [69]), это направление взаимодействия халконов с диаминами вряд ли может иметь самостоятельное синтетическое применение.
Более интересными как с практической, так и с теоретической точки зрения нам представляются реакции халконов с некоторыми о-диаминами, содержащими "гидразинную" аминогруппу (1,2-диаминобензимидазол, 3,4-ди- и 1,2,4-триамино- триазолы) [70, 71, 72]. В работе [72] впервые показана возможность образования в этих реакциях не триазепиновых систем, а замещенных азолопиримидинов 41; в этом случае. Процесс циклоконденсации протекает с отщеплением не только молекулы воды, но и аммиака. Предлагаемый механизм такого направления циклоконденсации [70] включает формирование дигидроазолопиримидиновой системы с последующей ее ароматизацией путем элиминирования аминогруппы:
|
NH2 |
Ar' |
|
|
Ar |
|
|
Ar |
|
|
|
|
|
|
|
||
N |
NH2 |
O |
|
X |
N |
|
X |
N |
X |
+ |
−H2O |
Y |
|
−NH3 |
Y |
|
|
Y |
|
N |
N Ar' |
N |
N Ar' |
|||
|
Ar |
|
|
|||||
|
|
|
H2N |
|
|
|
41 |
X, Y = C(R), N; X+Y = o-C6H4;
Ar = Ph, 4-MeOC6H4, 4-NO2C6H4;
Ar' = Ph, 4-MeC6H4, 4-MeOC6H4, 4-ClC6H4, 4-NO2C6H4
Интересно отметить, что аналогичная реакция, косвенно подтверждающая приведенный выше механизм, найдена для 1,2-диамино-4-фенилимидазола [73]; отличием является то, что в циклоконденсации участвует не атом азота, а π-избыточный углеродный реакционный центр и последующая гетероароматизация дигидропроизводного 42 в имидазопиридазин 43 не требует элиминирования аминогруппы:
Избранные методы синтеза и модификации гетероциклов, том 1 |
159 |
|
|
|
Ph |
|
Ph |
|
|
Ph |
|
Ar' |
N |
|
N |
|
|
O |
Ar |
|
NH2 |
Ar |
NH2 |
||
N |
N |
||||||
|
N |
||||||
N NH2+ |
|
−H2O |
N |
−2H |
N |
|
|
NH2 |
|
Ar |
Ar' |
|
Ar' |
|
|
|
|
|
42 |
|
43 |
|
Ar = Ph, 4-MeOC6H4, 4-BrC6H4, 4-MeC6H4, 3,4-MeOC6H3, 4-FC6H4
Ar' = Ph, 4-MeC6H4, 4-NO2C6H4, 4-BrC6H4, 2-OHC6H4
В процессе циклоконденсации со второй аминогруппой диамина может конкурировать не только орто-, но и ипсо-атом гетероцикла. Такой, на наш взгляд, весьма нетривиальный результат получен при исследовании взаимодействия халконов и циклических непредельных кетонов с 5,6-диамино-1,3-диметилураци- лом [29, 30]. При этом были опровергнуты данные [26] о оксазепиновом 44 строении продуктов этой реакции; образование в ней спиросистем 45 и 46 однозначно доказано с помощью РСА и спектральных методов:
O |
|
|
O |
|
R1 |
|
|
|
NH2 |
|
N |
|
|
||
N |
|
|
|
|
|||
|
N |
|
|
|
|||
|
|
|
|
44 |
|
||
|
|
|
|
|
|
||
O N |
NH2 |
|
|
|
|
|
|
O |
N |
O |
R |
|
|
||
|
MeOH, AcOH |
|
|
||||
+ |
|
|
R |
|
|
||
|
|
|
|
|
|||
∆ |
|
O |
|
|
O |
||
O |
|
|
|
|
|||
|
|
|
R1 |
N |
O |
||
|
|
|
N |
N |
|||
R1 |
R |
|
+ |
|
|||
|
|
|
|
||||
|
|
O |
N |
|
O |
|
N O |
45
R = Ph, 4-MeOC6H4, 4-MeC6H4, 4-BrC6H4, 4-NO2C6H4, 2-NO2C6H4 R1 = Me, Ph, 4-MeOC6H4, 4-MeC6H4, 4-BrC6H4, 4-NO2C6H4,
PhCH=CH, 4-MeOC6H4CH=CH
O |
Ph |
|
|
|
O Ph |
|
N |
NH2 |
O |
MeOH, AcOH |
N |
N |
R |
+ |
|
|||||
O N |
|
∆ |
|
|||
NH2 |
R |
O N O |
|
|||
|
|
|||||
|
R = H, PhCH= |
|
|
|
46 |
|
|
|
|
|
|
|
|
160 |
Серия монографий InterBioScreen |
