
Карцев В.Г. - Избранные методы синтеза и модификации гетероциклов. Том 1 (2003)(ru)
.pdf
24.Кузнецов В.В., Простаков Н.С., ХГС 1990 (1) 5.
25.Gaetano Z., Trends Heterocycl. Chem. 1991 2 85.
26.Grigg R., Sridharan V., Adv. Cycloaddit. 1993 3 161.
27.Georg G.I., Ravikumar V.T., in Organic Chemisrty of β-Lactams, Georg G.I., Ed., New York: VCH, 1993, p. 295.
28.Маслова М.М., Марченко Н.Б., Глушков Р.Г., Хим.-фарм. журн. 1993 27
(4)41.
29.Кузнецов В.В., Простаков Н.С., ХГС 1994 (1) 3.
30.Borrilleri R.M., Weinreb S.M., Synthesis 1995 (4) 347.
31.Kobayashi S., Ishitani H., Chem. Rev. 1999 99 (5) 1069.
32.Михайловский А.Г., ХГС 2000 (5) 579.
33.Pyridine and its Derivatives, Klingsberg E., Ed., New York: Intersсience publishers, Inc., 1960, pt. 1, p. 613.
34.Общая органическая химия, под ред. Бартона Д., Оллиса У.Д., т. 8; Азотсодержащие гетероциклы, под ред. Сэммса П.Г., М.: Химия, 1985, с. 752.
35.Tietre L.F., Chem. Rev. 1996 96 (1) 115.
36.Parsons Ph.J., Penkett C.S., Shell A.J., Chem. Rev. 1996 96 (1) 195.
37.Михальчук А.Л., Гулякевич О.В., Изв. АН, Сер. хим. 1996 (9) 2353.
38.Openshaw H.T., Whittaker N., J. Chem. Soc. 1961 (11) 4939.
39.Kóbor J., Sohár P., Szegedi Tanárképzö Föisk. Tud. Közl. 1972 125.
40.Kobor J., Sohar P., Fulop F., Tetrahedron 1994 50 (16) 4873.
41.Тютин В.Ю., Чкаников Н.Д., Шкляев В.С. и др., Изв АН, Сер. хим. 1992
(8)1888.
42.Агбалян С.Г., Ханамирян Ж.А., Ншанян А.О., Арм. хим. журн. 1968 21 (5) 422.
43.Агбалян С.Г., Нерсесян Л.А., Ханамирян Ж.А., Арм. хим. журн. 1967 20 (1) 45.
44.Askan V., Deeks R.H.L., Brit. Patent 1 267 170; Chem. Abstr. 1972 77 P53742.
45.Kametani T., Terasawa H., Ihara M., Fukumoto K., Heterocycles 1977 6 (1) 37.
46.Kametani T., Jpn. Kokai. Tokkyo Koho 79 32 499; Chem. Abstr. 1979 91 157617h.
47.Kametani T., Jpn. Kokai. Tokkyo Koho 79 103 897; Chem. Abstr. 1980 92 129165m.
48.Kametani T., Suzuki Y., Ihara M., Can. J. Chem. 1979 57 (13) 1679.
49.Kametani T., Suzuki Y., Terasawa H., Ihara M., J. Chem. Soc. Perkin Trans. 1 1979 5 1211.
50.Bhattacharjya A., Bhattachrjya P., Pakrashi S., Heterocycles 1983 20 (12) 2397.
51.Kobor J., Lázár J., Fülöp F., Bernáth G., J. Heterocycl. Chem. 1994 31 (4) 825.
52.Kobor J., Fülöp F., Bernath G., Heterocycles 1986 24 (11) 2227.
53.Blashkó G., Honty K., Novák L., Szántay Cs., Acta Chim. Acad. Sci. Hung. 1979 99
(1)35.
54.Михальчук А.Л., Гулякевич О.В., Ахрем А.А., ХГС 1996 (2) 235.
55.Михальчук А.Л., Гулякевич О.В., Ахрем А.А., ЖОрХ 1997 33 (4) 639.
56.Михальчук А.Л., Гулякевич О.В., в кн. Азотистые гетероциклы и алкалоиды,
под ред. Карцева В.Г., Толстикова Г.А., М.: Иридиум-Пресс, 2001, т. 2, с. 425.
57.Михальчук А.Л., Гулякевич О.В., в кн. Азотистые гетероциклы и алкалоиды,
под ред. Карцева В.Г., Толстикова Г.А., М.: Иридиум-Пресс, 2001, т. 2, с. 208.
58.Гулякевич О.В., Михальчук А.Л., ДАН 1996 350 (6) 781.
Избранные методы синтеза и модификации гетероциклов, том 1 |
41 |

59.Михальчук А.Л., Гулякевич О.В., ХГС 1996 (4) 561.
60.Kametani T., Terasawa H., Ihara M., J. Chem. Soc. Perkin Trans. 1 1976 23 2547.
61.Chapman D.D., Elwood J.K., Heseltine D.W., et al., J. Chem. Soc. Chem. Commun.
1974 16 647.
62.Chapman D.D., Res. Discl. 1974 128 35.
63.Загуляева О.А., Олейник И.В., ХГС 1995 (6) 816.
64.Катрицкий А.Р., Успехи химии 1972 41 (4) 700.
65.Chapman D.D., Elwood J.K., Heseltine D.W., et al., J. Org. Chem. 1977 42 (14) 2474.
66.Moeda Shigeo, Kurhashi Takeo, Yamaga Hiroyoshi, Jpn. Kokai. Tokkyo Koho 79 08,626; Chem. Abstr. 1979 90 205783p.
67.Liu Zhijie, Gong Yong, Chen Shuanhu, Cao Jujiu, Youji Huaxue 1987 (2) 137;
Chem. Abstr. 1987 107 236432w.
68.Шачкус А.А., Дегутис Ю.А., ХГС 1987 (4) 481.
69.Шачкус А.А., Дегутис Ю.А., ХГС 1990 (8) 1055.
70.Озолс Я., Виганте Б., Баумане Л. и др., ХГС 1998 (10) 1372.
71.Nair M.D., Indian J. Chem. 1968 6 (11) 630.
72.Строение и таутомерные правращения β-дикарбонильных соединений,
под ред. Гудриниеце Э.Ю., Рига: Зинатне, 1977, с. 448.
73.Rubinov D.B., Rubinova I.L., Akhrem A.A., Chem. Rev. 1999 99 (4) 1047.
74.Acetoacetates (Survey of Chemical Reactions, Specifications and Applications), Basel: LONZA, 1987, p. 77.
75.Kappe Th., Linnace Y., Monatsh. Chem. 1969 100 (5) 1726.
76.Востров Е.С., Масливец А.Н., в кн. Азотистые гетероциклы и алкалоиды,
под ред. Карцева В.Г., Толстикова Г.А., М.: Иридиум-Пресс, 2001, т. 2, с. 72.
77.Чуйгук В.А., Воловенко Ю.М., ХГС 1975 (4) 530.
78.Попов И.И., ХГС 1989 (12) 1695.
79.Михальчук А.Л., Гулякевич О.В., Ахрем А.А., Журн. прикл. хим. 1998 71
(4)645.
80.Гулякевич О.В., Михальчук А.Л., Ахрем А.А., Изв. АН, Сер. хим. 1997
(7)1358.
81.Гулякевич О.В., Михальчук А.Л., Ахрем А.А., Хим. прир. соед. 1997 (3) 432.
82.Гулякевич О.В., Михальчук А.Л., Пересада В.П. и др., ХГС 1997 (7) 972.
83.Михальчук А.Л., Гулякевич О.В., Пересада В.П. и др., ДАН 1997 356 (6) 769.
84.Михальчук А.Л., Гулякевич О.В., Ахрем А.А., ЖОрХ 1998 34 (4) 635.
85.Михальчук А.Л., Гулякевич О.В., Ахрем А.А., ЖОрХ 1997 67 (7) 1223.
86.Міхальчук А.Л., Гулякевіч В.У., Ахрэм А.А., Заяўка на Патэнт Рэспублікі Беларусь 409/97 Афіцыйны бюллетень Рэспублікі Беларусь (вынаходніцтвы, карыстныя мадэлі, прамысловыя узоры) 1999 1 (20) 35.
87.Міхальчук А.Л., Гулякевіч В.У., Ахрэм А.А., Заяўка на Патэнт Рэспублікі Беларусь 410/97 Афіцыйны бюллетень Рэспублікі Беларусь (вынаходніцтвы, карыстныя мадэлі, прамысловыя узоры) 1999 1 (20) 35.
88.Ахрем А.А., Гулякевич О.В., Михальчук А.Л., в кн. Азотистые гетероциклы и алкалоиды, под ред. Карцева В.Г., Толстикова Г.А., М.: Иридиум-Пресс, 2001, т. 2, с. 370.
42 |
Серия монографий InterBioScreen |

89.Ахрем А.А., Гулякевич О.В., Михальчук А.Л., в кн. Азотистые гетероциклы и алкалоиды, под ред. Карцева В.Г., Толстикова Г.А., М.: Иридиум-Пресс, 2001, т. 2, с. 371.
90.Kobayashi G., Vatsuda Y., Natsuki R., Sone M., Chem. Pharm. Bull. 1972 20 (4) 657.
91.Ахрем А.А., Гуляквич О.В., Михальчук А.Л., в кн. Азотистые гетероциклы и алкалоиды, под ред. Карцева В.Г., Толстикова Г.А., М.: Иридиум-Пресс, 2001,
т. 2, с. 88.
92.Kato T., Yamanaka H., Yamamoto Y., Sakamoto T., Yakugaku Zasshi 1970 90 613.
93.Sakamoto M., Akimoto T., Fukutomi K., Ishii K., Chem. Pharm. Bull. 1984 32
(3) 1170.
94.Phillipp A., Humber L.G., Bruderlein F.T., Gotz M.K., US Patent 3 896 130; Chem. Abstr. 1976 84 30922d.
95.Humbert L.G., Bruderlein F.T., Phillipp A.H., et al., J. Med. Chem. 1979 22 (7) 761.
96.Тосунян Д.Э., Верин С.В., Кузнецов Е.В., ХГС 1994 (9) 1176.
97.Pyschev A.J., Krasnikov V.V., Zibert A.E., et al., Mendeleev Commun. 1996 (3) 99.
98.Eicher Th., Krause D., Synthesis 1986 (11) 899.
99.Eicher Th., Freihoff W., Synthesis 1986 (11) 908.
Избранные методы синтеза и модификации гетероциклов, том 1 |
43 |
Посвящается профессору В.С. Шкляеву в связи с его 85-летием
3-Бензазепины
Глушков В.А.
Институт технической химии УрО РАН 614990, Пермь, ул. Ленина, 13
Введение
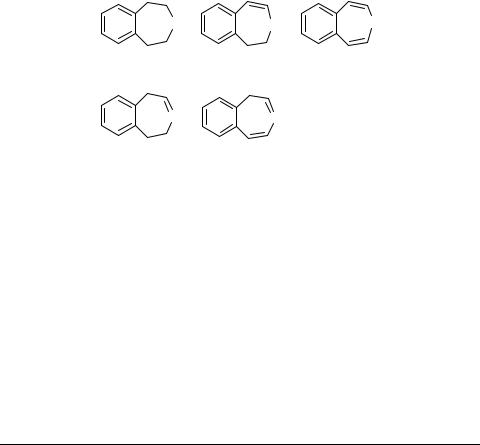
3-Бензазепины (бенз[3]азепины, или бенз[d]азепины) – широко распространены в природе, как и изохинолины, гомологами которых они являются. 3-Бензазепины обычно встречаются в виде замещенных скелетных структур 1–3, тогда как формы 4, 5 редко встречаются в природе и мало используются в химической практике.
6 |
|
|
|
|
|
7 |
5 |
4 |
NR |
NR |
NR |
|
|
3 |
|||
8 |
1 |
2 |
|
|
|
9 |
1 |
|
|
2 |
3 |
R = H, Me, Alk, Acyl |
|
|
|||
|
|
|
N |
N |
|
|
4 |
|
|
5 |
|
Есть подробный обзор по химии азепинов [1], но в нем уделяется мало внимания бензо-аннелированным системам. Обзор Орито [2], относящийся прямо к 3-бензазепинам, к настоящему времени уже устарел. Благодаря своеобразной химической структуре, 3-бензазепины представляют собой привлекательные синтетические мишени. Предметом данного обзора будут методы синтеза 3-бензазе- пинов и некоторые их химические свойства.
Распространение в природе и биологическая активность
Ядро 3-бензазепина входит в структуру молекул таких алкалоидов (схема 1), как изоиндоло[1,2-b][3]бензазепиновые алкалоиды чиленин 6 [3–5] и ленноксамин 7 [6, 7], реадиновые алкалоиды порфороксин 8 [8], альпинин 9 [9], цефалотаксин 10 [10] и его производные: цефалозамины 11 [11] и харрингтонины 12 [12]. Имеются обзоры по химии двух последних алкалоидов растений рода Cephalotaxus [13, 14]
44 |
Серия монографий InterBioScreen |
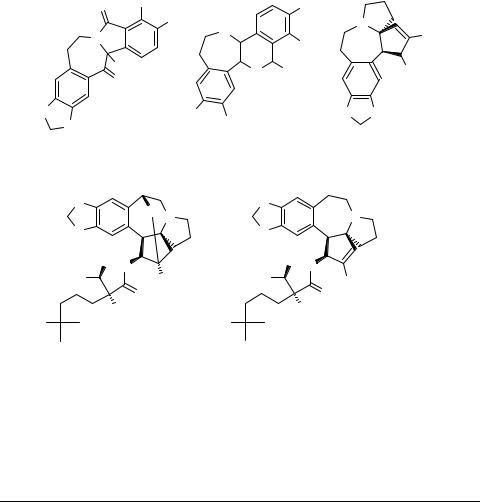
(см. также работу [15] и цитируемую там литературу). Сам цефалотаксин 10 биологически малоактивен, однако, среди его производных – цефалозаминов 11 и харрингтонинов 12 – найдены вещества, обладающие антилейкемическим действием (схема 1) [16].
Класс 3-бензазепинов представляет большой интерес для фармакологов, поскольку многие соединения данного ряда проявляют сродство к α- и β-адрено- рецепторам [17] (схема 2, соединения 13, 14) и к рецепторам дофамина [18–20] (соединения 15, 16). Интересно отметить тот факт, что соединение 16 может проявлять сродство как к D1, так и к D2 рецепторам дофамина в зависимости от типа сочленения колец B и C (цис- или транс-) [21].
Схема 1
|
O |
OMe |
|
|
OR |
|
|
9 |
10 |
OMe |
H |
N |
|
6 |
7 |
OMe |
||||
5 |
N 8 |
|
|
N |
RO |
|
|
11 |
|
|
|||
|
|
|
|
|||
|
R |
|
|
|
||
4 |
12 |
|
O |
OMe |
OH |
|
X |
|
|
||||
3 |
|
|
|
|
|
|
1 |
|
|
|
|
|
|
O |
|
MeO |
|
O |
O |
|
2 |
|
OMe |
||||
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
6 R = OH, X = O |
|
8 2R = (CH2) |
10 |
|
||
7 R = H, X = H2 |
|
9 R = Me |
|
|
||
O |
O |
N |
O |
N |
|
|
O |
O |
|
||||
|
|
|
|
|||
|
R2 O |
|
|
MeO2C |
R2 O |
|
MeO2C |
OMe |
OMe |
|
|||
n( ) |
|
O |
|
n( ) |
O |
|
OH |
|
|
OH |
|
||
R1 |
|
|
|
R1 |
|
|
11 цефалозамины |
|
12 харрингтонины |
|
|||
11 цефалозамин А: R1 = OH, R2 = H, n = 1; цефалозамин B: R1 = R2 = H, n = 1; цефалозамин C: R1 = R2 = OH, n = 0
12 харрингтонин: R1 = OH, R2 = H, n = 0; гомохаррингтонин: R1 = R2 = H, n = 1; деоксихаррингтонин: R1 = R2 = H, n = 0; изохаррингтонин: R1 = H, R2 = OH, n = 0
Избранные методы синтеза и модификации гетероциклов, том 1 |
45 |
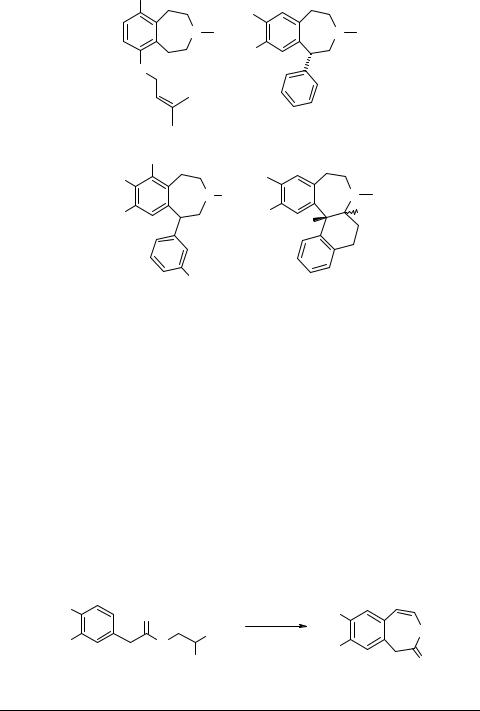
Схема 2
Cl
Cl
N N HO
O
13 (SKF 104078) [17] |
|
14 [22] |
|
|
|
X |
Cl |
|
|
|
|
HO |
A |
|
B N |
|
|
N Y |
|
|
H |
||
HO |
HO |
H |
C |
||
|
|
|
|||
|
|
|
|
|
|
|
|
|
D |
|
|
Z |
|
|
|
|
|
15 |
|
16 |
[18,19, 21] |
|
|
15: X = Z = H, Y = Me (соединение SKF 75670) [23]; X = Y = Z = H (SKF 38393) [24]; X = Cl, Y = Z = H (SKF 81297) [24]; X = Z = H, Y = All (SKF 77434) [24]; X = Cl, Y = All, Z = H (SKF 82958) [24]; X = Cl, Y = Z = Me (SKF 83959) [25]
Некоторые другие агонисты и антагонисты D1 и D2 рецепторов дофамина изучались в работах [26–28]. Биоактивная конформация R-(+)-8-хлор-2,3,4,5- тетрагидро-3-метил-5-фенил-1H-3-бензазепин-7-ола 16 обсуждается в статье [29]. Фторзамещенные 3-бензазепины описаны в работе [30].
Синтетические подходы к 3-бензазепинам
1. Формирование C5–C5a связи
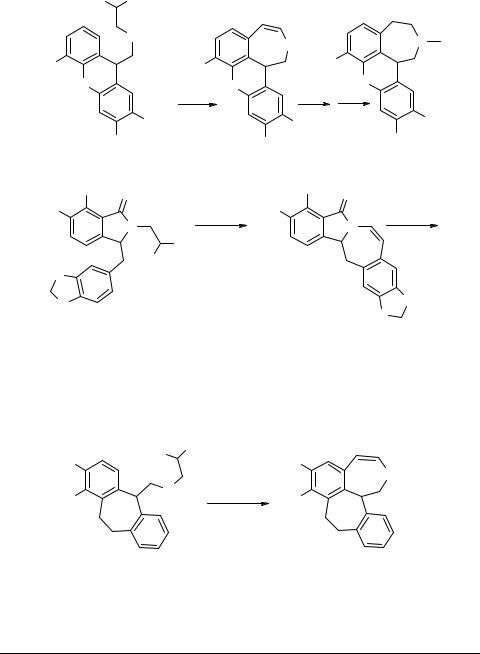
Сначала рассмотрим циклизацию замещенных аминоацеталей или аминоспиртов (по типу реакции Померанца–Фрича [31]), проходящую в присутствии кислот. Так, например, циклизация амида 17 приводит к 3-бензазепину 18 (схема 3) [32].
Схема 3
MeO |
O |
|
конц. HCl |
MeO |
|
|
|||
MeO |
N |
OMe |
AcOH, |
NH |
|
т. комн. |
MeO |
||
|
H |
OMe |
||
|
|
|
O |
|
|
17 |
|
|
18 |
46 |
Серия монографий InterBioScreen |
Этот тип реакции был использован при циклизации аминоацеталя 19 (схема 4) в алкалоид (±)-O-метилклавизепин 20 [33], а также в синтезе ленноксамина 7 [34]:
Схема 4
MeO |
OMe |
|
|
|
|
|
NTs |
|
NTs |
N |
|
|
|
|
|
||
MeO |
MeO |
|
MeO |
O |
|
O |
HCl |
O |
|
|
|
|
|
|
|
|
|
|
OMe AcOH |
OMe |
OMe |
||
|
OMe |
|
OMe |
OMe |
|
|
19 |
|
|
20 |
|
OMe |
O |
|
OMe O |
Pd/C |
|
MeO |
|
H2SO4 |
MeO |
|
|
|
HCO NH |
|
|||
|
N |
AcOH |
N |
2 4 |
7 |
|
OMe |
|
MeOH |
|
|
|
MeO |
|
|
∆ |
|
O |
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
O |
|
|
|
|
|
O |
|
Подобным же образом из аминоацеталя 21 (схема 5) образуется 6,7-ди- гидрокси-2,3,4,8,9,13b-гексагидро-1H-бензо[6,7]циклогепта[1,2,3-ef][3]бензазепин
22 [35]:
Схема 5
MeO |
MeO |
OMe |
|
MeO |
|
|
|
||||
|
|
|
|||
|
NCOCF3 |
MeSO3H |
NCOCF3 |
||
MeO |
MeO |
||||
|
|
|
|||
21 |
22 |
Подходящим катализатором для подобных циклизаций оказалась метансульфокислота. Так, из замещенного 2-амино-1-тетралола 23 были получены кон-
Избранные методы синтеза и модификации гетероциклов, том 1 |
47 |

формационно-затрудненные аналоги селективных лигандов дофаминовых рецепторов типа D1 – соединения 24a и 24b (схема 6) [20].
Схема 6
HO |
|
|
|
|
|
|
N |
O |
H |
6a |
O |
H |
|
MeSO3H |
||||||
13b |
NH + |
NH |
||||
O |
O |
O |
||||
O |
|
|
|
|||
|
|
|
|
24b |
||
23 |
|
24a |
|
|
Структура соединений 24a, b была подтверждена методом РСА. Их можно различить по константам спин-спинового взаимодействия в ЯМР 1H спектрах:
J6a,13b = 7.5 Гц для 24a (цис-изомер), J6a,13b = 3.5 Гц для 24b (транс-изомер).
Путь к другим агонистам и антагонистам дофаминовых рецепторов (см. выше) показан на схеме 7 [36].
Схема 7
|
NH2 |
O |
Cl |
|
Cl |
|
|
||
|
|
|
HN |
|
|
+ |
|
MeO |
|
|
|
|
||
MeO |
Br |
|
|
O |
|
|
|
|
|
|
|
|
|
Br |
|
H2SO4 |
Cl |
|
|
|
|
|
NH |
|
|
|
|
|
|
|
|
MeO |
|
|
Br
Некоторые другие примеры подобных реакций описаны в [26–28]. Окислительная циклизация сульфидов 3,4-(MeO)2C6H3CH2CH2N(Me)C(O)CH2SR под действием бис-трифторацетата фенилиодония привела к 3-мeтил-1-алкилтио-7,8- диметокси-1,3,4,5-тетрагидро-2H-3-бензазепин-2-онам [37]. Сообщалось также
48 |
Серия монографий InterBioScreen |
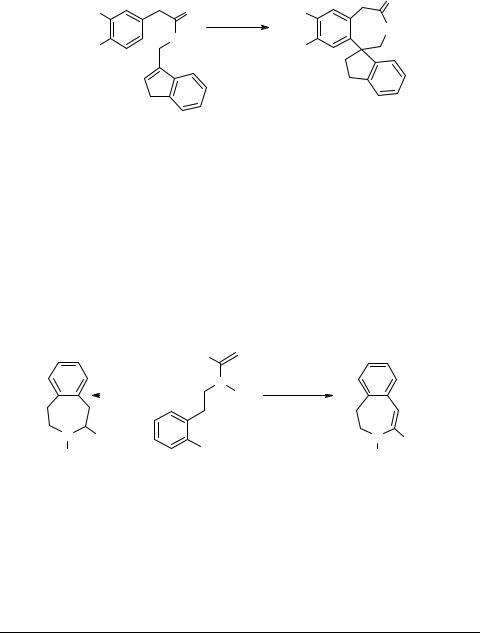
о получении 3-бензазепинов по реакции Бишлера–Напиральского [38]. Действие метансульфокислоты на замещенные индены приводит к спиро-3-бензазепинам 25
(схема 8) [39].
Схема 8
|
|
|
O |
MeO |
O |
MeSO3H |
MeO |
|
|
NH |
|
|
NH |
|
|
HO |
|
HO |
|
|
|
25 (75%)
Содержащие при C4 карбоксильную группу 3-бензазепины типа 26 и 27 являются конформационно-ограниченными аналогами аминокислот Phe, Tyr, Trp и His [40]. Несколько групп исследователей изучали применение к синтезу подобных соединений внутримолекулярной реакции Хека (образование C5–C5a связи). Гибсон показала, что внутримолекулярная реакция Хека дает продукт 26 с выходом 55%, [41], в то время как радикальная циклизация приводит к соединению 27 с выходом 73% [42] (схема 9). Реакция Хека может быть применена и к синтезу высших гомологов: 1,2,3,4,5,6-тетрагидро-3-бензазоцин-2-карбоновой кислоте (Hic, n = 2 на схеме 9) и к 2,3,4,5,6-гексагидро-3-бензазонин-2-карбоновой кислоте (Nic, n = 3) [41, 43].
Схема 9
|
|
Bu3SnH |
MeO2C |
|
|
|
|
N |
кат. Pd(OAc)2 |
|
|
|
|
AIBN |
|
||
|
|
Boc |
|
||
n( ) |
∆, бензол |
( )n |
NaHCO3 |
n( ) |
|
N |
CO2Me |
|
Bu4NCl |
N CO Me |
|
I |
|
||||
Boc |
|
|
|
2 |
|
|
|
|
|
Boc |
|
27 (73 %) |
|
|
|
|
26 (55%) |
n = 1−3 |
|
|
|
||
Титце [44] нашел, что в случае триметилсилилзамещенных амидов соотношение силилированного и десилилированного продуктов 28/29 (схема 10) зависит от типа катализатора: катализатор А (5 мол. % Pd(OAc)2/10 мол. % PPh3/3 экв. Ag2O) дает отношение 28/29 = 10/90; катализатор Б (2.5 мол. % [Pd2(dpu)3/10 мол. % PPh3/3 экв. Ag2O) – 28/29 = 95/5.
Избранные методы синтеза и модификации гетероциклов, том 1 |
49 |
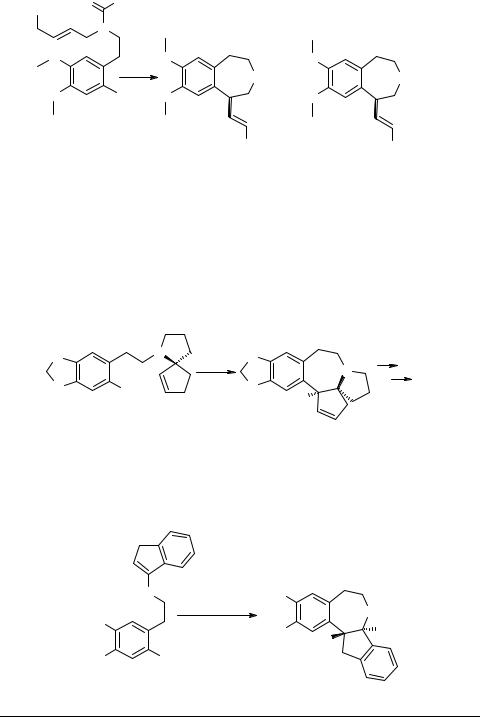
Схема 10
O |
CF3 |
|
|
|
|
|
|
SiMe3 |
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
Pd-кат. O |
|
|
O |
|
|
O |
I |
O |
NCOCF3 + |
|
NCOCF3 |
||
|
|
O |
|
|
|||
|
|
28 |
SiMe |
3 |
|
29 |
H |
|
|
|
|
|
|||
В ранних работах по циклизации подобных систем авторы использовали фотохимический подход [45], но реакция Хека все-таки предпочтительнее. В группе Титце был разработан также высокоэффективный энантиоселективный метод синтеза цефалотаксина, ключевая стадия которого состоит в Pd-катализи- руемом замыкании кольца в бромиде 30 [15]. Хиральное соединение 30 (схема 11) было получено в две стадии: путем восстановления замещенного циклопентенона по Кори хиральным оксазаборолидином, а затем энантиоселективной циклизацией Pd-аллильного комплекса по Тросту.
Схема 11
O |
N |
Pd кат. O |
4 стадии |
|
|
N |
10 |
O |
Br |
O |
|
|
|
H |
|
|
30 |
|
|
Подобным же образом был синтезирован гомоцефалотаксин [46]. 7-Эндо-триг-радикальная циклизация приводит к получению индено[1,2-b]-3-
бензазепинов 31 [47] и изоиндоло[1,2-b]-3-бензазепинов [48, 49]. Этот путь был апробирован и для синтеза ленноксамина 7 (схема 12) [50]:
Схема 12
OHCN |
Bu3SnH, AlBN MeO |
|
NCHO |
||
MeO |
бензол, t° |
|
|
||
MeO |
H |
H |
|||
|
|
||||
|
|
|
|
||
MeO |
Br |
|
|
|
|
|
|
|
31 |
|
|
50 |
Серия монографий InterBioScreen |
