
Карцев В.Г. - Избранные методы синтеза и модификации гетероциклов. Том 1 (2003)(ru)
.pdf
70.Яновская Л.А., Домбровский В.А., Хусид А.Х., Циклопропаны с функциональ-
ными группами, М.: Наука, 1987.
71.Анисимова Н.А., Дейко Л.И., Мандельштам Т.В., в сб. Современные проблемы органической химии: Межвуз. сб. научн. тр. СПбУ, СПб, 1996,
с. 136.
72.Анисимова Н.А., Дейко Л.И., Мандельштам Т.В., Циклопропановые аминокислоты, СПб: РГПУ им. А.И. Герцена, 1997, c. 3.
73.Анисимова Н.А., Дейко Л.И., Беркова Г.А., ЖОХ 2002 72 (1) 93.
74.Buchner E., Chem. Ber. 1890 23 703.
75.Buchner E., Dessauer T., Chem. Ber. 1894 27 (1) 879.
76.Buchner E., Liebigs Ann. Chem. 1893 273 230.
77.Buchner E., Liebigs Ann. Chem. 1892 470 295.
78.Donald R., Norman, Magnus, Can. J. Chem. 1965 43 1407.
79.Auwers K., Konig F., Liebigs Ann. Chem. 1932 496 252.
80.McGreer D., Wu W., Can. J. Chem. 1967 45 461.
81.McGreer D., Mastes J., J. Chem. Soc. Perkin Trans. 2 1969 47 3975.
82.Martelli J., Carrie R., Bull. Soc. Chim. Fr. 1977 11 1182.
83.Nagai W., Hirata Y., J. Org. Chem. 1978 43 (4) 626.
84.Hamelin I., Carrie R., Bull. Soc. Chim. Fr. 1972 5 2054.
85.Piet J.C., Coilleu P., Benhaua N., Bull. Soc. Chim. Belg. 1995 104 (7) 449.
86.Donald R., Daniel, Can. J. Chem. 1965 43 1407.
87.Engel P., Chem. Rev. 1980 2 100.
88.Deleux J., Leroy G., Weiler J., Tetrahedron 1973 (29) 1135.
89.Mcreer D., Chiu N., Vinje M., Wany K., Can. J. Chem. 1965 43 1389.
90.Jones W.M., J. Am. Chem. Soc. 1960 82 3136.
91.Jones W.M., Sanderfer P., Baarda D., J. Org. Chem. 1967 32 (5) 1367.
92.Walbrosky H., Pitt C., J. Am. Chem. Soc. 1962 84 4831.
93.Overberger C., Anselme J., J. Am. Chem. Soc. 1964 86 658.
94.Hauptmann S., Hirschberg K., J. Prakt. Chem. 1967 36 (1) 73.
95.Jones W.M., J. Am. Chem. Soc. 1959 81 5153.
96.Tabushi J., Takagi K., Okano M., Oda R., Tetrahedron 1967 23 2621.
97.Moore R., Vishra R., Crawford R., Can. J. Chem. 1968 46 (21) 3305.
Избранные методы синтеза и модификации гетероциклов, том 1 |
21 |

Синтез конденсированных производных хинолизина аннелированием циклических оснований Шиффа: Реакции [3+3]-циклоконденсации
Ахрем А.А., Гулякевич О.В., Михальчук А.Л.
Институт биоорганической химии Национальной Академии наук Беларуси 220141, Минск, ул. акад. В.Ф. Купревича, 5, корп. 2
Введение
В методах построения молекулярных скелетов конденсированных гетероциклов с ангулярным атомом азота важное место занимают реакции аннелирования циклических шиффовых оснований (азометинов 1а и таутомерных им енаминов 1b) [1–5]. В опубликованных ранее обзорах [1–3] обсуждались [2+4]-циклоконден- сации циклических азометинов 1а c 1,4-диполярофилами 2 (схема 1). Другое направление представляют [3+3]-циклоконденсации енаминовых таутомеров 1b c 1,3-диэлектрофилами 3. Как видно из формализованной схемы 1, и в первом и во втором случаях надстройка пиридинового цикла к циклическому основанию Шиффа приводит к родственным структурам 4, 5 с ангулярным атомом азота.
В химическом отношении енамины обычно рассматривают как С-нуклео- филы, что объясняют делокализацией неподеленной пары электронов атома азота, за счет сопряжения с π-электронами этиленового фрагмента [6–13]. Более современные представления, учитывающие наличие повышенной электронной плотности на атоме азота и β-углеродном атоме енаминовой системы, позволяют рассматривать эти соединения как 1,3-динуклеофилы [14]. Как следствие, взаимодействие таких систем с диэлектрофилами может приводить к образованию азотсодержащих гетероциклов.
Согласно общим представлениям [15, 16], в качестве 1,3-диэлектрофильных субстратов 3 в реакциях аннелирования могут выступать β-дикарбонильные соединения KН (R = H, Alk, Ar, Ac), их енолы ЕН или производные ЕХ (X = NRR, OAlk, SR, Hal), α,β-непредельные карбонильные соединения ЕX (X = H, Alk, Ar), полиены, содержащие электронодонорные и/или электроноакцепторные заместители EN, а также 1,3-бифункциональные алкилирующие агенты, такие как 1,3-ди- алогеналканы RX (X, X' = Hal).
Предметом настоящего обзора являются методы аннелирования циклических азометинов и енаминов 1,3-диэлектрофилами KН, EН, EХ, EN, RX, и др. Следует отметить, что использование оснований Шиффа в органическом синтезе является предметом множества обзорных работ [6–13, 17–32]. Тем не менее, ни в одном из указанных обзоров, общая проблема использования 1,3-динуклеофильных свойств шиффовых оснований в синтезе конденсированных гетероциклов не обсуждалась.
22 |
Серия монографий InterBioScreen |
Схема 1
|
|
δ+ |
|
|
Z |
|
|
|
|
δ− |
|
|
|
|
|
|
|
R1 |
|
|
|
N |
|
N: |
|
2 |
|
|
|
Z |
|
|
[2+4] |
|
|
|
|||
δ+ |
|
|
R |
|
|
||
R |
|
|
|
|
|
R1 |
|
1a |
|
|
|
|
|
4 |
|
имины |
|
δ+ |
|
|
|
|
|
|
|
|
|
Z |
|
|
|
|
|
δ+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R1 |
|
|
|
N |
|
|
|
3 |
|
|
|
Z |
|
NH |
|
|
|
|
|
||
|
[3+3] |
|
|
|
|||
R δ− |
|
|
R |
|
|
||
|
|
|
|
|
R1 |
|
|
1b |
|
|
|
|
|
5 |
|
енамины |
|
|
|
|
|
|
|
O |
O |
|
|
O |
OH |
O |
X |
|
|
|
|
δ+ |
δ+ |
|
δ+ |
δ+ |
R δ+ |
|
|
δ− |
δ+ |
Rδ− |
|
|
|
|
R |
||||
|
KH |
|
|
|
EH |
|
EX |
|
|
R |
|
|
X |
X |
|
|
X |
δ− |
|
|
|
|
|
|
|
δ− |
Y |
|
δ+ |
|
|
|
|
δ+ δ+ |
δ+ |
|
|||
|
|
|
|
|
R |
|
|
|
|
EN |
|
|
RX |
|
|
Принимая во внимание практическую ценность получаемых аннелированных пиридиновых и других азиновых систем [33, 34], подходы к синтезу которых рассмотрены в настоящем обзоре, анализ и теоретическое обобщение материала, накопившегося по этому вопросу к настоящему времени представляет особый интерес. Помимо синтетических подходов, представленных на схеме 1, можно также упомянуть об основанных на принципах домино мультикомпонентных процессах [35–37], где ключевыми стадиями при получении азагетероциклов являются реакции [3+3]-циклоконденсации. Однако, учитывая то, что эти процессы пока еще исследованы недостаточно, их обсуждение в настоящем обзоре представляется преждевременным.
Избранные методы синтеза и модификации гетероциклов, том 1 |
23 |
Аннелирование циклических шиффовых оснований α,β-непредельными
карбонильными соединениями и их аналогами
[3+3]-Циклоконденсация с нитрилами α,β-непредельных карбоновых кислот
Первое сообщение об аннелировании пиридинового цикла к производным изохинолина было опубликовано в 1961 г. [38]. В этой работе, посвященной синтезу эметина и родственных соединений, изучались реакции 1-замещенных 3,4-ди- гидроизохинолинов 6 (R = СN; R1+R4 = H; R2, R3 = Н, OMe) с акрилонитрилом.
Схема 2
|
|
CN |
R1 |
|
R2 |
|
R4 |
|
|
|
R2 |
|
||
|
R4 |
|||
|
|
|
||
R3 |
NH |
R3 |
NH |
|
|
|
|
||
N |
R |
|
R |
|
7 |
|
6 |
|
|
|
|
|
NC |
CN |
|
|
|
F3C CF3 |
|
|
|
|
R1 |
|
R2 |
|
R2 |
R4 |
|
|
N X |
|
R4 |
|
R3 |
R3 |
N |
NH2 |
|
|
|
|
||
|
R |
|
R |
CN |
|
8 |
|
F3C CF3 |
|
|
|
9 |
|
|
Изображенные на схеме 2 производные 6 являются енаминовыми таутомерами соответствующих иминопроизводных (3,4-дигидроизохинолинов). В описанном эксперименте [38], в результате взаимодействия енаминов 6 с акрилонитрилом на первой стадии образуются Михаэлевские аддукты 7 (R, R5 = СN; R2, R3 = H, ОМе), существующие также в термодинамически более предпочтительной енаминовой форме. Гетероциклизация енаминонитрилов 7 под действием кислоты (TsOH) или основания (EtONa) приводит к пиридо[2,1-a]изохинолинам (бензо[a]-
хинолизинам) 8 (R = CN, CO2Et; R2, R3 = OMe; X = NH, O) [38].
К сожалению, акрилонитрил и его аналоги являются не лучшими агентами для аннелирования циклических оснований Шиффа, поэтому исследования в этом направлении имеют скорее теоретический, нежели прикладной характер и, как следствие, представлены еще лишь несколькими частными примерами [39–41].
Так, описаны синтезы аддуктов 7 (R = H, CO2Et; R1, R4 = H; R2, R3 = OMe;
24 |
Серия монографий InterBioScreen |
R5 = CN, CO2Et) и их превращение в трициклические производные 8 (R = H; R2, R3 = OMe; X = H2, O) [39, 40]. Интересное развитие этот подход получил при использовании в циклоконденсации c азометинами 6 (R = H, Cl; R1 = H; R2, R3 = H, OMe; R1+R2 = CH=CH–CH=CH) 1,1-дициано-2,2-трифторметилэтилена
[41]. В этом случае трициклические производные 9 (R = H, Cl; R1 = H; R2, R3 = H, OMe; R1, R2 = CH=CH–CH=CH) были получены в одну стадию, без выделения аддуктов типа 7.
[3+3]-Циклоконденсация с амидами и эфирами α,β-непредельных карбоновых кислот
Более доступными и привлекательными для практического применения, по сравнению с непредельными нитрилами, являются сложные эфиры и амиды α,β-непре- дельных карбоновых кислот. Известно, что при взаимодействии 1-алкизаме-
щенных 3,4-дигидроизохинолинов 10 (R = H; R1 = H, Ph, СO2Et, CH2CH2CO2Me) с
акриламидом 11 (R2 = H, Z = NH2) [42] и акриловыми эфирами 11 (R2 = H, Ме; Z = OMe) [43] образуются производные пиридо[2,1-a]изохинолина 12 (R = H; R1 = H, Ph, CO2Et, CH2CH2CO2Me).
Схема 3
R |
|
R2 |
Z |
R |
|
|
R |
N |
+ |
O |
R |
N |
O |
|
||||||
|
|
|
|
|||
|
R1 |
|
|
|
R1 |
R2 |
|
10 |
|
11 |
|
12 |
|
В последующие годы в эту реакцию были введены: метиловый эфир 1,2,3,4- тетрагидро-1-изохинолинилиденуксусной кислоты 6 (R = CO2Et; R1+R4 = H) [44], 1-метил-3,4-дигидроизохинолины 10 (R = H, OMe; R1 = H) [40, 45–52], β-карбо-
лины 13 (R1 = H, OMe) [53], алкилиденмалоновый эфир 14 [46–49], диэтиловый эфир глутаконовой кислоты 15 [45, 49], метиловый и этиловый эфиры акриловой кислоты 11 (R2 = H; Z = OMe, OEt) [40, 44, 50, 51, 53]. В результате были полу-
чены соответствующие пиридо[2,1-a]изохинолины 16 [44–52] и гексагидропиридо- [2,1-a]-β-карболины 17 [53].
Схема 4
|
|
|
O |
OMe |
EtO2C CO2Et |
|
|
|
|
CO2Et |
|
R1 |
N |
N |
|
OMe |
|
|
|
CO2Et |
|||
|
H |
MeO |
O |
|
|
|
13 |
|
14 |
|
15 |
Избранные методы синтеза и модификации гетероциклов, том 1 |
25 |
R |
|
|
|
N |
R |
|
|
|
|
|
|
|
|
|
|
R |
N |
O |
|
|
O R |
|
N |
|
|
|
|
|
|
||
|
R2 |
R4 |
NH |
|
|
R2 |
R3 |
|
|
|
|
|
|||
|
R3 |
|
R1 |
|
|
AlkO2C |
|
|
16 |
|
|
|
|
|
|
|
|
17 |
|
|
18 |
|
Следует отметить, что в одних случаях реакции с непредельными эфирами 11, 14, 15 осуществлялись как одностадийные, приводящие непосредственно к продуктам аннелирования 16, 17 [43, 45–49, 53]. В других примерах реакцию останавливали на стадии образования аддуктов Михаэля 18 (R = H, OMe; R2 = H, CH2CH2COOEt, COOEt; R3 = CH2CH2(OMe)2), которые затем циклизовали в процессе восстановления C=N связи NaBH4 в конечные продукты 16 [44, 50, 51]. Эти данные свидетельствуют, что рассмотренные реакции [3+3]-циклоконденса- ции являются последовательностями нескольких элементарных актов: (а) Михаэлевское присоединение, (б) таутомерное имин-енаминное превращение Михаэлевских аддуктов и (в) циклоконденсация в целевые продукты 16.
Обращает на себя внимание неожиданное различие в региохимии аннелирования 3,4-дигидроизохинолинов 10 и β-карболинов 13. В случае первых аннелируется α-пиридоновый цикл с образованием пиридоизохинолинов 16 [44–52], в то время как при аннелировании β-карболинов 13 надстраивается γ-пиридоновый цикл с образованием производных 17 [53]. К сожалению такое различие в направлении однотипных реакций пока не получило теоретического объяснения.
Схема 5
MeO |
|
|
CO2Me |
R |
|
|
|
|
|
|
|
||
|
MeO2C |
|
|
|
||
|
|
R |
N |
O |
||
|
19 |
|
|
|||
|
|
|
|
21 |
||
|
|
|
|
|
|
|
|
|
|
|
|
R1 |
CO2Me |
10 |
|
|
|
|
OMe |
|
Ar |
O |
|
|
|
|
|
|
|
|
Ar |
O |
||
|
|
NH |
|
|
||
|
|
|
|
R1 |
|
|
O |
N |
O |
|
|
NH |
|
|
|
|
||||
|
H |
|
|
R |
|
22 |
|
20 |
|
|
N |
N O |
|
|
|
|
|
|||
R
26 |
Серия монографий InterBioScreen |
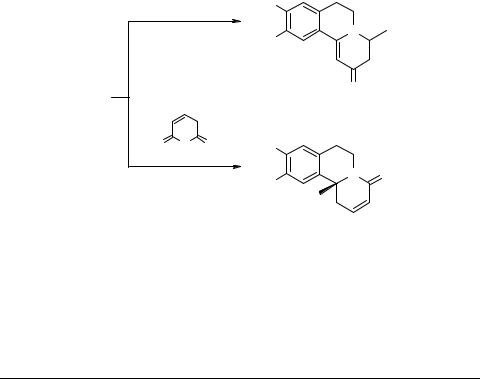
Дальнейшее развитие этот метод нашел в аннелировании 3,4-дигидроизохино- линов 10 (R = H, OMe; R1 = H, Me) арилиденовыми производными малонового эфира 19 [54–57] и барбитуровой кислоты 20 (Ar = Ph, 4-MeO-C6H4, 4-Me2N-C6H4, 4 NO2-C6H4, 3,4-(OH)2-C6H3, 3,4-(OMe)2-C6H3) [57–59]. Это позволило получить
2-фенилзамещенные пиридо[2,1-a]изохинолины 21 (R = H, OMe; R1 = H, Me) [54–57] и производные пиримидо[5',4':5,6]пиридо[2,1-a]изохинолин-1,3-диона 22
(R = H, OMe; R1 = H, Me; Ar = Ph, 4-MeO-C6H4, 4-Me2N-C6H4, 4 NO2-C6H4, 3,4-(OH)2-C4H3, 3,4-(OMe)2-C6H3) [57–59], представляющие интерес для физико-
химических и биологических исследований.
[3+3]-Циклоконденсация с ангидридами α,β-непредельных карбоновых кислот
Подобно непредельным эфирам 11, 14, 15 и амидам 11, 1,3-диэлектрофилами являются также ангидриды α,β-непредельных карбоновых кислот. Взаимодействие 3,4-дигидроизохинолина 10 (R = OMe; R1 = H) с ангидридом кротоновой кислоты приводит к образованию сложной реакционной смеси, из которой с выходом 17.5% был выделен продукт аннелирования 23 [60]. В отличие от реакций с эфирами, амидами или нитрилами (схемы 2–5), приводящих к наращиванию α-пиридоновых циклов и получению соединений 8, 12, 16, в случае непредельных ангидридов образуются γ-пиридоновые циклы 23.
Схема 6
(MeCH=CHCO)2O |
MeO |
|
|
|
|
|
|
|
MeO |
|
N |
|
|
|
|
10 |
|
23 |
O |
|
|
||
O O O |
MeO |
|
|
24 |
|
|
|
N O
MeO
25
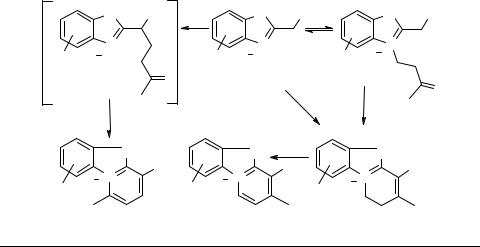
Вероятно, в последнем случае начальной стадией реакции является ацилирование имина 10 по электрофильному β-углеродному атому непредельным ангидридом.
В тоже время при взаимодействии изохинолина 10 (R = OMe; R1 = H) с циклическим непредельным ангидридом 24, вместо предполагаемого продукта [3+3]-циклоконденсации типа 23 с 56% выходом образуется соединение 25 в результате протекания [2+4]-циклоконденсации [60]. Очевидно, что в этом случае
Избранные методы синтеза и модификации гетероциклов, том 1 |
27 |
кардинально изменяется направление электрофильно-нуклеофильных взаимодействий субстрата и реагента.
[3+3]-Циклоконденсация с α,β-непредельными альдегидами и кетонами
Исследование взаимодействия солей α-алкилзамещенных азотсодержащих гетероциклов с α,β-непредельными карбонильными соединениями привело к обнаружению нового метода аннелирования пиридинового цикла [61, 62]. Так, реакции солей бензотиазолия 26 (R = Ph; R1 = H; Z = S; X = Br) бензоксазолия 26 (R = Ph; R1 = H; Z = O; X = Br), бензимидазолия 26 (R = Ph, CO2Et; R1 = H, Cl; Z = NMe, NEt; X = ClO4) и индолия 26 (R = Ph; R1 = H; Z = CMe2; X = ClO4), в зависимости от кислотности метиленовой группы заместителя CH2R и условий синтеза, приводят либо к аддуктам Михаэля 27, либо непосредственно к продуктам аннелирования 28. В отдельных случаях наблюдалось также образование ароматизованных производных 29. Однако ониевые продукты аннелирования 29, как правило, получают дегидрированием над палладием на угле [61]. При использовании более сильных СН-кислот 26 (R = CN, CO2Alk, Ph) реакции изменяют направление, вместо N-аддуктов 27 приводя к С-аддуктам 30, которые уже в условиях реакций превращаются непосредственно в ароматические системы 31 [61]. Аналогичным образом протекают реакции также в случае перхлората индолия 26 (R = Ph; Z = CMe2; X = ClO4).
При аннелировании солей 2-бензилбензоксазолия 26 (R = Ph; R1 = H; Z = O; X = Br) и имидазо[4,5-b]хиноксалиния 32 метилвинилкетоном выходы целевых продуктов 28 (R = Ph; R1 = H; Z = S; X = Br) и 33 не превышают 10%. Это объясняется пониженной СН-кислотностью 2-арилалкильной группы и обратимым характером реакции Михаэлевского присоединения [61]. Представленные примеры [3+3]-циклоконденсаций [61, 62], распространяющиеся на бензазолиевые и индолиевые системы, являются свидетельством общности химических и таутомерных свойств этих гетероциклов [63, 64].
Cхема 7
Z |
R |
|
Z |
R |
Z |
R |
+ |
|
|
+ |
|
+ |
|
NH |
|
nR1 |
NH |
|
N |
|
nR1 X |
|
X |
|
nR1 X |
|
|
30 |
|
O |
26 |
|
27 |
O |
|
|
|
|
|
|
|
Z |
|
|
Z |
|
Z |
|
+ |
R |
|
+ |
R |
+ |
R |
nR1 X N |
|
nR1 X N |
|
nR1 X N |
|
|
31 |
|
29 |
|
|
28 |
|
28 |
Серия монографий InterBioScreen |

N |
Et |
|
N |
Et |
|
|
N |
Ph |
N |
Ph |
|
||
N |
+ |
|
N |
+ |
|
|
NH |
|
N |
|
|
||
ClO−4 |
|
ClO−4 |
HN+ S |
|||
32 |
|
|
33 |
|
ClO−4 |
34 |
|
|
|
|
|
Ph |
|
|
|
|
|
|
|
|
O |
R3 |
|
|
|
Z |
|
|
+ |
R |
||
|
|
|
|
||
|
|
Z |
|
N |
|
|
|
− |
nR1 |
|
|
R2 |
O |
|
ClO4 |
− |
Ph |
|
R4 |
N+ S |
ClO4 |
Z |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
Ph |
|
|
35 |
|
36 |
37 |
38 |
|
Впоследствии в эту реакцию были введены соли 2,3,3-триметилиндолия 26
(R1 = H, 5-Me, 7-Me, Hаl, OAlk; Z = CMe2; X = Cl, Br, ClO4 и др.) [62, 65–69], соль бензилаценафтотиазолия 34 [65] и различные α,β-непредельные карбонильные соединения, например бензилиденацетофенон 35 (R2 = R3 = Ph) [62], бензилиденинданоны 36 (R4 = Ph, C6H4-4-OMe; Z = CH2) [65], фурфурилиденинданон 36
(R4 = CHC4H3O, Z = CH2) [65], бензилидениндандион 36 (R4 = Ph, Z = CO) [65]
бензилидебензофуранон 36 (R4 = Ph, Z = O) [65], бензилиденацетоны 35 (R2 = H, Alk, OAlk, Hаl; R3 = Me) [66], дибензилиденацетоны 35 (R2 = Ph, C6H4-4-Cl, C6H4-4-Br, C6H4-4-OMe, C6H4-4-NMe2; R3 = CH=CHR) [67], коричные 35 (R2 = Ph, C6H4-4-NMe2; R3 = H) [68] и кротоновый альдегиды 35 (R2 = Me, R3 = H) [69]. Это позволило получить труднодоступные производные пиридоиндолия, бензпиридотиазолия, бензпиридооксазолия, и бензпиридоимидазолия 28–31, пиридоимидазохиноксалиния 33 [61], аценафтопиразолопиридиния 37 [65], инденопиридоиндолия 38 [65] и другие соединения, представляющие значительный практический интерес в качестве оптических отбеливателей и красителей для природных и синтетических волокон.
Интересный пример [3+3]-циклоконденсации недавно описан латышскими химиками [70], показавшими, что ендион 39a, генерируемый из хлорвинилкетона 39 при обработке цинком в присутствии ацетата серебра, конденсируется с енаминами 40 (R = H, Me; R1 = COMe, COOMe, COSMe, NO2), образуя соответ-
ствующие гидрированные аналоги изохинолина 41.
Избранные методы синтеза и модификации гетероциклов, том 1 |
29 |
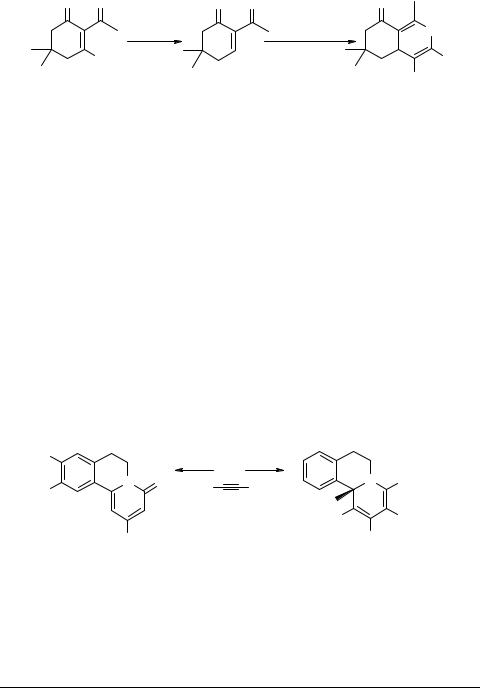
Схема 8
O O |
O O |
RC(NH2)=CHR1 |
O |
|
|
Zn/AgOAc |
|
NH |
|
|
40 |
|
||
Cl |
|
|
|
R |
39 |
39a |
|
41 |
R1 |
|
|
Описанный пример, не относящийся непосредственно к получению хинолизинов, демонстрирует возможности распространения этого метода на другие сферы гетероциклического синтеза.
[3+3]-Циклоконденсация с эфирами ацетилендикарбоновой кислоты
Производные ацетиленкарбоновой кислоты, из которых наиболее подробно изучен диметилацетилендикарбоксилат, подобно своим этиленовым аналогам 11, 14, 15, 19 принадлежат ряду 1,3-диэлектрофилов и также способны вступать в реакции циклоконденсации. Принимая во внимание линейное строение ацетиленовых соединений и, как следствие, их неспособность к одновременному взаимодействию с C- и N-нуклеофильными центрами енаминов и азометинов из-за стерических ограничений, очевидно, что такие реакции осуществляются как последовательность нескольких элементарных актов. Исследование реакций ацетилендикарбонового эфира с 1-метил-3,4-дигидроизохинолинами 10 (R = H, OMe, OCH2O; R1 = H) показало, что в зависимости от условий взаимодействия образуются продукты аннелирования 42 (R = H, OMe) или 43 [71].
Схема 9
R |
1 : 1 |
10 |
1 : 2 |
|
|
+ |
N CO2Me |
||
R |
N O MeO2C |
|
CO2Me |
|
|
|
|
MeO2C |
CO2Me |
|
CO2Me |
|
|
CO2Me |
|
42 |
|
|
43 |
Очевидно, что соединения 42 являются результатом 1,3-динуклеофил- 1,3-диэлектрофильной [3+3]-циклоконденсации, в то время как продукт 43 – результатом мультикомпонентной [2+2+2]-циклоконденсации одного эквивалента азометина 10 (R = R1 = H) c двумя эквивалентами ацетилендикарбонового эфира.
30 |
Серия монографий InterBioScreen |
