
Карцев В.Г. - Избранные методы синтеза и модификации гетероциклов. Том 1 (2003)(ru)
.pdf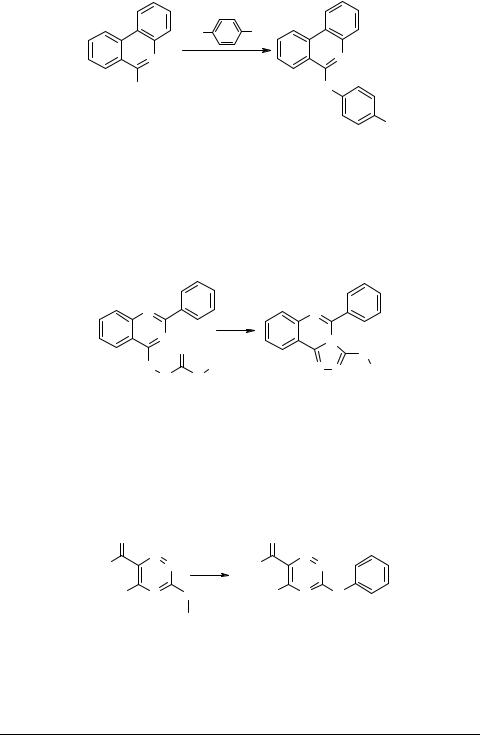
H2N |
R |
|
N |
|
N |
Cl |
HN |
|
84 |
85 |
R |
|
1-(41-Хиназолил)-4-фенилтиосемикарбазиды 86, полученные конденсацией 4- гидразинохиназолина с арилизотиоцианатами, при нагревании с оксидом ртути(II) с хорошим выходом циклизуются в производные 2Н-3-ариламино-1,2,4-триазоло- [4,3-c]хиназолина 87.
N |
|
HgO |
N |
|
|
|
|
|
|
N |
S |
|
N |
H |
|
|
|
N |
|
HN N |
N Ar |
|
N N |
|
|
Ar |
|||
H |
H |
|
|
|
86 |
|
|
87 |
|
Кипячением в спирте этилового эфира 3-метилтио-5-гидрокси-1,2,4-триазин- 6-карбоновой кислоты 88 с анилином получен этиловый эфир 3-анилино-5- гидрокси-1,2,4-триазин-6-карбоновой кислоты 89 [92].
O |
|
|
O |
|
EtO |
N N |
PhNH2 |
EtO |
N N |
HO |
N |
S |
HO |
N N |
|
|
|
|
H |
|
88 |
|
|
89 |
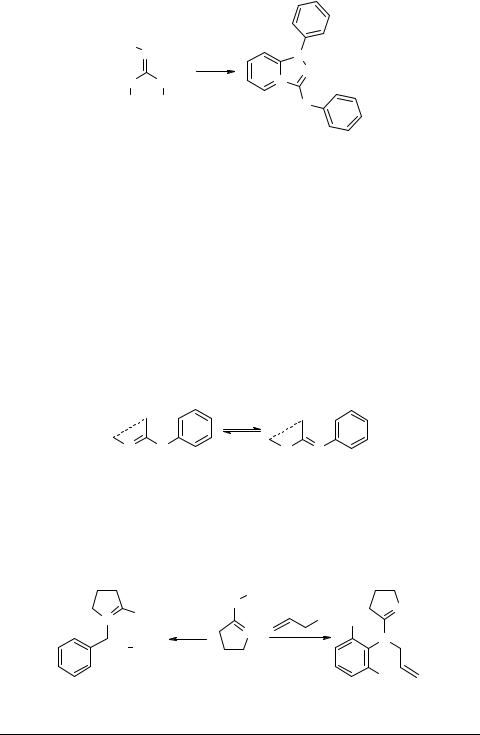
Тозилат 3-анилино-1-фенил-1Н-[1,2,4]триазоло[4,3-a]пиридиния-4 91 получают при взаимодействии п-толуолсульфохлорида с N-гидрокси-N',N''-дифенил- гуанидином 90 в смеси сухого пиридина и толуола при низкой температуре [93].
Избранные методы синтеза и модификации гетероциклов, том 1 |
131 |
HO N |
|
TosCl |
|
N |
Tos− |
HN |
NH |
+ |
N |
||
Py |
N |
|
|
||
Ph |
Ph |
|
|
N |
|
|
|
|
|
H |
|
90 |
|
|
|
91 |
|
Свойства N-ариламидинов
Гетероциклические N-ариламидины могут существовать в двух амино-имино таутомерных формах. Их строение изучалось с помощью ИК-, УФ- и ПМР-спек- троскопии, а также методом рентгеноструктурного анализа. Так, с помощью метода ИК-спектроскопии установлено, что 2-анилинопиридин в твердом состоянии существует в двух формах с преобладанием аминной [94]. В работе [95] на основе данных УФ-, ИК- и ПМР-спектров доказано, что 2-ариламино-5,6-дигидро- 4Н-1,3-тиазины в растворах имеют аминное строение. Но данные РСА свидетельствуют, что те же соединения в твердом состоянии существуют в иминоформе, причем во всех случаях реализуется Z-изомер [96]. Интересно отметить, что замена ариламиногруппы в этом гетероцикле на бензиламиногруппу приводит к реализации аминоформы (метод РСА) [97]. 2-Бензиламинотиазолин в твердом состоянии также находится в амино-форме [98].
N N |
N |
N |
H |
H |
имино- |
амино- |
|
Алкилирование 2-ариламино-4,5-дигидро-3Н-пиррола (92 R = 2,6-Cl2C6H3) протекает [99] по экзоциклическому атому азота с образованием соли 94, тогда как незамещенный 2-амино-4,5-дигидро-3Н-пиррол (95 R = H) алкилируется по эндоциклическому атому азота [100], образуя хлорид 1-бензил-2-амино-4,5-дигидро- 3Н-пирролиния 93.
+ |
NH2 |
HN |
R |
N |
|
Br |
|||
N |
PhCH2Cl |
Cl |
||
|
|
N |
N HBr |
|
|
|
|
||
|
Cl |
|
|
|
|
|
|
|
|
93 |
R = H, Ar |
92 |
|
94 Cl |
|
|
|
|
132 |
Серия монографий InterBioScreen |

Алкилирование производных 5,6-дигидро-4Н-1,3-тиазина (95 X = S) [101] и 5,6-дигидро-4Н-1,3-оксазина (95 X = O) [102, 103] иодистым метилом в ацетоне протекает по экзоциклическому атому азота с образованием соответствующих азинов 96 с выходом более 90%.
H |
|
|
X N |
|
X N |
|
MeI |
|
|
|
|
|
|
|
N |
R |
− |
N |
R |
|
HO |
|
||
95 |
|
|
96 |
|
X = S, O |
|
|
|
|
Замещенные 2-(о-хлорфениламино)пиридины в присутствии эквимолярных количеств щелочи при комнатной температуре в результате фотолиза [104, 105] замыкаются в производные пиридобензимидазола 97 или в 8-хлорбенз[i]-α-карбо- лин (при фотоциклизации 2-(1-нафтиламино)-3,5-дихлорпиридина) [106].
Cl |
N |
hν R |
N |
R |
|
HO− |
|
N |
|
N |
|
H |
|
|
97 |
|
|
|
Интересный метод получения трициклических азолов (99–103) предложен в работе [107]. При обработке амидинов 98 н-бутиллитием образуются бензиновые интермедиаты, которые в присутствии электрофильных реагентов селективно превращаются в аннелированные производные бензимидазола.
|
|
|
H |
X |
|
|
|
N |
|
N |
|
N |
|
|
|
|
( )n |
|
||
|
N |
O |
N |
N |
S |
|
|
98 |
|
||||
R R |
|
|
F |
|
R |
R |
99 |
|
|
|
|||
|
|
|
|
|
100 |
|
|
N |
|
|
N |
|
N |
|
N |
R |
N |
R |
N |
|
R |
|
|
||||
|
|
R |
|
R |
|
|
101 |
|
102 |
|
103 |
|
|
X = O, S, CH2; R = H, Me, SPh, CH(OH)Ph, SiMe3; n = 0, 1, 2
Избранные методы синтеза и модификации гетероциклов, том 1 |
133 |

Взаимодействием производных 3-ариламинопиразола 104 с дибензоилпероксидом или тетраацетатом свинца в результате окислительной циклизации получают производные пиразоло[1,5-a]бензимидазола 105 [108].
H2N |
R1 |
|
|
|
N |
H |
Pb(OAc) |
|
R1 |
||
|
|
4 |
R2 |
||
|
N |
|
|
|
|
HN |
|
|
|
N |
|
N |
|
|
|
||
|
|
|
|
H2N |
N |
|
|
R2 |
|
H |
|
|
104 |
|
|
105 |
|
|
|
|
|
Замещенные 6-аминофенантридины 106 алкилируются диметилсульфатом при кипячении в абсолютном бензоле [90]. При этом показано, что региоспецифичность алкилирования находится в прямой зависимости от природы заместителя при атоме азота в положении 6 системы: в случае алкильных и бензильных заместителей реакция идет по экзоциклическому атому азота с образованием соответствующих бесцветных солей 107. В N-ариламидинах реакция протекает по атому азота гетероцикла с образованием желтых четвертичных солей 108. Выводы о направлении алкилирования были сделаны на основании анализа продуктов щелочного гидролиза соответствующих четвертичных солей 107 и 108.
N Me2SO4 |
|
Me2SO4 |
N+ |
+NH |
|
N |
NH |
− |
R |
NH |
MeSO4− |
MeSO4 |
|
|
|
107 |
106 |
108 |
|
R = CH2Ph, Ph |
|
|
|
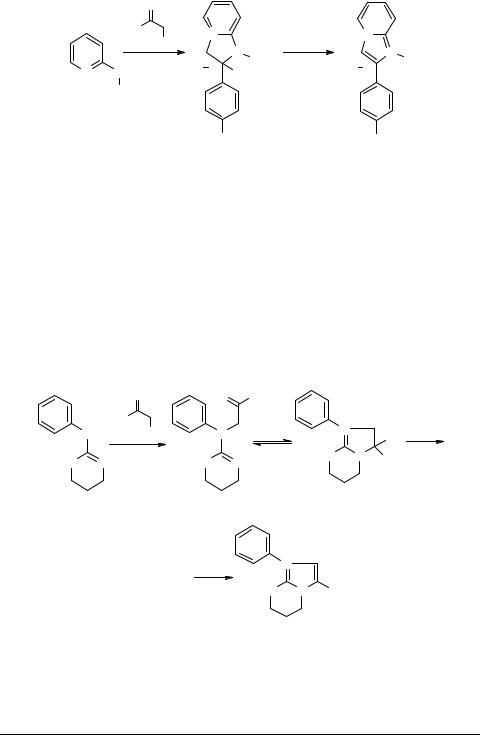
Алкилирование как 2-алкиламинопиридинов (2 R = Me, CH2Ph, Ph), замещенными фенацилбромидами, протекает по эндоциклическому атому азота [109–111] с образованием соответствующих бромидов имидазо[1,2-a]пиридиния 109. Кипячение последних в 48%-ной бромистоводородной кислоте [109] (или в уксусном ангидриде [111]) сопровождается отщеплением молекулы воды с реализацией ароматической системы 110.
134 |
Серия монографий InterBioScreen |
O |
|
|
|
|
|
|
Ar |
|
+ |
HBr или |
N |
|
|
|
Br |
N |
Ac2O |
+ |
||
|
N R |
|
||||
N NH |
|
|
|
N |
R |
|
Br |
OH |
|
Br |
|
|
|
R |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
R = Me, Ph, CH2Ph |
|
R1 |
|
|
R1 |
|
|
|
|
|
|
||
|
|
109 |
|
110 |
|
|
Алкилирование 2-фениламинотиазолина (111 n = 0, X = S), 2-фениламино-5,6- дигидро-4Н-1,3-тиазина (114 n = 1, X = S), 2-фениламино-4,5-дигидро-3Н-пиррола
(111 n = 0, X = CH2), 2-фениламино-3,4,5,6-тетрагидропиридина (111 |
n |
= 1, |
||
X = CH2, 2-фениламино-4,5,6,7-тетрагидро-3Н-азепина |
(111 n = |
2, X |
= |
CH2), |
2-фениламино-5,6-дигидро-2Н-оксазина-1,4 (111 n = 1, |
X = О) |
замещенными |
||
α-галогенкетонами протекает (в отличие от ароматических амидинов 2) по экзоциклическому атому азота [112–115] с образованием солей 112. Последние, в зависимости от размера цикла и заместителей в бензольном кольце могут существовать в таутомерных формах А и В. Кипячение солей 112 в уксусном ангидриде приводит к образованию четвертичных солей 113.
Среди производных солей 113 найдены высокоактивные соединения, которые
предложены в качестве анальгетиков нового поколения [116–119]. |
|
|||||
|
O |
O |
Ar |
|
|
|
NH |
Ar |
N |
|
N+ |
|
|
Br |
|
|
|
Ar |
||
X N |
X |
N |
X |
N |
OH |
|
|
( )n |
|||||
( |
)n |
|
( )n |
|
|
|
111 |
|
112A |
112B |
|
|
|
|
|
|
|
+ |
|
|
|
|
Ac2O |
|
N |
|
|
|
|
|
X |
N Ar |
|
|
|
n = 0, 1, 2; |
|
|
( )n |
|
|
|
|
|
113 |
|
|
|
|
X = O, S, CH2 |
|
|
|
||
Методом РСА показано, что производные тетрагидропиридина (114 X = CH2), 5,6-дигидро-4Н-1,3-тиазина (114 X = S) и 5,6-дигидро-2Н-оксазина-1,4 (114 X = О)
алкилируются фенацилбромидами по эндоциклическому атому азота с образова-
Избранные методы синтеза и модификации гетероциклов, том 1 |
135 |
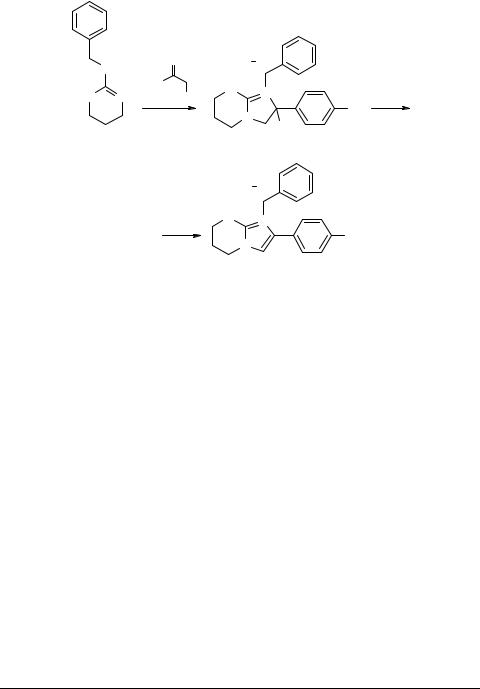
нием бициклических солей 115 [114, 115]. Кипячение последних в уксусном ангидриде приводит к четвертичным солям 116.
NH |
O |
Br |
|
|
Ar |
|
|
||
X N |
X N+ |
|
||
Br |
R |
|||
|
|
N |
|
|
|
|
OH |
|
|
|
|
|
|
|
114 |
|
|
115 |
|
Br
Ac2O X N+
R
N
X = O, S, CH2 116
Литература
1.Чичибабин А.Е., Журн. русск. физ.-хим. об-ва 1926 58 1159.
2.Hoffmann C., Faure A., Bull. Soc. Chim. Fr. 1966 (7) 2316.
3.Ito Y., Hamada Y., Hirota H., Chem. Pharm. Bull. 1972 20 2678.
4.Fr. Patent 2 050 940; PЖХим. 1972 8Н340П.
5.Seidl H., Huisgen R., Grashey R., Chem. Ber. 1969 102 926.
6.Mason J., Tennant G., J. Chem. Soc. Chem. Commun. 1972 (4) 218.
7.Otohiko T., Masashi T., Shuntaro M., Tetrahedron Lett. 1968 36 3877.
8.Anon U.K., Res. Discl. 1992 344 963, Сhem. Аbstr. 1993 118 124364w.
9.Benson R.E., Cairns T.L., J. Am. Chem. Soc. 1948 70 2115.
10.Kabbe H., Berschauer F., FRG Patent 3 529 692; РЖХим. 1987 5Н228П.
11.Javorsky R., Vesela Z., Truchlik S., Chem. Zvesti 1978 32 (2) 223.
12.Grisar J.M., Claxton G.P., US Patent 4 055 561; РЖХим. 1978 11О45П.
13.Grisar J.M., Blohm T.R., US Patent 4 126 413; Chem. Abstr. 1979 90 86770u.
14.Maillard J., Langlois M., Eur. J. Med. Chem. – Chim. Ther. 1983 18 (4) 353.
15.Adcock B., Lawson A., Miles D.H., J. Chem. Soc. 1961 5120.
16.Dains F.B., Brewster R.Q., Malm I.L., J. Am. Chem. Soc. 1925 47 (7) 1981.
17.Gluchowski C., Патент США 5066664; Chem. Abstr. 1992 116 59357p.
18.Lehmann D., Nowak R., GDR Patent 220 957; Chem. Abstr. 1986 104 68842x.
19.Mahajan R.N., Havaldar F.H., Fernandes P., J. Indian Chem. Soc. 1991 68 (4) 245.
20.Mishra R.K., Azian J. Chem. 1992 4 (2) 225; Chem. Abstr. 1992 116 255550k.
136 |
Серия монографий InterBioScreen |

21.Cesur N., Cesur Z., Guersoy A., Arch. Pharm. 1992 325 (9) 623.
22.El-Barbary A., Croat. Chem. Acta. 1985 58 71; Chem. Abstr. 1986 104 168414c.
23.Tilley J.W., Ramuz H., Helv. Chim. Acta 1980 63 (4) 832.
24.Tilley J.W., Ramuz H., Helv. Chim. Acta 1980 63 (4) 841.
25.Weissberger A., Porter H.D., J. Am. Chem. Soc. 1943 65 732.
26.Weissberger A., Porter H.D., J. Am. Chem. Soc. 1942 64 2133.
27.Hetzheim A., Irmscher A., GDR Patent 296 918; Chem. Abstr. 1992 116 194318s.
28.Gerniani A., Passerini R., Ann. Chim. 1954 44 (1) 3; РЖХим. 1955 5510.
29.Kover J., Timar T., Tompa J., Synthesis 1994 (11) 1124.
30.Kurzer F., Sanderson P., J. Chem. Soc. 1962 (1) 230.
31.Давиденков Л.Р., Порай-Кошиц Б.А., ЖОХ 1956 26 (3) 868.
32.Mohsen A., Omar M.E., Synthesis 1974 (1) 41.
33.Garin J., Melendez E., Merchan F.L., et al., J. Heterocycl. Chem. 1991 28 (2) 359.
34.Mohsen A., Omar M.E., Pharmazie 1972 27 (12) 798.
35.Merchan F., Garin I., Martinez V., Melendez E., Synthesis 1982 (6) 482.
36.Kiffer D., Bull. Soc. Chim. Fr. 1970 (6) 2377.
37.Tweit R.C., J. Heterocycl. Chem. 1970 7 (3) 687.
38.Mohsen A., Omar M.E., Habib N.S., Aboulwafa O.M., Synthesis 1977 (12) 864.
39.Papadopoulos E.P., Torres C.D., J. Heterocycl. Chem. 1982 19 (2) 269.
40.Garin J., Melendez F.L., Merchan T., Tejero E., Synthesis 1983 (5) 406.
41.Sastry C.V., Ram B., Krishnan V.S.H., Indian J. Chem., Sect. B 1989 28 (1) 52.
42.Pazdera P., Meindl J., Novacek E., Chem. Pap. 1992 46 (5) 322.
43.Kurasava Y., Yoshishiba N., Kureyama T., et al., J. Heterocycl. Chem. 1992 29
(5) 1653.
44.Srivastava V.K., Singh S., Palit G., Shanker K., Pharmazie 1986 41 (8) 598.
45.Purcell T., Eur. Appl. EP 86 126; Chem. Abstr. 1984 100 6512y.
46.Matsuo M., Taniguchi K., Katsura Y., Chem. Pharm. Bull. 1985 33 (10) 4409.
47.Porretta C.C., Cerreto F., Floravanti R., Farmaco 1988 43 (1) 12.
48.Esser F., Pook K.-H., Synthesis 1992 (6) 596.
49.Назаренко К.Г., Демченко А.М., Ковтуненко В.А., ХГС 1997 (7) 946.
50.Dornow A., Pietsch H., Marcs P., Chem. Ber. 1964 97 2647.
51.Dornow A., Menzel H., Marcs P., Chem. Ber. 1964 97 2173.
52.Sugimoto Y., Jpn. Patent 91.184.914; Сhem. Аbstr. 1992 116 41485u.
53.Hubele A., Eur. Appl. EP 457 726; Сhem. Аbstr. 1992 116 128953u.
54.Hubele A., Eur. Appl. EP 457 727; Сhem. Аbstr. 1992 116 106312g.
55.Watanabe J., Jpn. Patent 91.271.278; Сhem. Аbstr. 1992 116 151789d.
56.Zimmermann J., PCT Int. Appl. WO 9 509 851; Сhem. Аbstr. 1995 123 55915r.
57.Spychala J., Synth. Commun. 1997 27 (11) 1943.
58.Pfluger R.W., US Patent 4.542.216; Сhem. Аbstr.1986 104 88586v.
59.Zimmermann J., PCT Int. Appl. WO 9 509 853; Сhem. Аbstr. 1995 123 55914q.
60.Zimmermann J., PCT Int. Appl. WO 9 509 847; Сhem. Аbstr. 1995 123 313996t.
61.Aldrich P.E., PCT Int. Appl. WO 9 510 506; Сhem. Аbstr. 1995 123 31398v.
62.Zimmermann J., PCT Int. Appl. WO 9 50 9852; Сhem. Аbstr. 1995 123 169650f.
63.Kawamura Y., Sato J., Jpn. Patent 9 589 941; Сhem. Аbstr. 1995 123 143919a.
64.Lett R.M., PCT Int. Appl. WO 9 322 291; Сhem. Аbstr. 1994 120 217720r.
65.Shibata M., Sakatani H., Jpn. Patent 9 553 527; Сhem. Аbstr. 1995 122 290883s.
66.McChesney J.D., Gonzalez-Sierra M., Pharm. Res. 1985 (3) 146.
Избранные методы синтеза и модификации гетероциклов, том 1 |
137 |

67.Thomas A.P., PCT Int. Appl. WO 9 515 952; Сhem. Аbstr. 1995 123 286077k.
68.Machon Z., Cieplik J., Wieczorek Z., Pol. Patent 164 076 1995 123 83387p.
69.Ram V.J., Haque N., Nath M., Indian J. Chem., Sect. B 1993 32 754.
70.Sirakawa K., J. Pharm. Soc. Jpn. 1960 80 (11) 1542; РЖХим. 1961 19Ж197.
71.Burak K., Machon Z., Glowiak T.J., Crystallogr. Spectr. Res. 1992 22 (6) 665.
72.Basavaraja K.M., Vaidya V.P., Sangapure S., Ind. J. Heterocycl. Chem. 1992 2 (1) 35.
73.Zhong-E.L., Huaxue Xuebao 1995 53 (2) 193; Chem. Abstr. 1995 122 239649t.
74.Jian-Ping Z., Jun W., Huaxue Xuebao 1993 51 (10) 1030; Chem. Abstr. 1994 120
217578a.
75.Jian-Ping Z., Chem. Res. 1994 10 (3) 175; Chem. Abstr.1995 122 187529g.
76.Zhonge L., Daqing S., Tianlin X., et al., Org. Prep. Proced. Int. 1992 24 (3) 358.
77.Bano Q., Tiwari N., Giri S., Ind. J. Chem., Sect. B 1992 31 (7) 467.
78.Senga K., Ichiba M., Kanazawa H., J. Heterocycl. Chem. 1978 15 (4) 641.
79.Cacace F., Masironi R., Ann. Chim. (Rome) 1957 47 366.
80.Kokel B., J. Heterocycl. Chem. 1994 31 1185.
81.Соколова В.Н., Модникова Г.А., Новитский К., Хим.-фарм. журн. 1974
8 (1) 14.
82.Barker A.J., PCT Int. Appl. WO 9 633 977; Сhem. Аbstr. 1997 126 18887z.
83.Barker A.J., PCT Int. Appl. WO 9 633 978; Сhem. Аbstr. 1997 126 18888a.
84.Barker A.J., PCT Int. Appl. WO 9 633 979; Сhem. Аbstr. 1997 126 31371w.
85.Rewcastle G.W., Denny W.A., Bridges A.J., J. Med. Chem. 1995 38 (18) 3482.
86.Barker A.J., Патент Канады 2086969; Сhem. Аbstr. 1994 120 217715t.
87.Molina P., Lorenzo A., Aller E., Tetrahedron 1992 48 (22) 4601.
88.Wendelin W., Keimelmayr H., Goessnitzer E., Sci. Pharm. 1991 59 (4) 257.
89.Omar A., Mohsen M.E., Habib N.S., Adoulwafa O.M., Pharmazie 1977 32 758.
90.Михайловский А.Г., Вахрин М.И., ХГС 1991 (10) 1361.
91.Spirkova K., Stankovsky S., Collect. Czech. Chem. Commun. 1994 59 (1) 222.
92.Heinisch L., J.Prakt. Chem. 1987 329 (2) 290.
93.Bishop B.C., Marley H., McCullough K.J., et al., J. Chem. Soc. Perkin Trans. 1
1993 705.
94.Рудько А.П., Чернюк И.Н., Розум Ю.С., ЖОХ 1968 38 1275.
95.Eнгоян А.П., Переслени Е.М., Шейнкер Ю.Н. и др., ХГС 1976 (8) 1047.
96.Argay G., Kalman A., Petrovic D., Izv. Jugosl. Cent. Kristalogr 1976 2 133.
97.Ribar B., Makan T., Argay G., Cryst. Struct. Commun. 1981 10 (3) 979.
98.Reiter J., Toldy L., Ribar B., Lazar D., Cryst. Struct. Commun. 1981 10 (3) 967.
99.Ueda Y., Shirai S., Jpn. Patent 87.22.757; Сhem. Abstr. 1987 107 96583u.
100.Бабичев Ф.С., Ковтуненко В.А., Демченко А.М., Укр. хим. журн. 1986
52 (4) 398.
101.Овечкин П.Л., Игнатова Л.А., Гехман А.Е., Унковский Б., ХГС 1974 (3) 357.
102.Игнатова Л.А., Гехман А.Е., Овечкин П.Л., ХГС 1974 (3) 354.
103.Игнатова Л.А., Овечкин П.Л., Бранзбург М.З. и др., ХГС 1972 (8) 1037.
104.Бакланов М.В., Фролов А.Н., А. с. СССР 1641821, 1991.
105.Фролов А.Н., ЖОХ 1999 69 (8) 1303.
106.Фролов А.Н., Бакланов М.В., ЖОрХ 1991 27 (11) 2424.
107.Caroon J.M., Fisher L.E., Heterocycles 1991 32 (3) 459.
108.Kluge R., Schulz M., Pobisova M., Nuechter M., Chem. Ber. 1994 127 (9) 1723.
138 |
Серия монографий InterBioScreen |

109.Bradsher C.K., Litzinger E.F., Zinn M.F., J. Heterocycl. Chem. 1965 2 (4) 331.
110.Kuhla D.E., Watson H.A., J. Heterocycl. Chem. 1978 15 (10) 1149.
111.Демченко А.М., Чумаков В.А., Назаренко К.Г. и др., ХГС 1995 (5) 644.
112.Демченко А.М., Чумаков В.А., Красовский А.Н. и др., ХГС 1997 (6) 833.
113.Демченко А.М., Доповіді НАН України 2000 (4) 144.
114.Демченко А.М., Бова С.И., Чумаков В.А. и др., ЖОХ 2001 71 (11) 1857.
115.Штиль Н.А., Демченко А.М., Андрушко А.П. и др., ХГС 2001 (8) 1142.
116.Демченко А.М., Дисс. д-ра фарм. наук, Львов: ЛМУ, 2001.
117.Демченко А.М., Бухтиарова Т.А., Лозинский М.О., Патент Украины 26 886.
118.Тринус Ф.П., Ядловский О.Е., Михайлов С.А., Ліки України 2000 (1–2) 69.
119.Демченко А.М., Бухтиарова Т.А., Назаренко К.Г., Лозинский М.О.,
в кн. Азотистые гетероциклы и алкалоиды, под ред. Карцева В.Г.,
Толстикова Г.А., М.: Иридиум-Пресс, 2001, т. 1, с. 291.
Избранные методы синтеза и модификации гетероциклов, том 1 |
139 |

Циклокондесация ароматических и гетероароматических 1,2-диаминов
с α,β-непредельными карбонильными соединениями
Десенко С.М.1, Чебанов В.А.1, Колос Н.Н.2, Орлов В.Д.2
1НТК Институт монокристаллов 61001, Харьков, пр. Ленина, 60
2Харьковский национальный университет им. В.Н. Каразина 61077, Харьков, пл. Свободы, 4
1. Введение
К числу наиболее употребимых подходов к синтезу азагетероциклических систем относятся циклоконденсации на основе α,β-непредельных кетонов. Популярность данного типа гетероциклизаций вызвана высокой реакционной способностью бифункциональных еноновых систем при существенных различиях в электрофильных свойствах альтернативных реакционных центров. Как следствие – высокая региоселективность реакций выгодно отличает α,β-ненасыщенные кетоны, например, от их синтонных аналогов – β-дикарбонильных соединений, взаимодействие несимметричных представителей которых с бинуклеофильными частицами, чаще всего, приводит к образованию смеси региоизомерных гетероциклических продуктов реакции.
Особое место в ряду гетероциклизаций ненасыщенных карбонильных соединений занимают циклоконденсации на основе ароматических 1,2-диаминов. Эти реакции характеризуются многообразием направлений формирования нового гетероцикла, приводящим к различным, подчас неожиданным, структурам. Данная особенность связана с тем, что, во-первых, продукты "нормального" взаимодействия непредельного кетона с о-диамином – дигидрированные ди- и триазепиновые системы – весьма химически лабильны и способны к дальнейшим превращениям. Во-вторых, при наличии альтернативы, процесс образования семичленных гетероциклов термодинамически заметно менее выгоден, чем шести- и пятичленных структур (особенно гетороароматических). И как следствие, распространенными явлениями при взаимодействии о-диаминов с халконами являются наложение на процесс конденсации вторичных химических побочных реакций. Такая неоднозначность нашла свое отражение в литературных дискуссиях по строению образующихся продуктов: достаточно отметить, что некоторым из них последовательно приписывалось по три и более различных структур. В данном обзоре сделана попытка систематизации накопленных к настоящему времени в литературе данных и анализа закономерностей, касающихся реакций о-диаминов с халконами и их использования в синтезе гетероциклов.
140 |
Серия монографий InterBioScreen |
