
Карцев В.Г. - Избранные методы синтеза и модификации гетероциклов. Том 1 (2003)(ru)
.pdf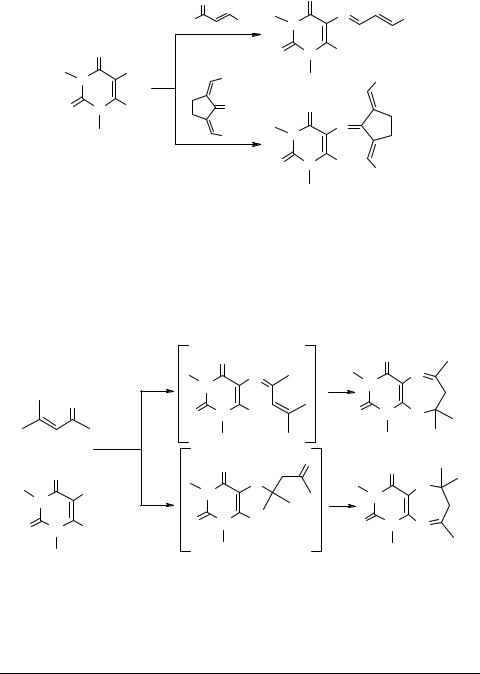
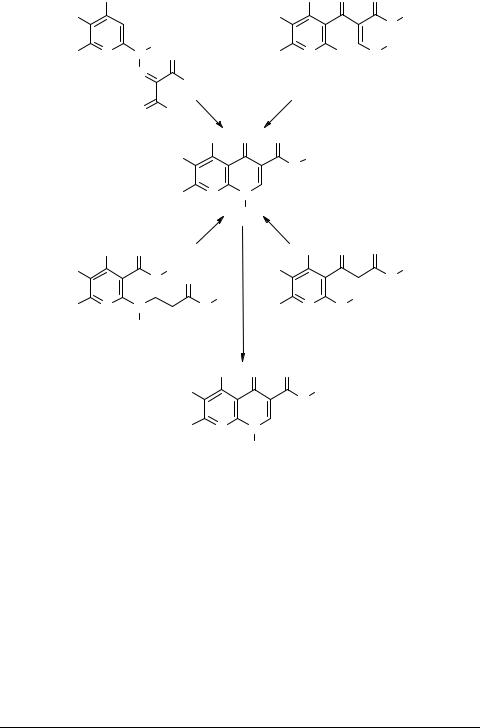
В то же времяпоказано, чтовзаимодействиекоричногоальдегидаидибензилиденциклопентанона с 1,3-диметил-5,6-диаминоурацилом уже не приводит к спиросоединениям, а останавливается на стадии образования азометина [29, 30]:
|
|
O |
O |
N |
|
|
H |
Ph |
N |
Ph |
|
|
|
|
|||
|
O |
O |
N |
NH2 |
|
N |
NH2 |
Ph |
|
|
Ph |
|
|
|
|||
O N NH2 |
O |
O |
N |
|
|
|
|
Ph |
N |
|
|
|
|
|
|
||
|
|
O |
N |
NH2 |
Ph |
|
|
|
|
|
|
Реакция окиси мезитила 47 с 1,3-диметил-5,6-диаминоурацилом в апротонных растворителях (бензол, толуол) также имеет иную, чем в случае халконов, направленность – продуктом взаимодействия является дигидродиазепин 51. Согласно данным французских авторов [74], строение диазепина соответствует структуре 50, в то время как данные РСА, проведенного авторами другой публикации [31] однозначно свидетельствуют в пользу структуры 51. Образованию на первой стадии реакции β-аддукта 49, а не азометина 48 способствует, по мнению авторов, большая поляризация С=С связи окиси мезитила по сравнению с халконами.
|
|
O |
|
|
O |
N |
|
|
|
N |
N |
|
N |
||
|
O |
|
|
|
|||
|
O N |
NH2 |
|
O N |
N |
||
|
|
|
|||||
+ |
толуол |
|
48 |
|
50 |
H |
|
|
|
|
|
|
|||
∆ |
O |
|
O |
O |
|
||
O |
H |
H |
|||||
|
|||||||
N |
NH2 |
N |
N |
|
N |
N |
|
|
|
|
|||||
|
|
|
|
|
|
||
O N NH2 |
O N NH2 |
|
O N |
N |
|||
47 |
|
|
49 |
|
51 |
|
|
|
|
|
|
|
|
||
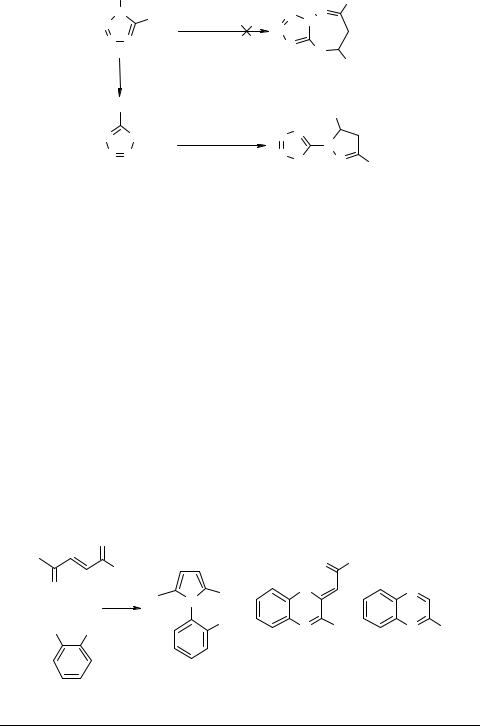
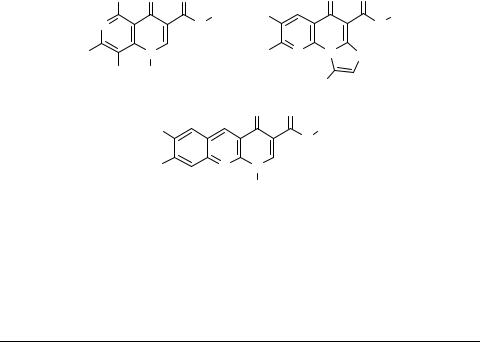
К образованию производных пиразолина 53 (но не дигидротетразолотриазепинов 52, как считалось ранее [22]) приводит конденсация халконов с диаминотетразолом [32]. Строение соединений 53 убедительно доказано методом РСА; механизм их образования включает перегруппировку по Димроту либо исходного диамина(какпоказанонасхеме), либоодногоизинтермедиатовциклоконденсации:
Избранные методы синтеза и модификации гетероциклов, том 1 |
161 |
NH2 |
|
|
N N |
Ar' |
|
|
N N |
NH2 |
ArCH=CHCOAr' |
N |
|
|
|
N N |
−H2O |
N |
|
|
|
|
N |
N |
|
|
|||
|
|
|
|
H Ar |
|
|
|
|
|
|
52 |
|
|
NHNH2 |
|
|
Ar |
|
|
|
N |
NH |
ArCH=CHCOAr' |
N N |
N |
|
|
N N |
−H2O |
N N |
|
|
||
N |
|
Ar' |
||||
|
|
|
H |
|
|
|
|
|
|
53 |
|
|
|
|
|
|
|
|
|
|
Ar = Ph, 4-MeOC6H4, 4-BrC6H4, 4-MeC6H4, 3,4-MeOC6H3
Ar' = Ph, 4-MeC6H4, 4-NO2C6H4, 4-BrC6H4
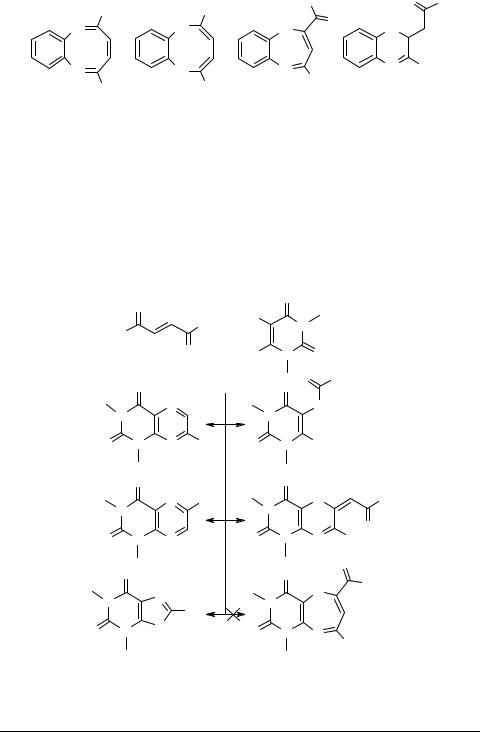
Большие сложности у исследователей вызвало изучение реакций о-диаминов
сдибензоилэтиленом 54. Полиэлектрофильность молекулы этого кетона, а также возможность протекания в реакционных смесях окислительно-восстановительных процессов делает потенциально возможным образование в таких реакциях разнообразных гетероциклических систем. Это приводит к существенным трудностям в установлении строения получаемых соединений и является источником достаточно многочисленных ошибок. Так, за 5 лет (1970–1975 гг.) опубликовано 5 противоречащих друг другу сообщений, посвященных реакции дибензоилэтилена
сФДА [75–79]. В этих работах для двух гетероциклических продуктов реакции поочередно предлагалось 5 возможных структур 55, 56, 58–60 и только строение третьего продукта конденсации – ранее описанного 2-фенилхиноксалина 57 – было установлено сразу. В конечном итоге удалось показать, что циклоконденсация может приводить к образованию производных пиррола и хиноксалина, и опровергнуть более ранние выводы о диазепиновом и диазоциновом строении соответствующих продуктов. Удалось также выделить интермедиат реакций образования соединений 56 и 57 – дигидрохиноксалин 61 [79].
|
|
O |
|
|
|
|
|
Ph |
|
Ph |
|
|
O |
Ph |
|
|
|
|
|
H |
|
|
|
O |
|
54 |
|
|
|
N |
|
|
N |
Ph |
N |
|
|||
|
|
Ph |
|
+ |
|
||
H2N |
+ |
NH2 |
|
NH+2 |
N |
N Ph |
|
|
|
|
Ph |
||||
|
|
|
55 |
|
56 |
|
57 |
162 |
Серия монографий InterBioScreen |
|
Ph |
H |
Ph |
H |
Ph |
O |
Ph |
|
O |
H |
|
||||
N |
|
|
|
||||
|
N |
|
N |
|
N |
|
|
N |
|
N |
|
N |
Ph |
N |
Ph |
|
Ph |
H |
Ph |
|
|
|
|
58 |
59 |
60 |
|
61 |
|
||
|
|
|
|
Доминирование того или иного направления взаимодействия ФДА с дибензоилэтиленом существенным образом зависит от условий реакции. Так, кипячение исходных веществ в уксусной кислоте приводит к образованию фенацилиденхиноксалина 56 (обычно преобладающий продукт реакции), триарилпиррола 55 и 2-фенилхиноксалина 57 [65]. При взаимодействии в кипящем метаноле в присутствии кислотного катализатора единственным гетероциклическим продуктом реакции оказывается 2-фенилхиноксалин. Селективный синтез дигидрохиноксалина 61 путем кратковременного кипячения в метаноле описан в [79, 80]. Данный метод носит достаточно общий характер и применим к синтезу дигидрохиноксалинов на основе замещенных ФДА и диароилэтиленов [80].
|
|
O |
|
|
|
O |
|
|
|
|
|
|
|
H2N |
|
|
|
|
|
|
Ar |
|
Ar + |
N |
|
|
|
||
|
|
|
|
15 |
|
||||
|
|
54 |
|
O |
H2N |
N |
O |
|
|
|
|
|
|
|
|
||||
|
|
O |
|
|
|
O O |
|
Ar |
|
|
|
N |
N |
|
|
N |
NH |
|
|
62 |
|
|
|
|
|
|
65 |
||
|
|
|
|
|
|
|
|
||
|
O |
N |
N |
Ar |
O |
N |
NH2 |
||
|
|
||||||||
|
|
O |
|
|
|
O |
H |
|
|
|
|
|
N |
Ar |
|
|
|
Ar |
|
|
|
N |
|
N |
N |
|
|||
63 |
|
|
|
|
|
Ar O |
66 |
||
|
|
|
|
|
|
|
|||
|
O |
N |
N |
|
O |
N |
N |
||
|
|
|
|||||||
|
|
O |
|
|
|
O |
|
O |
|
|
|
|
|
|
H |
Ar |
|
||
|
|
|
|
|
|
|
|
||
|
N |
|
N |
|
|
N |
N |
|
|
64 |
|
Ar |
|
|
|
67 |
|||
|
|
|
|
|
|||||
|
|
N |
|
|
|
|
|||
|
O |
N |
|
O |
N |
N |
|
|
|
|
H |
|
Ar |
|
|||||
|
|
|
|
|
|
|
|
|
|
Ar = 4-MeC6H4
Неоднозначность в определении строения продуктов возникает и при взаимодействии диароилэтиленов с гетероциклическими о-диаминами. Так, одному из
Избранные методы синтеза и модификации гетероциклов, том 1 |
163 |

продуктов конденсации 1,3-диметил-5,6-диаминоурацила 15 с 4,4'-диметилди- бензоилэтиленом первоначально была приписана диазепиновая структура 67 [81]. Однако, сопоставление спектральных характеристик этого соединения с характеристиками модельного бензоаннелированного аналога позволяет считать для этого соединения более вероятной пиримидопиразиновую структуру 66 [79]. Реакции образования соединения 66 сопутствует ряд параллельно идущих конденсационных процессов.
Таким образом, взаимодействие о-диаминов с непредельными 1,4-дикетонами приводит к образованию шестилибо пятичленных гетероциклов. Этот факт обусловлен большей термодинамической выгодностью процессов формирования этих циклов по сравнению с семичленными дигидродиазепиновыми системами.
Литература
1.Ekeley J., Wells P., Chem. Ber. 1905 2 (38) 2259.
2.Ried W., Stahlhofen P., Chem. Ber. 1957 90 815.
3.Мушкало Л.К., Хiм. збiрник КДУ 1957 (8) 133.
4.Железняков Л., Бижев А., Годишник на висшия химико-технологич. ин-т
(София) 1972 20 (1) 851.
5.Nawojski A., Nawrocka W., Rozniki Chem. 1977 51 (11) 2117.
6.Яременко Ф.Г., Орлов В.Д., Колос Н.Н., Лаврушин В.Ф., ХГС 1979 (6) 848.
7.Колос Н.Н., Дисс. канд. хим. наук, Харьков, 1982.
8.Орлов В.Д., Колос Н.Н., Яременко Ф.Г., Лаврушин В.Ф., ХГС 1980 (5) 697; Орлов В.Д., Колос Н.Н., Лаврушин В.Ф., ХГС 1980 (5) 697.
9.Svetlik J., Hanus V., Bella J., Liebigs Ann. Chem. 1989 91.
10.Toth G., Levai A., Szollosy A., Liebigs Ann. Chem. 1992 803.
11.Dawidar A.M., Metwally M.A., Abdel-Galil F.M., Berghot M.A.,
Indian J. Chem. B 1985 24 1124.
12.Augustin M., Jeschke P., Synthesis 1987 10 937.
13.Хват А.В., Дисс. канд. хим. наук, Харьков: ХГУ, 1996.
14.Hakiki A., Mossadak M., Mokhles M., et al., Tetrahedron 1995 51 (8) 2293.
15.Curtis N.F., Aust. J. Chem. 1986 39 (2) 239.
16.Douglas L., Scheibelin W., Hideg K., J. Chem. Res. Miniprint 1981 3 0838.
17.Ried W., Gruell F., Chem. Ber. 1963 96 130.
18.Kavali J.R., Badami B.V., Chem. Res. Synop. 2000 12 546.
19.Орлов В.Д., Кирога Х., Колос Н.Н., ХГС 1987 (3) 363.
20.Орлов В.Д., Кирога Х., Марруго А. и др., ХГС 1987 (11) 1563.
21.Орлов В.Д., Папиашвили И.З., Повстяной М.В. и др., ХГС 1983 (12) 1638.
22.Десенко С.М., Орлов В.Д., Гапоник П.Н., Каравай В.П., ХГС 1990 (11) 1533.
23.Десенко С.М., Дисс. канд. хим. наук, Харьков: ХГУ, 1986.
24.Insuasti B., Perez A., Valencia J., Quiroga J., J. Heterocycl. Chem. 1997 34
(5) 1555.
25.Орлов В.Д., Папиашвили И.З., ХГС 1985 (2) 241.
26.Орлов В.Д., Папиашвили И.З., Григоров П.А., ХГС 1985 (2) 241.
27.Insuasty B., Ramos M., Quiroga J., J. Heterocycl. Chem. 1994 31 (1) 61.
28.Insuasty B., Insuasty H., Quiroga J., J. Heterocycl. Chem. 1999 36 (4) 933.
164 |
Серия монографий InterBioScreen |

29.Колос Н.Н.,Чебанов В.А., Орлов В.Д., ХГС 1999 (9) 1230.
30.Колос Н.Н., Орлов В.Д., Чебанов В.А. и др., ХГС 1996 (7) 978.
31.Чебанов В.А., Дисс. канд. хим. наук, Харьков: ХНУ, 2000.
32.Колос Н.Н., Папонов Б.В., Орлов В.Д., Тез. междунар. конф. "Химия азотсодержащих гетероциклов", Харьков, 2000, с. 21.
33.Орлов В.Д., Яременко Ф.Г., Колос Н.Н., Лаврушин В.Ф., Докл. Акад. Наук УССР 1987 (3) 247.
34.Колос Н.Н., Орлов В.Д., Яременко Ф.Г. и др., ХГС 1995 (7) 950.
35.Колос Н.Н., Шишкин О.В., Орлов В.Д., Стручков Ю.Т., ХГС 1995 (5) 551.
36.Elderfild A., McCarthy B., J. Am. Chem. Soc. 1951 73 975.
37.Begland R.W., Harter D.R., Jones F.N., et al., J. Org. Chem. 1974 39 2341.
38.Абраменко В.Л., Сергиенко В.С., Гарновски А.Д., Порай-Кошиц М.А.,
ЖОХ 1990 60 (7) 1593.
39.Morales H., Bulbarela A., Contreras R., Heterocycles 1986 24 (1) 135.
40.Kaupp G., Pogodda U., Schmeyers J., Chem. Ber. 1994 127 (11) 2249.
41.Dai-Il J., Tae-Won C., Yun-Young K., et al., Synth. Commun. 1999 29 (11) 1941.
42.Fischer J.W., Atkins R.L., Nissan R.A., et al., J. Heterocycl. Chem. 1986 23 1519.
43.Зеленин К.Н., Украинцев И.В., Алексеев В.В., ХГС 1998 3 363.
44.Quiroga J., Insuasty B., Abonia R., Baumann W., J. Heterocycl. Chem. 1994 31
(4)813.
45.Shanthan R.P., Venkataratnam R.V., Indian J. Chem. B 1992 31 (11) 733.
46.Insuasty B., Abonia R., Quiroga J., Meier H., J. Heterocycl. Chem. 1993 30 (1) 229.
47.Reddy A. Pandu Randa, Veeranagaiah V., Indian J. Chem. B 1986 25 527.
48.Balakrishna M.S., Kaboudin B., Terahedron Lett. 2001 42 (6) 1127.
49.Reddi P.S., Patham C.V., Rao S.N.V., Indian J. Chem. 1972 10 982.
50.Herbert J., Suschitky H., J. Chem. Soc. Perkin Trans. 1 1974 23 2657.
51.Папиашвили И.З., Дисс. канд. хим. наук, Харьков: ХГУ, 1983.
52.Орлов В.Д., Десенко С.М., ХГС 1985 (12) 1673.
53.Begland R.W., Harter D.R., Jones F.N., J. Org. Chem. 1974 39 2341.
54.Кери Ф., Сандберг Р., Углубленный курс органической химии. Реакции и синтезы, М.: Химия, 1981, c. 45.
55.Zhong W., Zhang Y., Chen X., J. Chem. Res. Synop. 2000 11 532.
56.Орлов В.Д., Колос Н.Н., Десенко С.М., Лаврушин В.Ф., ХГС 1982 (6) 830.
57.Орлов В.Д., Десенко С.М., Пивненко Н.С., ХГС 1987 (4) 523.
58.Xu J., Chen L., Heteroat. Chem. 2000 11 (2) 158.
59.Колос Н.Н., Чебанов В.А., Орлов В.Д., Фізіологічно активні речовини 2000 29
(1)14.
60.Aversa M.C., Gianetto P., Ferlazzo A., Bruno G., J. Chem. Soc. Perkin Trans 2 1986 1533.
61.Aversa M.C., Ferlazzo A., Gianetto P., Kohneke F.H., Synthesis 1986 3 230.
62.Chimirri A., Grasso S., Ottana R., et al., J. Heterocycl. Chem. 1990 27 (4) 371.
63.Xu J., Jin S., Xing Q., Phosphorus, Sulfur Silicon Relat. Elem. 1998 141 57.
64.Insuasty B., Abonia R., Quiroga J., et al., Eur. J. Org. Chem. 2000 10 1973.
65.Орлов В.Д., Колос Н.Н., Золотарев Б.М., ХГС 1983 (3) 390.
66.Insuasty B., Ramos M., Moreno R., et al., J. Heterocycl. Chem. 1995 32 (4) 1229.
67.Колос Н.Н., Орлов В.Д., Ариса Д. и др., ХГС 1996 (1) 87.
68.Barltrop J.A., Richards C.G., Russel D.M., Ryback G., J. Chem. Soc. 1959 3 132.
Избранные методы синтеза и модификации гетероциклов, том 1 |
165 |

69.Азотсодержащие гетероциклы, под ред. Кочеткова Н.К., М.: Химия, 1982,
с. 752.
70.Десенко С.М., Орлов В.Д., ХГС 1989 (8) 1071.
71.Десенко С.М., Орлов В.Д., Липсон В.В., Эстрада Х., ХГС 1991 (9) 1215.
72.Орлов В.Д., Десенко С.М., Кругленко В.П. и др., ХГС 1986 (8) 1136.
73.Колос Н.Н., Орлов В.Д., Папонов Б.В. и др., ХГС 1999 (10) 1388.
74.Quan D.Q., Gaujolle R., Dang T.B.T., C. R. Acad. Sci. C 1972 274 885.
75.Шевчук М.И., Толочко А.Ф., Домбровский А.В., ЖОХ 1970 6 (5) 1108.
76.Bindra A., Le Goff E., Tetrahedron Lett. 1974 (16) 1523.
77.Trattner R.B., Perlmutter H.D., J. Heterocycl. Chem. 1974 11 (1) 89.
78.Perlmutter H.D., Trattner R.B., J. Heterocycl. Chem. 1974 11 (5) 847.
79.Bass R.G., Crichton D.D., Mets H.K., Johnson A.F., Tetrahedron Lett. 1974 15 (25) 2073.
80.Орлов В.Д., Десенко С.М., Инсуасти Б. и др., ХГС 1987 (4) 523.
81.Wawzonek S., J. Org. Chem. 1976 46 (20) 310.
166 |
Серия монографий InterBioScreen |
Нафтиридины: Химия и биологическая активность
Дяченко В.Д., Роман С.В.
Луганский государственный педагогический университет им. Тараса Шевченко 91011, Луганск, ул. Оборонная, 2
Введение
Повышенный интерес к нафтиридинам (пиридопиридинам) в последние два десятилетия вызван широчайшим спектром биологической активности производных этого класса. В большинстве случаев стимулом для синтетических изысканий в этой области являлся поиск новых веществ, перспективных для терапевтического использования, о чем указано в обзорных работах [1–3]. Помимо этого, в литературе последних лет появилось множество сведений об использовании нафтиридиновых производных в сельском хозяйстве, как средств защиты растений, и в ветеринарии, как антибиотиков для млекопитающих. Большое число соединений этого ряда заявлено в качестве гербицидов, инсектицидов, нематоцидов, регуляторов роста растений, фунгицидов и бактерицидов нового типа.
Настоящий обзор охватывает данные литературы по синтезу нафтиридинов за последние 20 лет. Материалы сгруппированы в соответствии с типами использованных в синтезе реакций, при этом указаны важнейшие виды биологической активности, проявляемой полученными соединениями.
1. Метод Скраупа
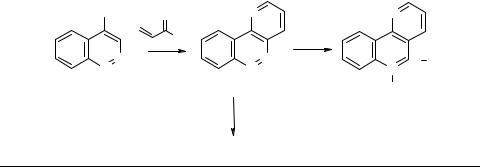
Метод Скраупа [4], имеющий ключевое значение в химии нафтиридинов, и его современные модификации [2] основаны на циклоконденсации аминопиридинов с α,β-непредельными альдегидами и кетонами. Распространение этого метода на синтез конденсированных нафтиридиновых систем привело к получению веществ с пестицидной активностью. Так, из 4-амино(изо)хинолинов 1a, b получены соответствующие бензо[h][1,5]- (2a, Z = CH, Y = N) и бензо[h][1,6]нафтиридины (2b, Z = N, Y = CH) [5]. Их трансформация в четвертичные соли 3, 4 [5] и бензо[h]- пирролонафтиридины 5, 6 [6, 7] подробно освещена нами в обзоре [2]. Соединения 2–6 представляют интерес как эффективные фунгициды и бактерициды [5–7].
NH2 |
O |
N |
|
N |
|
|
|
H |
RX |
|
|
|
|
|
|
|
|
Y |
|
Z |
Y |
+ |
X |
Z |
|
|
N |
||
1a, b |
|
2a, b |
4 |
R |
|
|
|
RX |
|
|
|
Избранные методы синтеза и модификации гетероциклов, том 1 |
|
167 |
|||

|
|
|
RX |
|
|
|
|
|
|
O |
X N |
|
|
|
O |
N |
|
Ph |
|
N |
|
OEt |
|
N |
|
|
|
N |
R1 |
||
|
R1 |
|
+ |
|
|||
|
|
N |
|
|
|||
|
|
R |
|
R |
|
R |
|
|
|
|
|
|
|
||
|
5 |
|
3 |
|
|
6 |
|
3, 4 R = Me, CH2CH=CH2, CH2Ph, 2,4-NO2C6H3, CH2CO2Et, CH2COPh;
X = галоген;
5 R, R1 = H, CO2Et или R = COMe, R1 = H;
6R, R1 = H, CO2Me, CO2Et, COMe
2.Циклизация 1,2-дизамещенных производных пиридинового ряда
Длясинтезабактерицидов общей формулы 7 используют различные способы [2, 8]:
1.Реакция Гоулда–Джекобса с циклизацией диэфиров N-(2-пиридил)амино- метилиденмалоновых кислот 8 в кипящем теплоносителе – даутерме А. Этим методом был получен в том числе и ряд производных, обладающих нематоцидным действием, наиболее сильно выраженным по отношению к Filariidae [9].
2.Конденсация по Дикману эфиров 2-[N-(2-алкоксикарбонил)-амино]никоти- новых кислот 9 в условиях основного катализа (NaH или t-BuOK) с последующим дегидрированием образующихся интермедиатов хлоранилом.
3.Внутримолекулярное циклодегидрохлорирование эфиров.
4.2-(2-хлорникотиноил)-3-аминоакриловых кислот 10 в присутствии основания
(NaH, t-BuOK, K2CO3, NaHCO3, Bu4N+F−) в среде органического растворителя при 80–180°С.
5.Циклизация эфиров 2-аминоникотиноилуксусных кислот 11 под действием ортомуравьиного эфира в уксусном ангидриде, диметил- и динеопентил-
ацеталей в среде ДМФА, комплекса Me2NCHO Me2SO4 в присутствии MeONa, а также реактива Вильсмейера (POCl3/ДМФА).
Превращение субстратов 7 в производные 12, обладающие бактерицидной активностью [10–41] может включать снятие карбоксильной защиты и реакцию замещения галогена или арилсульфонильной группы в положении 7 нафтиридинового цикла на моно-, бициклическую аминогруппу или, что реже, содержащую серу функцию [10].
168 |
Серия монографий InterBioScreen |
R3
R4
R3
R4
R2 |
|
|
|
|
R2 |
O |
O |
|
|
|
|
R3 |
|
|
O R1 |
N |
N R O |
|
R4 |
N |
Cl |
N R |
|
|
C |
|
|
|
|
|
H |
|
OEt |
|
|
|
|
||
8 |
|
|
|
10 |
|
||
|
|
|
|
|
|
||
|
O OEt |
|
|
|
|
|
|
|
|
|
R2 |
O O |
|
|
|
|
|
R3 |
|
|
O R1 |
|
|
|
|
R4 |
N |
N |
|
|
|
|
|
|
7 |
R |
|
|
|
R2 |
O |
|
|
|
R2 |
O |
O |
|
|
O R1O |
|
R3 |
|
|
O R1 |
N |
N |
|
O R1 |
R4 |
N |
N R |
|
|
R |
|
|
|
|
H |
|
|
|
R5H |
−R4 |
|
|
|
|
9 |
|
|
|
11 |
|
||
|
|
|
|
|
|
||
|
|
|
R2 |
O |
O |
|
|
|
|
R3 |
|
|
O R1 |
|
|
|
|
R5 |
N |
N |
|
|
|
|
|
|
|
R |
|
|
|
12
7−12: R = алкил, циклоалкил, алкенил, алкинил, галогеналкил, гидроксиалкил, алкоксил, аминогруппа, арил; R1 = Н, незамещенный или замещенный алкил, циклоалкил, фенил, катион металла, остаток β-лактамного антибиотика − производного цефалоспорановой или пенициллановой кислот, (5-метил-2-оксо-1,3-диоксол-4- ил)метил; R2 = H, галоген, аминогруппа, OH, алкокси, SH, алкилтио, арилтио, незамещенный или замещенный алкил, алкенил, CF3, алкинил, CN, NO2; R3 = H, галоген, NO2, CH3, CF3, CCl3; R4 = галоген, арилсульфонил; R5 = остаток пирролидина, пиперидина, пиперазина, морфолина, тиоморфолина, азетидина, пиррола, имидазола, азабициклоалкана, диазабициклоалкана, диазаспироалкана, S(O)nR6 (где R6 = Н, алкил, алкенил, аминоалкил, арилалкил и др., n = 0–2)
Соединения 12 и соли при низкой токсичности активны против широкого спектра грамположительных (например, Staphylococcus aureus) и грамотрица-
тельных бактерий (Escherichia coli, Pseudomonas aeruginosa и др.), особенно
Enterobakteriaceen, в том числе штаммов, резистентных к другим антибиотикам. Противомикробная активность изучалась in vitro и in vivo.
Избранные методы синтеза и модификации гетероциклов, том 1 |
169 |
На основе нафтиридинов 12 и хинолонкарбоновых кислот разработаны лекарственные составы перорального применения (торговые названия − темафлоксацин, тозуфлоксацин, ципрофлоксацин, офлоксацин, норфлоксацин, дифлоксацин, енрофлоксацин, данофлоксацин и др.) [11], широко используемые для профилактики и химиотерапии инфекционных [10–19], в том числе респираторных [20] заболеваний. Для человека суточные дозы этих препаратов обычно составляют 1–100 мг/кг. Предложенные лекарственные составы не вызывают характерную для нафтиридонов псевдоаллергическую реакцию, связанную с понижением артериального давления. Указанные побочные явления минимальны и для препарата BMY 40062 (12, R = t-Bu, R1 = R2 = H, R3 = F, R5 = (1R,4R)-2,5-диазабицикло[2,2,1]гептан- 2-ил) [21] и его аналогов [22], выбранных для доклинических испытаний.
Производные 1,8-нафтиридонкарбоновых кислот 12 пригодны для применения в животноводстве в качестве добавок к кормам [12, 18, 19, 23–29] и питьевой воде животных [19], как консерванты органических и неорганических материалов − кожи, древесины, бумаги, волокон, полимеров, смазочных масел, красителей, продтоваров и воды [12, 13, 19, 27–34]. В сельском хозяйстве их используют в качестве активных ингредиентов средств борьбы с болезнями растений, вызываемыми фитопатогенными бактериями [10, 13, 35–37]. Эффективное фунгицидное действие нафтиридинов 12 [30, 38], связанное с ингибированием ДНК-гидразы, позволяет применять их для дезактивации зараженных микоплазмой культур клеток [39–41].
В качестве бактерицидов заявлены также производные 13 1,6-нафтиридон- карбоновой кислоты [42], тиазоло[3,2-a]- (14) [43] и бензо[b][1,8]нафтиридинов
(15) [44–48].
R2 |
O O |
|
|
O |
O |
N |
|
O R1 |
F |
|
O R1 |
R3 |
N |
|
R2 |
N N |
S |
R4 |
R |
|
|
R 14 |
|
13 |
|
|
|
|
|
|
|
|
O |
O |
|
|
F |
|
|
O R1 |
|
|
R2 |
N |
N |
|
|
|
|
15 |
R |
|
|
|
|
|
|
|
13:R = OH, галоген, алкокси, алкил, циклоалкил, амингруппа, арил; R1 = Н, алкил,
(5-метил-2-оксо-1,3-диоксол-4-ил)метил; R2 = Н, галоген, NH2, CH3, CF3;
R3 = гетероциклический радикал; R4 = Н, OH, галоген, алкокси, алкил, NH2, CN, NO2
14:R = Н, галогенметил, метоксиметил; R1 = Н, незамещенный или замещенный алкил; R2 = бициклический гетероциклический радикал
15:R = Н, алкил, циклоалкил, замещенная аминогруппа, N(CH3)CHO и др.; R1 = Н, алкил; R2 = галоген, остаток пиперазина или замещенного пиперазина
170 |
Серия монографий InterBioScreen |
