
Карцев В.Г. - Избранные методы синтеза и модификации гетероциклов. Том 1 (2003)(ru)
.pdf
H |
O |
H |
O |
|
|
||
N O |
H + |
N O |
H |
|
|
||
Ac |
|
Ac |
|
97 (10%) |
|
98 (90%) |
|
Следует отметить, что в других условиях процесс протекает иначе и, помимо пентациклов 97 и 98, из оксиндола 96 образуются и продукты 99–102:
|
|
|
|
OH |
|
|
|
O |
|
|
|
|
|
|
H |
|
|
|
ZnCl2 |
|
|
|
|
H |
|
|
96 |
+ 98 |
+ |
O + |
|
|
|
O + |
|
97 |
|
N |
||||||
|
|
|
|
N |
|
|
||
|
|
|
|
99 Ac |
|
100 |
Ac |
|
|
|
O |
|
|
|
|
|
|
|
H |
|
|
|
|
H |
O |
|
|
H |
|
|
|
|
|
|
|
+ |
|
N |
O |
+ |
|
|
|
H |
|
|
|
|
|
N |
|
O |
|
|
101 |
Ac |
|
|
102 |
Ac |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
||
Ряд работ посвящен замыканию пиридиновых циклов, аннелированных с индольным. Так, при конденсации 4,6-дизамещенного оксиндола 103 с 2,3-дифенил- 4,6-диметоксииндолом 104 в присутствии хлорокиси фосфора получено пентациклическое соединение 105 [33].
|
|
|
|
|
|
|
OMe |
|
|
|
|
|
|
|
Ph |
|
R |
|
OMe |
Ph |
|
|
|
|
|
|
|
|
MeO |
N Ph |
|
|
O |
+ |
|
|
POCl3 |
||
|
|
|
|
|
|||
R |
|
N |
Ph |
N |
|
||
N |
MeO |
|
ДМФА |
|
|||
|
H |
|
|
H |
|
|
R |
|
103 |
|
104 |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
R |
105 |
Избранные методы синтеза и модификации гетероциклов, том 1 |
111 |
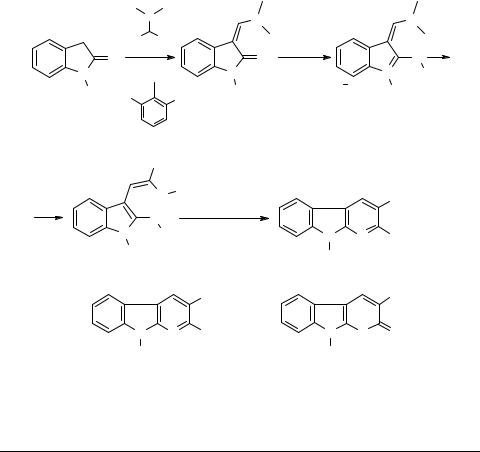
Данная реакция осуществляется за счет активации амидной функции оксиндола путем трансформации его в хлорокисный комплекс, обладающий значительно большей электрофильностью (о синтезе и свойствах таких комплексов см. [34]). Известны и другие способы активации амидов – превращение их в соответствующие алкоксипроизводные, например, амидацетали и их аналоги. Этот подход широко используется в химии гетероциклических соединений [35]. Так, описано взаимодействие оксиндола 106, его N-этил- и N-(2,6-дихлорфенил)- производных 107, 108 с диэтилацеталем диметилформамида 8 с образованием 3-диметиламинометиленоксиндолов 109, активация енаминоамидной функции которого осуществлена путем алкилирования с помощью диметилсульфата или фторбората триэтилоксония. Образующиеся при этом диметилсульфатные или фторборатные комплексы 110 легко реагирует с соединениями, имеющими активное метиленовое звено. Полученные винильные производные 111 под воздействием различных реагентов трансформируются в α-карболины 112–114
[36–41].
В качестве примера можно привести реакции с использованием производных циануксусной кислоты:
|
|
N |
|
|
N |
Me2SO4 |
|
N |
|
|
EtO |
|
OEt |
|
|
|
|
|
|
|
8 |
|
O |
или |
|
O |
|
||
|
O |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|||
N |
|
|
|
|
N |
Et3O BF4 |
|
+N |
R1 |
R |
Cl |
|
Cl |
109 R |
X |
110 |
R |
|
|
106 R = H |
108 R = |
|
|
|
|
|
R1 = Me, Et |
|
|
107 R = Et |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
X = MeSO4 , BF4 |
||
|
|
CN |
|
|
|
|
|
|
|
|
|
|
O R2 |
NH3 /EtOH |
|
|
CONH2 |
||
|
|
|
|
|
|
|
|||
|
N |
O |
для R = R1 = Et |
|
|
|
+ |
||
|
|
R1 |
N |
N |
NH2 |
|
|||
111 |
|
|
R2 = CO2Et |
|
|||||
R |
|
|
|
|
112 Et |
|
|
|
|
R1 = CN, CO2Alk, CONH2 |
|
|
|
|
|
||||
+ |
|
|
|
|
CO2Et |
|
|
CN |
|
|
|
|
|
+ |
N |
N |
O |
|
|
|
N |
|
N |
|
NH2 |
|
|||
|
Et |
|
|
|
Et |
H |
|
|
|
|
|
|
|
|
|
|
|||
|
113 |
|
|
|
114 |
|
|
|
|
Рассмотренные выше аннелированные индолы использовались для синтеза более сложных гетероциклов. Так в работе [38] показано, что соединение 114 при
112 |
Серия монографий InterBioScreen |
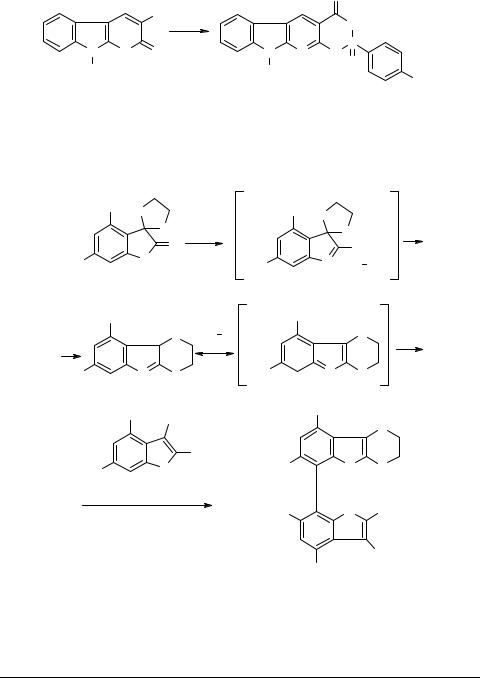
обработке реагентом Лавессона гладко превращается в 1,3,2-оксазафосфорино- карболин 115.
|
|
S |
|
|
CN RL |
|
NH |
|
|
|
|
N N O |
N N O |
P |
|
Et |
H |
Et |
S |
|
OMe |
||
114 |
|
115 |
|
|
|
||
Возвращаясь к работе [35], отметим, что в ней показана возможность синтеза на основе оксиндолов и других конденсированных индолов, например, дитиано- [2,3-b]индолов 116:
|
OMe S |
S |
POCl3 |
|
OMe S |
|
|
|
|
|
|
S |
|
||
MeO |
N |
|
O |
|
+ |
OPOCl2 |
|
|
|
MeO |
N |
Cl |
|
||
H |
|
|
|
||||
|
OMe |
|
|
|
OMe |
S |
|
|
|
+ |
S Cl |
|
|
|
|
MeO |
N |
|
S |
MeO |
+ |
S |
|
|
N |
|
|||||
|
OMe |
Ph |
|
OMe |
|
|
|
|
|
|
|
S |
|||
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
Ph |
MeO |
N |
S |
|
MeO |
|
N |
|
||||
|
|
H |
|
|
|
H |
|
|
104 |
|
|
|
|
H |
|
|
|
|
|
MeO |
|
Ph |
|
|
|
|
|
|
N |
||
Ph
OMe
116
Недавно открыт новый класс анальгетиков, противовоспалительных средств и антиартритных агентов в ряду производных оксиндола [42]. Наиболее активные соединения в этой группе содержат в качестве заместителей в бензольном кольце
Избранные методы синтеза и модификации гетероциклов, том 1 |
113 |
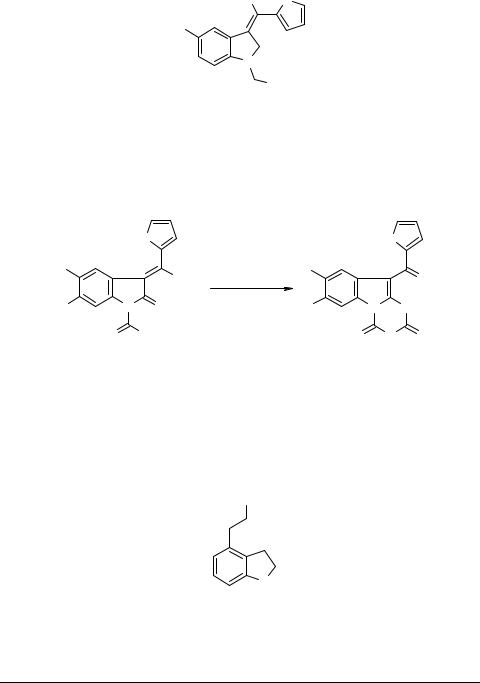
галогены, а одно из таких веществ имеет уже патентованное название как лекарственный препарат – тенидап 117.
HO S
Cl
 O
O
N
O NH2
NH2
117
В процессе поиска новых высокоактивных веществ в ряду производных оксиндола в [43] на основе "тенидапоподобных" соединений был осуществлен синтез представителя конденсированной гетероциклической системы, 1,3,5-окса- диазино[3,2-a]индола 118, представляющего собой циклический карбамат.
|
S |
|
|
S |
|
Cl |
OH |
ClCONCO |
Cl |
|
O |
|
|
|
|||
F |
N O |
Et3N, CH2Cl2 |
F |
N |
O |
|
|||||
O |
NH2 |
|
O |
N |
O |
|
|
|
|
H |
|
|
|
|
118 |
|
|
2.3 Замыкание семичленных циклов
В качестве исходного соединения в данном исследовании выбран ропинирол 119, лекарственный препарат, предназначенный для лечения паркинсонизма и принадлежащий по структуре к ряду производных оксиндола.
OTs
 O
O
N
H
119
В реакции ропинирола с основаниями Шиффа образуется смесь производных азепино[3,4,5-cd]индола 120 и 3-R'-метилен-4-β-тозилоксиэтилиндола 121 [44].
114 |
Серия монографий InterBioScreen |
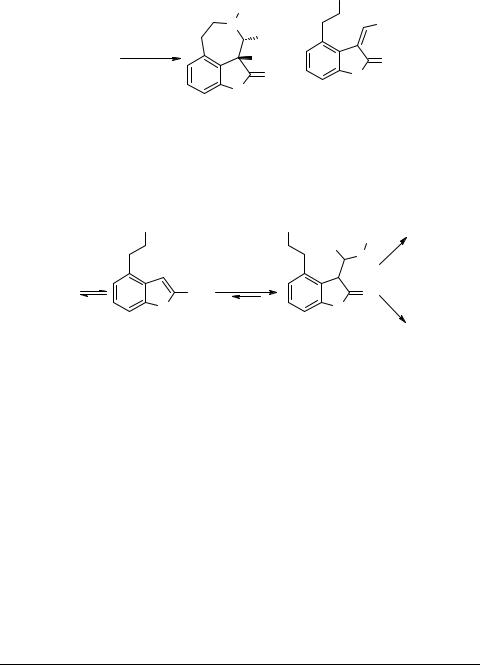
Трициклы 120 образуются в тех случаях, когда R – первичная алкильная или электроноизбыточная арильная группы.
|
|
R |
OTs |
|
|
|
R1 |
||
|
|
N |
||
|
RN=CNR1 |
R1 |
|
|
119 |
H + |
O |
||
|
||||
|
|
O |
N |
|
|
|
N |
H |
|
|
|
H |
121 |
|
|
|
120 |
Предполагаемый авторами [44] механизм циклизации можно представить следующим образом:
|
OTs |
OTs |
|
120 |
|
|
|
R1 |
R |
|
|
|
N |
|
|
|
|
|
|
|
|
RN=CNR1 |
|
H |
|
|
|
|
|
119 |
OH |
|
N |
O |
|
N |
|
|
|
|
H |
|
H |
121 |
|
|
|
|
Когда R или R' имеют разветвленные боковые цепи, стерические затруднения в интермедиате приводят к тому, что процесс сдвигается в сторону образования оксиндола 121.
В заключение можно констатировать, что использование индоксила и оксиндола для создания разнообразных конденсированных гетероциклов является плодотворным и перспективным направлением. Синтетический потенциал производных индоксила и оксиндола в плане гетероциклизации далеко не исчерпан, и их использование остается привлекательным подходом для построения новых полициклических индольных систем, представляя значительный интерес для синтетической и теоретической органической химии.
Литература
1.Машковский М.Д., Лекарственные средства, Харьков: Торсинг, 1997.
2.Граник В.Г., Лекарства: Фармакологический, биохимический и химический аспекты, М.: Вузовская книга, 2001.
3.Рябова С.Ю., Граник В.Г., Хим.-фарм. журн. 1995 (12) 3.
Избранные методы синтеза и модификации гетероциклов, том 1 |
115 |

4.Граник В.Г., Граевская И.П., Рябова С.Ю., Хим.-фарм. журн. 1997 (12) 20.
5.Ryabova S.Yu., Granik V.G., Mendeleev Commun. 1995 (3) 107.
6.Рябова С.Ю., Трофимкин Ю.И., Алексеева Л.М. и др., Хим.-фарм. журн. 1995
(9)22.
7.Рябова С.Ю., Трофимкин Ю.И., Граник В.Г., Хим.-фарм. журн. 1995 (5) 43.
8.Kawasaki T., Tang C.-Y., Nakanishi N., et al., J. Chem. Soc. Perkin Trans. 1 1999
(3)327.
9.Kawasaki T., Terashima R., Sakaguchi K.-E., et al., Tetrahedron Lett. 1996 37
(42)7525.
10.Kawasaki T., Masuda K., Baba Y., et al., J. Chem. Soc. Perkin Trans. 1 1996
(7)729.
11.Kawasaki T., Tang C.-Y., Koizumi E., et al., Heterocycles 1998 48 (5) 975.
12.Вележева В.С., Лепешкин А.Ю., Федотова А.Ю. и др., Хим.-фарм. журн. 1996
(10)37.
13.Вележева В.С., Томчин А.Б., Мельман А.И., Марышева В.В., ЖОрХ 1998 34
(4)604.
14.Tietze L.F., Chem. Rev. 1996 96 115.
15.Merour J.-Y., Mamai A., Malapel B., Gadonneix P., Tetrahedron 1997 53 (3) 987.
16.Cuifolini M.A., Byrne N.E., J. Am. Chem. Soc. 1991 113 8016.
17.Davion Y., Joseph B., Merour J.-Y., Synlett. 1998 1051.
18.Азимов В.А., Трофимкин Ю.И., Рябова С.Ю. и др., Хим.-фарм. журн. 1995
(9)36.
19.Merour J.-Y., Merour A., Synthesis 1994 767.
20.Вележева В.С., Гунар В.И., Балякина М.В., Суворов Н.Н., ХГС 1978 (7) 939.
21.Рябова С.Ю., Алексеева Л.М., Граник В.Г., ХГС 2000 (3) 362.
22.Рябова С.Ю., Алексеева Л.М., Лисица Е.А. и др., Изв. АН, Сер. хим. 2001
(8)1379.
23.Рябова С.Ю., Тугушева Н.З., Алексеева Л.М., Граник В.Г., ХГС 1996 (7) 42.
24.Тугушева Н.З., Рябова С.Ю., Соловьева Н.П., Граник В.Г., ХГС 1998 (2) 241.
25.Тугушева Н.З., Рябова С.Ю., Соловьева Н.П., Граник В.Г., ХГС 2002, в печати.
26.Тугушева Н.З., Рябова С.Ю., Соловьева Н.П. и др., ХГС 2001 (7) 962.
27.Popp E.D., J. Heterocycl. Chem. 1969 6 125.
28.Ланцетти Н.А., Рябова С.Ю., Алексеева Л.М. и др., Изв. АН, Сер. хим. 2002 (3), в печати.
29.Santos P.F., Almeida P.S., Lobo A.M., Prabhakar S., Heterocycles 2001 55
(6)1029.
30.Pei X.-F., Bi S., Heterocycles 1996 39 (1) 357.
31.Villalobos A., Butler T.W., Chapin D.S., et al., J. Med. Chem. 1995 38 (15) 2802.
32.Desimoni G., Faita G., Righetti P.P., Tacconi G., Tetrahedron 1996 52 (36) 12009.
33.Black D.St.C., Ivory A.J., Kumar N., Tetrahedron 1996 52 (20) 7003.
34.Kantlehner W., in Iminium Salts in Organic Chemistry, Bohme H., Viehe H.G., Eds., New York: Wiley, 1979, vol. 2, p. 6.
35.Граник В.Г., ХГС 1992 (6) 762.
36.Головко Т.В., Соловьева Н.П., Граник В.Г., Хим.-фарм. журн. 1994 (5) 48.
37.Golovko T.V., Solov'eva N.P., Granik V.G., Mendeleev Commun. 1995 (6) 226.
38.Головко Т.В., Соловьева Н.П., Граник В.Г., Хим.-фарм. журн. 1996 (10) 32.
116 |
Серия монографий InterBioScreen |

39.Исакович И.П., Азимов В.А., Рябова С.Ю. и др., Хим.-фарм. журн. 1995
(2)22.
40.Исакович И.П., Рябова С.Ю., Алексеева Л.М., Граник В.Г., Хим.-фарм. журн.
1995 (12) 44.
41.Исакович И.П., Рябова С.Ю., Алексеева Л.М., Граник В.Г., Хим.-фарм. журн.
1996 (9) 35.
42.Porcs-Makkay M., Simig G., J. Heterocycl. Chem. 2001 38 (2) 451.
43.Robinson R.P., Reiter L.A., Barth W.B., et al., J. Med. Chem. 1996 39 (1) 10.
44.Hayes J.F., Hayler J.D., Walsgrove T.C., Wicks C., J. Heterocycl. Chem. 1996 33
(1)209.
Избранные методы синтеза и модификации гетероциклов, том 1 |
117 |
Синтез и свойства гетероциклических N-ариламидинов
Демченко А.М.1, Лозинский М.О.2
1Черниговский педагогический университет им. Т.Г. Шевченко 14038, Чернигов, ул. Гетьмана Полуботка, 53 2Институт органической химии НАН Украины 02094, Киев, ул. Мурманская, 5
Введение
Со времени синтеза 2-аминопиридина А.Е. Чичибабиным [1] химия гетероциклических амидинов интенсивно развивалась. Среди производных соединений этого класса было найдено и внедрено в практическую деятельность много лекарственных средств. Несмотря на это, N-арилзамещенные гетероциклические амидины, по нашему мнению, до настоящего времени все еще мало изучены. В представленном обзоре систематизированы методы синтеза и химические свойства N-арилзаме- щенных гетероциклических амидинов.
Методы синтеза N-арилзамещенных гетероциклических амидинов
Производные 2-анилинопиридина 2 с хорошими выходами получены [2, 3] при взаимодействии 2-галогенпиридинов 1 с замещенными анилинами при кипячении последних в высококипящих растворителях. Для повышения выхода продуктов конденсации были использованы в качестве катализатора ZnCl2 и твердый К2СО3.
R |
ArNH2 |
R |
|
R1 |
|
N Hal |
|
|
|
N N |
|
|
|
H |
1 2
Hal = Br, Cl;
R = H, CO2H; R1 = Hal, Alk, OAlk
При пятичасовом нагревании эквимолярных количеств 2-гидроксипиридина и анилина в автоклаве при 350°С и давлении 150 атм был получен 2-анилино- пиридин с выходом 97% [4].
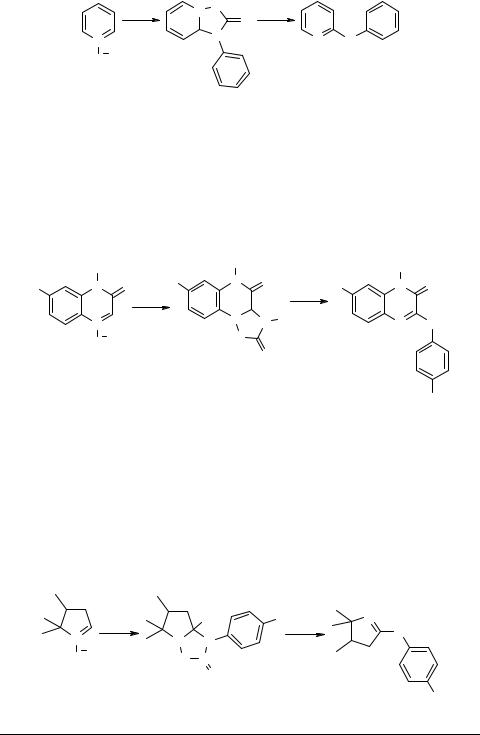
Конденсацией N-окиси пиридина 3 с фенилизоцианатом в сухом ДМФА был получен 1-фенил-[1,8-а]-дигидро-2Н-[1,2,4]оксадиазоло[2,3-a]пиридин-2-он 4. Длительное кипячение последнего в диметилформамиде сопровождается выделением СО2 и образованием 2-анилинопиридина 2а с выходом 77% [5]. При использовании данного метода из N-окисей изохинолина и фенантридина были получены 1-анилиноизохинолин и 6-анилинофенантридин с выходами 75 и 87% соответственно [5].
118 |
Серия монографий InterBioScreen |
PhNCO |
N O |
t° |
|
+ |
N |
O −CO2 |
N N |
N |
|
||
O |
|
|
H |
|
|
|
|
3 |
4 |
|
2a |
1-Н-Хиноксалин-2-он 4-N-оксид 5 (R = H, X = O) вступает в реакцию 1,3-ди- полярного циклоприсоединения с фенилизотиоцианатом с образованием соответствующего промежуточного продукта 6 [6]. Термическим разложением последнего получен 3-анилино-1Н-хиноксалин-3-он 7 с выходом 99%. Аналогично, на основе 1-метил-1Н-хиноксалин-2-он 4N-оксида 5 (R = СH3) и 4-хлорфенилизоцианата получен 1-метил-3-(4-хлорфениламино)-1Н-хиноксалин-2-он 7 с выходом 56%.
|
R |
|
R |
|
R |
X |
N O |
X |
N O |
t° X |
N O |
|
|
ArNCO |
|
−CO2 |
|
|
+ |
|
N N Ar |
N NH |
|
|
N |
|
|
||
|
O |
|
O |
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
5 |
|
6 |
|
7 |
|
X = H, Cl |
|
|
|
R1 |
|
|
|
|
|
|
|
R = R1 = H, Me |
|
|
|
|
Также в результате реакции 1,3-диполярного циклоприсоединения 4,5,5-три- метил-∆1-пирролин-1-оксида 8 к N-сульфиниланилину 9 при низких температурах были получены [7] неустойчивые бициклические соединения 10. Медленное нагревание реакционной смеси до комнатной температуры сопровождается их разложением с выделением SO2 и образованием 2-ариламино-4,5,5-триметил-∆1- пирролинов 11 с выходом 54–90%.
|
OS=NAr |
|
H |
R t° |
N H |
+ |
9 |
|
|||
|
|
|
|
N |
|
N |
|
N |
N |
−SO2 |
|
O |
|
O |
S |
|
|
8 |
|
10 |
O |
|
11 |
|
|
|
R
Избранные методы синтеза и модификации гетероциклов, том 1 |
119 |
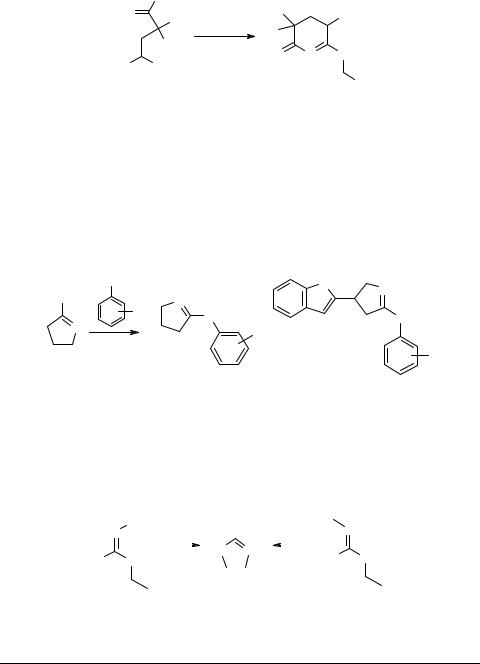
Взаимодействием нитрила 12 с замещенными бензиламинами при низкой температуре (–30°С) в инертных растворителях получены производные тетра- гидропиридин-2-она 13 [8].
O |
OEt |
Cl |
|
|
|
Cl ArCH2NH2 |
|
Cl |
|||
|
Cl |
|
|||
|
Cl |
|
|
||
|
O N NH |
||||
NC Cl |
|||||
|
|
Ar |
|||
12 |
|
|
13 |
||
|
|
|
|||
Для получения циклических амидинов 15 исходные анилины нагревали с избытком лактимного эфира 14 [9–11]. При использовании солей аминов реакция протекает в более мягких условиях (при комнатной температуре). В этом случае лактимный эфир реагирует в виде иминиевой соли, которая намного чувствительнее к нуклеофилам, чем исходное основание. Этим методом получены амидины 16 с противовоспалительной, диуретической и гипогликемической активностью на основе гидрохлоридов α-метилбензиламина [12] и цис-фенилцикло- пентиламина [13]. Аналогично был получен ряд 2-ариламино-4-(21-бензофурил)- 4,5-дигидро-3Н-пирролов 16, обладающих антиаритмической активностью [14].
NH2 |
|
|
|
X |
N |
OMe |
|
N |
H |
|
|
|
|
|
|||
R |
|
|
|
NH |
|
n( ) |
|
N |
|
||
N |
|
|
R |
|
|
n( ) |
|
|
|
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
14 |
|
15 |
|
16 |
|
n = 1, 2, 3 |
|
|
|
X = O, S |
|
Производные гуанидина формулы ArNHC(=NC6H5)NHCH2CH2OH 17 при кипячении в ксилоле циклизуются с образованием 2-анилинооксазолидинов 18 при одновременном отщеплении анилина. Эти же соединения образуются при обработке изотиурониевой соли ArNHC(=S+CH3)NHCH2CH2OH 19 этилатом нат-
рия [15, 16].
|
N Ph |
|
t° |
|
NHAr |
EtONa |
S+ |
I |
|
|
||||
|
|
|
|
|
||||||||||
|
|
|
N |
|
||||||||||
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HN |
|
|
NH |
|||||
HN NH |
|
−PhNH2 |
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ar |
|
|
|
|
|
|
|
Ar |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
18 |
|
|
|
|
19 |
OH |
|||||
17 |
|
|
|
|
|
|
|
|
|
|
||||
120 |
Серия монографий InterBioScreen |
