
Карцев В.Г. - Избранные методы синтеза и модификации гетероциклов. Том 1 (2003)(ru)
.pdf
Синтез пиррол-2-онов
Егорова А.Ю., Тимофеева З.Ю.
Саратовский государственный университет им. Н.Г. Чернышевкого 410600, Саратов, ул. Астраханская, 83
Введение
Пиррол-2-оны по праву занимают особое место в современной органической химии в связи с их широким использованием в синтезе биологически активных веществ.
В последние годы наибольшее внимание уделяют исследованию пиррол- 2-онов и пиррол-3-онов, входящих в состав природных соединений и их аналогов
[1–13].
Структура пиррол-2-она присутствует в молекулах порфиринов [11, 14, 15], желчных пигментов [16–18], фикоцианобилина [19].
Пиррол-2-оновый фрагмент обнаружен в природных антибиотиках, таких как малономицин [21] и др. [20–22], алкалоидах [23–28] (компоненты Jatropha macrorrhiza [8, 26–27], мирабимиды A-D [7, 28], лилидин [13]). Эта структура входит в молекулы различных ферментов и антиметаболитов [2–4, 6, 30], ингибиторов РНК бактерии Bacillus megaterium (α-липомицина [12] и стрептолидигина [32]).
|
|
+ |
|
H3N |
+ |
|
|
NH3 O |
|
OH |
|
|
|
|
O |
||
HO N |
O |
HN |
|
HN O |
|
|
|
CO2H |
|||
H |
|
O |
O |
O |
|
|
|
||||
|
|
|
|
||
лилидин |
|
|
малономицин |
||
|
|
O |
|
|
|
N |
O |
N |
O O |
O |
|
|
O |
N |
|
N |
|
|
|
|
|
|
|
|
|
мирабимид С |
|
|
O |
Структура пиррол-2-онов допускает возможность существования этих соединений в трех таутомерных формах A, B, C [33]:
Избранные методы синтеза и модификации гетероциклов, том 1 |
181 |

R |
|
R |
|
R |
|
N |
O |
N |
O |
N |
OH |
|
|
|
|||
R1 |
|
R1 |
|
R1 |
|
A |
|
B |
|
C |
|
|
|
|
|
3 |
|
Отмечено, что α-гидроксипирролы C существуют в таутомерной форме пирролонов с двойной связью в 3Н- (A) или 5Н- (B) положении [34–35]. Незамещенный 2-гидроксипиррол, его 3-алкил- и 3-ацетилпроизводные существуют преимущественно в виде 5Н-изомера B, что доказано на основе спектров ЯМР. Если же ацильные или эфирные заместители занимают положение 4, то преобладает 3Н-изомер 1.
В настоящем обзоре впервые систематизированы методы синтеза пиррол-2- онов, включая данные последних лет.
1. Синтезы на основе оксокислот и их производных
Метод получения пиррол-2-онов путем циклизации оксокарбоновых кислот и их производных, является наиболее известным [36].
Одним из первых представителей этого ряда гетероциклов является 1,4,5- трифенил-3Н-пиррол-2-он 2, синтезированный в 1892 г. из замещенной β-бензоил- пропионовой кислоты 1 [37, 38] (схема 1).
Схема 1
Ph O |
|
|
Ph O |
|
O |
|
H2O |
|
PhNH2 |
||
Ph |
OEt |
Ph |
|
OH |
N Ph |
|
|
|
Ph |
||
O |
|
O |
|
|
|
|
|
|
Ph |
||
1 |
|
|
|
|
2 |
5-Фенил-3Н-пиррол-2-он 4 получен обработкой спиртовым раствором аммиака β-бензоилпропионовой кислоты 3 при 100°С (схема 2). Выход целевого продукта 4 не превышает 10% [36, 37, 39].
Схема 2
O |
NH3 |
|
|
|
OH EtOH |
N |
O |
O |
|
H |
|
|
|
||
|
|
|
|
3 |
|
4 |
|
182 |
Серия монографий InterBioScreen |
Циклизация эфиров 3-метил-2-оксопента-3-еновой кислоты 5 под действием первичных аминов (схема 3) приводит к 3-аминозамещенным 5Н-пиррол-2-онам 6
[40, 41]:
Схема 3
O
O
OMe + |
RNH |
2 |
|
|
NH |
|
O |
|
R |
||
O |
|
|
|
||
|
|
|
|
|
|
5 |
|
|
|
|
|
|
O |
|
|
|
H |
|
|
RNH2 |
|
N R |
|
|
|
|
|
|
|
N |
O |
|
N |
O |
|
|
|
|
|
||
R |
|
|
|
R |
|
R = Me, Et, C6H11, CH2Ph, Ph |
6 |
|
|||
|
|
||||
Замещенные пиррол-2-оны 8 получают по методу Фишера из диэтилацетилсукцината 7 кипячением в растворе аммиака в течение 10 часов при температуре 100°С (схема 4). Однако и в этом случае выход продукта не превышает 10–15% [42–48].
Схема 4
O O |
NH3 |
HN |
OEt H O |
HN |
OH |
EtO |
|
2 |
|
||
OEt |
|
O |
|
O |
|
|
O |
O |
|||
O |
|
||||
|
|
|
|
|
|
7 |
|
|
|
|
8 |
Замыкание цикла возможно при восстановлении производных β-кетоэфиров, циангидринов 9, или нагреванием эфира 3-замещенной оксокислоты 10 с аммиаком и первичными аминами. Реакция проходит через стадию образования аминоэфира, который при дальнейшем нагревании в спирте циклизуется в 4-карбэтокси- 3Н-пиррол-2-он 11 (схема 5) [33].
Избранные методы синтеза и модификации гетероциклов, том 1 |
183 |
Схема 5
OEt |
|
|
OEt |
|
R |
||
O |
R |
|
H2 |
|
|
||
CN |
O |
R |
|
R2 |
|||
R2 |
|
Ni |
|
|
HN |
||
OH |
|
R2 |
OH NH2 |
|
|||
|
|
|
O |
||||
|
|
|
|
||||
|
9 |
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
O O |
R |
|
|
O |
|
R2 |
|
|
RNH2 |
OEt |
OEt |
||||
|
|
OEt |
EtO |
N |
|||
EtO |
|
|
|
|
O |
||
|
|
|
|
R O |
O |
||
|
O |
|
|
HN |
|||
10 |
|
|
11 |
||||
R = Me, Et; R2 = Et, Pr |
R2 |
|
|
||||
|
|
|
|
||||
|
|
|
|
|
|||
Под действием уксусного ангидрида происходит превращение 4,7-дикето- каприловой кислоты 12 в непредельный γ-лактон 13, последний под действием ацетата аммония в уксусной кислоте рециклизуется в азотсодержащий гетероцикл
14 с выходом 21% [49, 50] (схема 6).
Схема 6
OH |
O |
O |
|
O |
NH |
||
O |
|||
AcONH4 |
|
||
O |
|
|
|
O |
O |
O |
|
12 |
|||
13 |
14 |
Удобным является метод, основанный на циклизации амидов оксокислот 15 в присутствии уксусного ангидрида при катализе хлорной кислотой [50–56] (схема 7). Однако следует отметить, что и этот метод позволяет получать Ν-фенил- 3Н-пиррол-2-оны 16 с выходом, не превышающим 25%. Реакция осложняется образованием перхлоратов иммония 17.
Схема 7
|
|
O |
|
R |
+ |
|
|
|
NH |
||
|
R NH |
N |
|
|
ClO−4 |
|
|
R |
N R |
||
|
O |
Ac2O |
|
+ |
|
|
|
|
|
||
|
|
HClO4 |
|
|
|
|
|
|
|
|
|
O |
|
|
|
17 |
|
15 |
|
16 |
|
|
|
184 |
Серия монографий InterBioScreen |
4-Метил-5Н-пиррол-2-он 19 с выходом 41% синтезирован при восстановлении и карбонилировании амида непредельной кислоты 18 на родиевом катализаторе [57, 58] (схема 8).
Схема 8
O |
H2 |
/CO HN |
|
NH2 |
Rh |
18 |
O |
19 |
1,5-Замещенный пиррол-2-он получен в результате внутримолекулярной циклизации производных транс-кротоновых кислот под действием порошка железа [59].
Много внимания в литературе уделено вопросам кольчато-цепного равновесия амидов 3-оксокарбоновых кислот [60–69]. Так как гидроксипирролидоны являются внутренними амидами оксокислот, показано, что кольчато-цепное равновесие в растворах Ν-замещенных амидов 4-оксоалкановых кислот 20–23 смещено в сторону циклической формы 23 (схема 9).
Схема 9
O |
O |
O |
O |
|
R |
N R |
N R |
N R |
|
R |
−H2O |
R |
||
|
||||
O NH |
R |
|||
HO |
|
|
||
R |
|
|
|
|
20 |
21 |
22 |
23 |
При длительном нагревании 5-метил-5-оксипирролидоны 21 отщепляют воду, образуя 5-метил-3Н-пиррол-2-оны 22 [70–72], существующие в таутомерной смеси с соединениями, имеющими экзоциклическую двойную связь.
Реакцией α-кетолов (α-ацетолов) с амидами α-цианоуксусной кислоты в присутствии этилата натрия в спирте получены 3-карбомоил-4,5,5-триметил-1-алкил- 5Н-пиррол-2-оны с выходом до 63–82% [73].
Взаимодействие этиловых эфиров 4-оксоалкановых кислот 24 с ароматическими аминами (анилин, п-толуидин) при проведении реакции в жестких условиях (ксилол, 120°С, 3 часа) и соотношении реагентов 1 : 3 протекает с образованием N-арил-5-алкил-пиррол-2-онов в виде 3Н-изомеров 25 с выходом 63–75% [74, 75] (схема 10).
Избранные методы синтеза и модификации гетероциклов, том 1 |
185 |
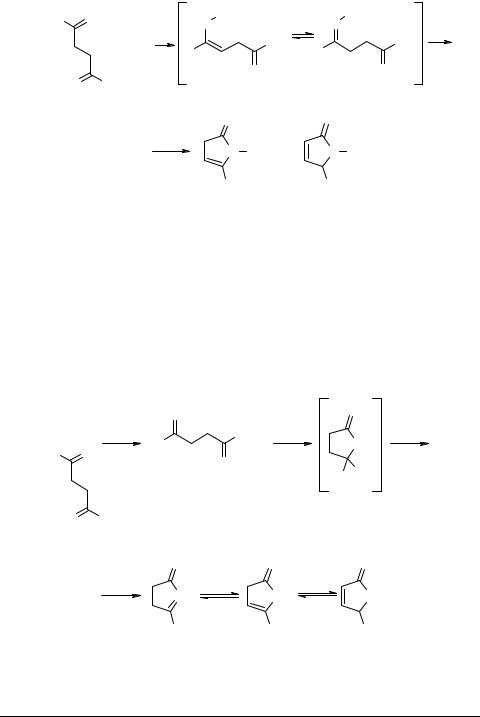
Схема 10
R |
O |
HN |
Ar |
N |
Ar |
|
|
|
|
|
|
||
|
+ ArNH2 |
R |
OEt |
R |
|
OEt |
|
|
|
|
|||
O |
OEt |
|
O |
|
|
O |
|
|
|
|
|
||
|
24 |
|
D |
O |
E |
|
|
|
|
O |
|
|
|
|
|
−EtOH |
N Ar + |
N Ar |
|
|
|
|
|
|
|
|
|
|
|
|
R |
R |
|
|
|
|
|
25 |
26 |
|
|
R = Me, Bu, i-Bu; Ar = Ph, C6H4Me
Одновременно с 3Н-формой в этих условиях получены N-арил-5-алкил-5Н- пиррол-2-оны 26 с выходом 10–35%.
В более мягких условиях (этанол, 70–75°С) реакция приводит к получению смеси продуктов с общим выходом, не превышающим 18%.
С целью получения N-незамещенных 3Н-пиррол-2-онов 28, этиловые эфиры 4-оксоалкановых кислот 27 обрабатывались аммиаком при соотношении реагентов
1 : 3 в автоклаве [76, 77] (схема 11).
Схема 11
NH3 |
|
O |
|
O |
|
+ |
100°C |
R |
NH2 |
NH |
∆ |
R O |
EtOH |
O |
−H2O |
||
|
|
|
OH |
|
|
|
|
|
R |
|
|
O |
OEt |
|
|
|
|
27 |
|
|
|
|
|
|
|
O |
O |
O |
|
|
|
N |
NH |
NH |
|
|
|
R |
R |
R |
|
|
|
|
28 |
|
|
R = Pr, C5H11, i-C5H11, C6H13, C7H15, C8H17
186 |
Серия монографий InterBioScreen |
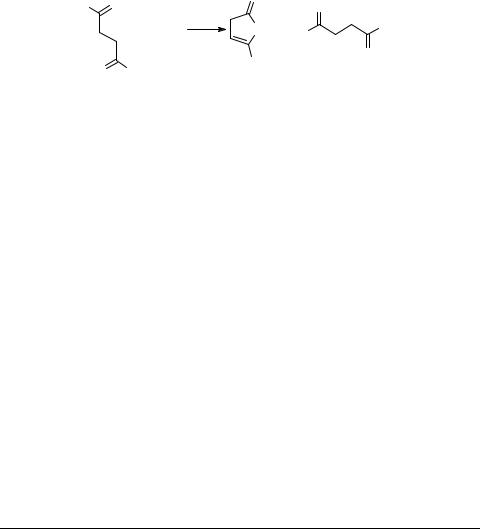
Показано, что аммонолиз этиловых эфиров оксокислот приводит к амидам 4-оксоалкановых кислот, которые выделены путем упаривания спиртовых растворов аминированных эфиров 4-оксокислот. Дальнейшая циклодегидратация амидов в пиррол-2-оны осуществляется путем перегонки в вакууме.
Взаимодействие 4-оксоалкановых кислот 29 с ацетатом аммония проводилось кипячением в среде ксилола или уксусного ангидрида. Целевые N-незамещенные пиррол-2-оны 30 с лучшими выходами (до 70%) получены при использовании уксусного ангидрида (схема 12).
Схема 12
R |
O |
O |
O |
|
|
|
|||
|
+ AcONH4 |
NH + R |
|
NH2 |
29 |
OH |
30 R |
31 |
O |
O |
|
|
|
R = Pr, C5H11, i-C5H11, C6H13, C7H15, C8H17, Ph
Использование ксилола позволяет получать пиррол-2-оны с выходом до 55%; одновременно, при использовании этого растворителя, выделены амиды 4-оксо-
кислот 31 (20%) [76].
2. Синтезы на основе соединений фуранового ряда
Взаимодействие кислородсодержащих гетероциклов, таких как фуран-2-оны с первичными аминами, представляет значительный интерес ввиду возможности получения таких продуктов, как амиды 4-оксоалкановых кислот и оксилактамов, являющихся кольчато-цепными изомерами. Показано [78], что оксилактамы образуются лишь в реакциях с метиламином, в то время как с другими аминами выделены ациклические продукты – амиды 4-оксокислот [79–88]. 5-Алкил(арил)- 3Н-фуран-2-оны (лактоны енолов γ-кетокарбоновых кислот) являются также удобными исходными реагентами в синтезе их N-содержащих гетероаналогов. Они реагируют с первичными ароматическими аминами (анилином, п-толуидином) в растворе ксилола при 120°С с образованием смесей 1-арил-5-алкил(арил)-3Н- пиррол-2-онов 32 и 1-арил-5-алкил(арил)-5Н-пиррол-2-онов 33 (схема 13). Целевые продукты выделены в основном в виде 3Н-изомеров 1,5-дизамещенных пиррол-2-онов (70–75%). Содержание 5Н-формы в реакционной смеси незначительно.
Избранные методы синтеза и модификации гетероциклов, том 1 |
187 |
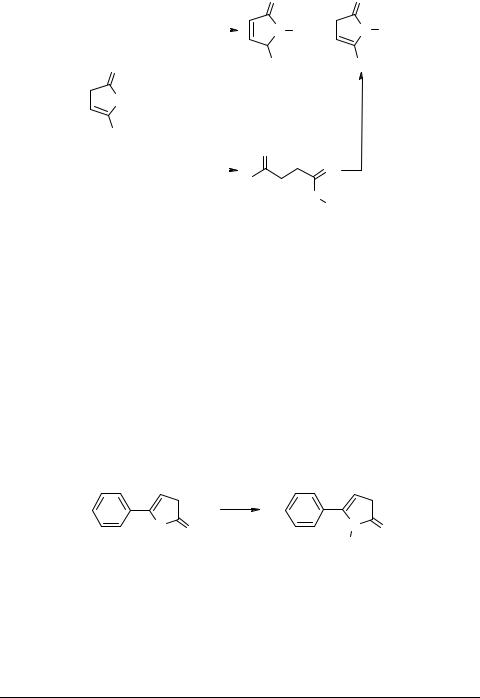
Схема 13
|
|
|
|
O |
|
O |
|
|
|
120°C |
N |
Ar + |
N |
Ar |
|
|
|
|
|
||||
|
|
|
|
||||
O |
|
|
R |
32 |
R |
33 |
|
O + ArNH2 |
|
|
|
|
Ac2O |
|
|
|
|
|
|
|
|||
R |
|
|
|
|
|||
|
|
O |
|
|
|
||
|
|
80°C |
|
|
|
||
|
|
|
O |
|
|
||
|
|
|
Ar |
34 |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
||
|
|
|
|
HN Ar |
|
|
|
R = C5H11, C6H13, C7H15, Ph |
|
|
|
||||
|
|
|
|
||||
Ar = Ph, C6H4Me, C6H4-Br |
|
|
|
|
|||
Образующиеся амиды 34 подвергаются последовательно циклизации в таутомерные 1-арил-5-алкил(арил)-5-гидрокси-2-оксопирролидоны с дальнейшей дегидратацией и частичной изомеризацией 3Н-формы в более устойчивые 5Н-изомеры.
Целенаправленно амиды оксокислот получены в более мягких условиях, при проведении реакции в растворе бензола при 80°С, и сокращении времени контакта реагентов в два раза, дальнейшая их внутримолекулярная циклодегидратация проходит при кипячении в присутствии уксусного ангидрида [89–92].
5-Фенил-3Н-пиррол-2-он 36 с выходом до 65% получен рециклизацией кислородного гетероаналога 35 в абсолютном этаноле под действием аммиака [93], метиламина [78, 94, 95], анилина [96] (схема 14).
Схема 14
|
|
RNH2 |
|
|
O |
O |
EtOH |
N |
O |
|
||||
|
|
36 R |
||
35 |
|
|
|
|
R = H, Me, Ph |
|
|
|
|
Использование в качестве аминирующего агента ацетата аммония приводит к замещению гидроксильной группы в положении 3 и циклизации с образованием 3,4-дизамещенных пиррол-2-онов 37 [97] (схема 15).
188 |
Серия монографий InterBioScreen |
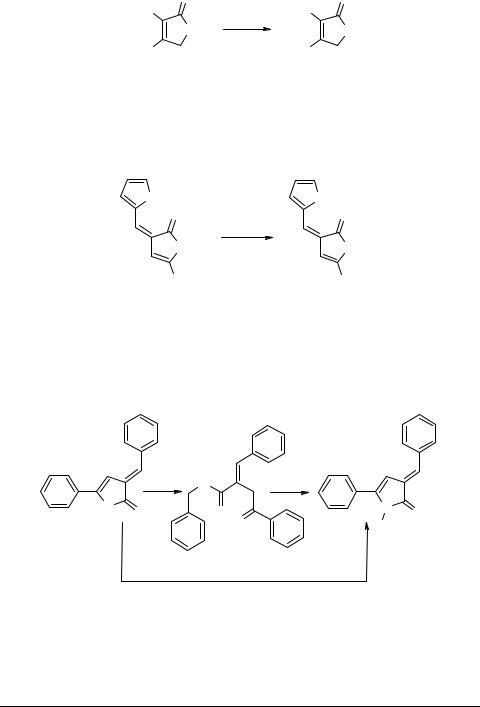
Схема 15
O |
|
|
O |
HO |
AcONH4 H2N |
NH |
|
O |
N2, 120°C |
|
|
EtO2C |
EtO2C |
|
|
|
37 |
||
|
|
|
|
Этот же метод синтеза был распространен и на ряд 3Н-пиррол-2-онов 38, имеющих в положении С-3 фурфурилиденовый заместитель [93, 98] (схема 16).
Схема 16
O |
|
|
O |
O |
NH3/EtOH |
|
O |
|
|
|
|
O |
|
|
NH |
Ar |
|
38 |
Ar |
|
|
Ar = Ph, C6H4Me, C6H4OMe, C6H4Cl
Бензилиден-3Н-пиррол-2-он 39 получен взаимодействием его кислородного гетероаналога с бензиламином [99] (схема 17).
Схема 17
|
BnNH2 |
H |
Ac2O |
|
|
|
N |
|
|
O |
O |
O O |
N |
O |
|
R |
|||
|
|
|
|
39 (80−85%)
NH3
R = H, CH2Ph
Использование водно-спиртового раствора аммиака позволяет получить в одну стадию незамещенные по атому азота 3-арилиден-3Н-пиррол-2-оны с выхо-
дом до 85% [100].
Избранные методы синтеза и модификации гетероциклов, том 1 |
189 |
В случае получения N-замещенных арилиденовых 3H-пиррол-2-онов, имеющих ароматический заместитель при атоме азота, процесс протекает через образование амидов оксоалкановых кислот, которые циклизуются в присутствии водоотнимающих средств [100].
5-Арил-3-метил-3Н-фуран-2-он 40 под действием анилина в этаноле с хорошим выходом образует амид замещенной β-бензоилпропионовой кислоты, циклизация которого в 1,5-диарилзамещенный 3Н-пиррол-2-он 41 протекает при кипячении в уксусном ангидриде [101–104] (схема 18).
Схема 18
|
Ar |
R |
R |
O |
NH2 |
|
|
R |
EtOH OHN |
O Ac2O Ar |
N O |
O + |
|
|
|
40 Ar
R = H, Me
41
Ar = Ph, C6H3Cl-3,4
При рециклизации 4,5-дихлор-3-алкокси-5Н-фуран-2-оны 42 образуют N-цик- логексил-5Н-пиррол-2-оны. Последовательной обработкой азидом натрия первоначально получены 5-азидо-4-хлор-3-алкокси-фуран-2-оны 43, кипячение последних с избытком циклогексиламина позволяет получать N-циклогексил-3,4,5-замещен- ные пиррол-2-оны 44 [105–107] (схема 19).
Схема 19
R |
O |
R |
NH2 |
Cl |
|
O R |
O |
|
|
|
|||
O |
O |
|
|
|
||
|
|
|
|
|
||
|
O |
NaN3 |
O |
HO |
N |
O |
|
|
|||||
|
|
|
|
|||
Cl |
|
Cl |
−NH3 |
|
|
|
Cl |
N N+ N |
|
|
|
||
|
|
|
|
|
||
|
42 |
|
43 |
|
44 |
|
5Н-Пиррол-2-он 46, имеющий в положении С-5 углеводный остаток, получен многостадийным синтезом из гликозилфурана 45, который на ключевой стадии обрабатывали азидом натрия в бензоле [108] (схема 20).
190 |
Серия монографий InterBioScreen |
