
- •80 Теория цветности органических соединений
- •Часть 1 Теория цветности органических соединений
- •1. Физические основы цветности
- •1.1. Природа света и происхождение цветоощущения
- •1.2. Спектральный способ регистрации поглощенного света и спектральная терминология
- •1.3. Взаимодействие электромагнитного излучения с веществом
- •1.3.1. Конфигурация электронно-колебательных уровней
- •1 Лекция 3.3.2. Принцип Франка-Кондона и форма полос поглощения
- •2. Анализ электронной структуры методами квантовой химии.
- •2.1. Способы описания энергетических состояний молекул.
- •2.2. Основные принципы метода возмущения молекулярных орбиталей
- •2.3. Формирование мо и основные типы электронных переходов
- •3. Экспериментальные методы изучения электронной структуры
- •3.1. Фотоэлектронная спектроскопия
- •3.2. Электронная трансмиссионная спектроскопия
- •4. Основные положения теории цветности
- •4.1. Электронные переходы в молекулах углеводородов
- •4.1.1. Энергии электронных переходов в насыщенных углеводородах
- •4.1.2. Энергии электронных переходов в сопряженных системах
- •4.1.3. Энергия электронных переходов в ароматических углеводородах
- •4.1.4. Альтернантные и неальтернантные -системы
- •4.1.5. Типы возмущений и их влияние на энергию –мо
- •4.2. Электронные переходы в молекулах, содержащих гетероатомы
- •4.2.1. Переходы в гетероцепных четных альтернантных системах
- •4.2.2. Переходы в гетероцепных нечетных альтернантных системах
- •4.3. Влияние поляризующих заместителей на поглощение света сопряженными системами
- •4.3.1. Классификация заместителей
- •4.3.2. Электронодонорные заместители
- •4.3.3. Электроноакцепторные заместители
- •4.3.4. Совместное действие поляризующих эд и эа заместителей
- •4.3.5. Полосы переноса заряда
- •4.4. Влияние ионизации на поляризующее действие заместителей
- •4.4.1. Ионизация эд-заместителей
- •4.4.2. Ионизация эа-заместителей
- •4.4.3. Ионизация сложных молекул
- •4 Лекция 9.5. Сложные конкурирующие и перекрещивающиеся сопряженные системы
- •4.5.1. Разветвленные сопряженные системы
- •4.5.2. Объяснение спектральных закономерностей при образовании разветвленных сопряженных систем методом возмущения мо
- •4.5.3. Перекрещивающиеся сопряженные системы
- •4 Лекция 10.6. Влияние пространственных факторов на поглощение света
- •4.6.1. Нарушение копланарности сопряженной системы
- •4.6.2. Искажение валентных углов
- •4.7. Комплексообразование с металлами
- •4.7.1. Комплексообразование с углублением цвета
- •4.7.2. Комплексообразование без углубления цвета
- •5. Хромофорная система красителей
3. Экспериментальные методы изучения электронной структуры
Объективные критерии для оценки адекватности квантово-химических расчетов предоставляют методы электронной спектроскопии, которые дают экспериментальные данные об орбитальной и электронной конфигурации молекул. К ним относятся:
фотоэлектронная спектроскопия (ФЭС), которая оценивает энергию занятых электронных уровней;
электронная трансмиссионная спектроскопия (ЭТС), которая оценивает энергию вакантных электронных уровней;
электронная абсорбционная спектроскопия, которая позволяет измерить разность энергий основных и возбужденных состояний.
3.1. Фотоэлектронная спектроскопия
Фотоэлектронная спектроскопия является ионизационными методом и основана на фотоэлектронном эффекте. В эксперименте пары вещества, находящиеся в глубоком вакууме, облучаются монохроматическим излучением высокой энергии, которое способно вызвать фотоионизациюотдельных молекул.
M + h = M+ + e
Для исследования энергетики внутренних электронных слоев используют рентгеновские лучи (излучение KMg с энергией фотонов 1253 эВ). Для исследования энергии связывающих, валентных электронов применяют вакуумные ультрафиолетовые лучи [излучение разрядной лампыHeI(21,2 эВ) илиNeI(16,8 эВ)].
Энергия фотонов расходуется на отрывэлектрона (эта часть энергии определяет потенциал ионизацииIi) ипередачуионизированному электрону кинетической энергииEiкин, что выражается уравнением:hIi + Eiкин(уравнение баланса)
Полученный поток фотоэлектронов направляется в анализатор, где они сортируются по кинетическим энергиям и регистрируются. Увеличение интенсивности облучения (при сохранении энергии его фотонов) усиливает интенсивность потока фотоэлектронов (фотоэлектронный ток), но не его энергию.
Посколькусоотношение между регистрируемой кинетической энергией фотоэлектронов и потенциалом ионизацииоднозначно определяется из уравнения баланса, фотоэлектронный спектр представляет собой график зависимости потенциала ионизации,эВ(ось x абсцисс) от интенсивности фотоэлектронного тока, импульс/сек (осьy ординат). Иными словами ФЭС регистрирует энергетический спектр электронов покидающих молекулы при облучении монохроматическим световым потоком.
Такой спектр имеет вид.
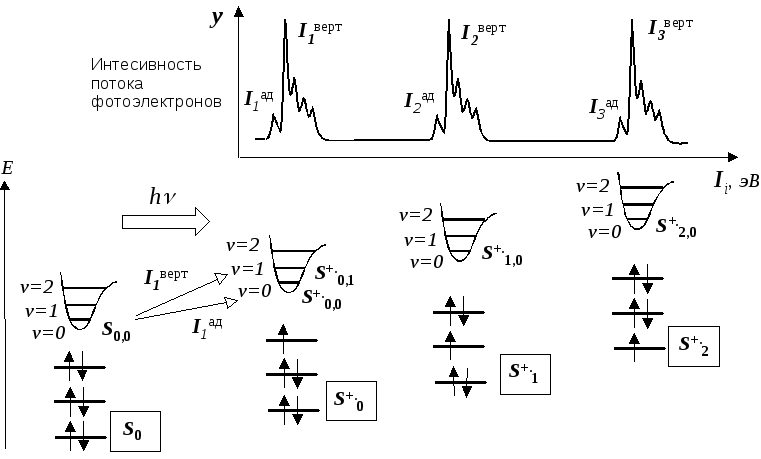
Образующийся ион M+находится в различных электронных и колебательных состояниях, что можно условноизобразить схемой заселенностиэлектронных уровней и выделением колебательного уровня на потенциальной кривой. Эти состояния обозначатся буквойS+с двумя подстрочными индексами. Первая цифра указывает на номер электронного состояния иона M+, вторая цифра - учитывает его колебательное состояние. Например,
|
S+0,0 |
- ион в основном состоянии, которому соответствует отрыв электрона сВЗМО и нахождение иона восновном колебательномсостоянии (v=0), |
|
S+0,1 |
- ион в основном состоянии, которому соответствует отрыв электрона с ВЗМО, но учитывается нахождение иона в первом колебательном состоянии (v=1), |
|
S+1,n |
- ион в первом электронном состоянии, которому соответствует удаление электрона со 2-ой ЗМО и нахождение иона в n-ом колебательном состоянии (v=n). |
Тогда процесс сохранения энергии при фотоионизации можно записать следующим выражением:
h + E(S0,0) = E(S+i,n) + Eкин или h – Eкин = E(S+i,n) – E(S0,0)
Тогда потенциалы ионизации молекулы Ii можно представить как разность энергий ее конечного состояния (образовавшийся ион) и начального состояния (нейтральная молекула).
Ii = E(S+i,n) - E(S0,0)
Таким образом, получаемые из ФЭ-спектра потенциалы ионизацииI1,I2,I3… Iiотвечают однократно заряженному молекулярному ионуM+, у которого удален электрон с 1-й, 2-й, 3-й, …i-й занятой МО.
Если фотоионизация молекулы сопровождается изменением колебательного состояния иона, полоса в ФЭС наблюдается в виде серии пиков. Расстояние между ними соответствует шагу колебательных уровней в молекулярном ионе.
О бычно
наиболее интенсивным оказывается второй
пик, отвечающий первому колебательному
состоянию уровнюS+0,1.
Поэтому чаще всего измеряют значение
вертикального
потенциала ионизации
I
верт, который
является франк-кондоновским переходом.
Более точно оценивает энергию орбитали
адиабатический потенциал ионизации
I
ад, которому
соответствует разности энергии между
основными колебательными состояниями
E(S+0,0)
- E(S0,0),
хотя различие между I
верт
и I
ад
не превышает 0.1-0.2 эВ.
бычно
наиболее интенсивным оказывается второй
пик, отвечающий первому колебательному
состоянию уровнюS+0,1.
Поэтому чаще всего измеряют значение
вертикального
потенциала ионизации
I
верт, который
является франк-кондоновским переходом.
Более точно оценивает энергию орбитали
адиабатический потенциал ионизации
I
ад, которому
соответствует разности энергии между
основными колебательными состояниями
E(S+0,0)
- E(S0,0),
хотя различие между I
верт
и I
ад
не превышает 0.1-0.2 эВ.
Полагая, что при фотоионизации электрона с одной из МО не происходит значительного изменения энергий остальных занятых молекулярных орбиталей, можно записать: Iiверт=– EiССП
Это соотношение получило название теоремы Купманса, согласно которой измеренные потенциалы вертикальной ионизации (I верт) равны отрицательной величине орбитальных энергий, рассчитанных с помощью метода ССП Хартри-Фока.
Отметим, что стабильные, связывающие орбитали всегда имеют отрицательные значения энергии.
Примером применения теоремы Купманса может служить хорошая корреляция первых потенциалов ионизации полиаценов с рассчитанными энергиями ВЗМО:
|
Полиацены |
Бензол |
Нафталин |
Антрацен |
Тетрацен |
|
Е (ВЗМО) |
|
, |
, |
, |
|
I1 эВ |
9,24 |
8,15 |
7,41 |
6,97 |
Из данных таблицы видно, что чем выше энергия -ВЗМО, тем ниже значение ионизационного потенциала.
