- •80 Теория цветности органических соединений
- •Часть 1 Теория цветности органических соединений
- •1. Физические основы цветности
- •1.1. Природа света и происхождение цветоощущения
- •1.2. Спектральный способ регистрации поглощенного света и спектральная терминология
- •1.3. Взаимодействие электромагнитного излучения с веществом
- •1.3.1. Конфигурация электронно-колебательных уровней
- •1 Лекция 3.3.2. Принцип Франка-Кондона и форма полос поглощения
- •2. Анализ электронной структуры методами квантовой химии.
- •2.1. Способы описания энергетических состояний молекул.
- •2.2. Основные принципы метода возмущения молекулярных орбиталей
- •2.3. Формирование мо и основные типы электронных переходов
- •3. Экспериментальные методы изучения электронной структуры
- •3.1. Фотоэлектронная спектроскопия
- •3.2. Электронная трансмиссионная спектроскопия
- •4. Основные положения теории цветности
- •4.1. Электронные переходы в молекулах углеводородов
- •4.1.1. Энергии электронных переходов в насыщенных углеводородах
- •4.1.2. Энергии электронных переходов в сопряженных системах
- •4.1.3. Энергия электронных переходов в ароматических углеводородах
- •4.1.4. Альтернантные и неальтернантные -системы
- •4.1.5. Типы возмущений и их влияние на энергию –мо
- •4.2. Электронные переходы в молекулах, содержащих гетероатомы
- •4.2.1. Переходы в гетероцепных четных альтернантных системах
- •4.2.2. Переходы в гетероцепных нечетных альтернантных системах
- •4.3. Влияние поляризующих заместителей на поглощение света сопряженными системами
- •4.3.1. Классификация заместителей
- •4.3.2. Электронодонорные заместители
- •4.3.3. Электроноакцепторные заместители
- •4.3.4. Совместное действие поляризующих эд и эа заместителей
- •4.3.5. Полосы переноса заряда
- •4.4. Влияние ионизации на поляризующее действие заместителей
- •4.4.1. Ионизация эд-заместителей
- •4.4.2. Ионизация эа-заместителей
- •4.4.3. Ионизация сложных молекул
- •4 Лекция 9.5. Сложные конкурирующие и перекрещивающиеся сопряженные системы
- •4.5.1. Разветвленные сопряженные системы
- •4.5.2. Объяснение спектральных закономерностей при образовании разветвленных сопряженных систем методом возмущения мо
- •4.5.3. Перекрещивающиеся сопряженные системы
- •4 Лекция 10.6. Влияние пространственных факторов на поглощение света
- •4.6.1. Нарушение копланарности сопряженной системы
- •4.6.2. Искажение валентных углов
- •4.7. Комплексообразование с металлами
- •4.7.1. Комплексообразование с углублением цвета
- •4.7.2. Комплексообразование без углубления цвета
- •5. Хромофорная система красителей
4.6.1. Нарушение копланарности сопряженной системы
Структурно близкий ряд соединений, представленных в таблице,: флуорен (1), 9,10-дигидрофенантрен (2), бифенил (3), 2-метилбифенил (4), 2,2'-диметилбифенил (5) и бимезитил (6) имеют формально одинаковые 12 -электронные системы. В то же время, эти молекулы отличаются в пространственном отношении, а именно, углом поворота () бензольных колец относительно друг друга вокруг C-C биарильной связи. Этот угол называется двугранным межплоскостным углом.

Изменение величин межплоскостного угла в этом ряду соединений и положение полосы поглощения в спектре приведено в таблице и объясняется следующим образом.
Межплоскостной уголγи положение К-полосы в электронных спектрах производныхбифенила.
|
№ |
Соединение |
Формула |
О |
Положение К-полосы макс, нм () |
|
1 |
Флуорен |
|
0 |
267 (21000) |
|
2 |
9,10-Дигидрофенантрен |
|
10 |
265 (17000) |
|
3 |
Бифенил |
|
35 |
251 (15000) |
|
4 |
2-Метилбифенил |
|
50 |
237 (12000) |
|
5 |
2,2'-Диметилбифенил |
|
70 |
218 (11000) |
|
6 |
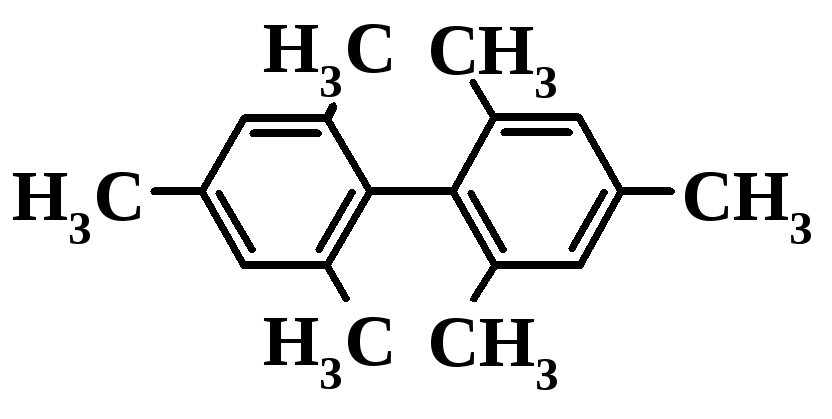
Бимезитил |
|
90 |
208 ( 9600) |
Связывание 2,2'-положений бифенила метиленовой группой фиксирует бензольные кольца в флуорене (1) в одной плоскости. Увеличение длины дополнительных связей между кольцами (2), разрыв жесткой связи между кольцами (3), увеличение числа объемистых СН3 -групп в положениях 2,2' (46) приводит к росту стерических напряжений, которые компенсируются увеличением межплоскостного угла от 0О в плоском флуорене (1) до 90О в бимезитиле (6).
Переход в одно из возбужденных состояний этих молекул сопровождается однотипной поляризацией -системы вдоль длинной оси и приближением молекулы к диполярной ионной структуре, для которой характерно наличие двойной связи между кольцами.

Электронный переход такого типа аналогичен 1A1La в бензоле и ему соответствует в спектре интенсивная K-полоса. В основном состоянии уровни энергии соединений (1-5) мало, чем отличаются друг от друга.
Возникающие пространственные (стерические) напряжения в них снимаются поворотом вокруг существенно простой в основном состоянии биарильной связи.
Уровни энергии возбужденного состояния этих соединений должны заметно различаться. Поскольку поворот бензольных колец относительно двойной в возбужденном состоянии биарильной связи невозможен, перевод в возбужденное состояние неплоских молекул (2-5) потребует дополнительных затрат энергии для восстановления плоской структуры. Принято считать, что эта дополнительная энергия расходуется на деформацию -связей, которыми пространственно взаимодействующие группы присоединены к -системе.
Чем больше межплоскостной угол в соединении по сравнению с плоским флуореном, тем большая энергия должна быть затрачена для возбуждения этой молекулы. Поэтому в ряду соединений (1-5) происходит увеличение энергии возбуждения, а в электронных спектрах наблюдается смещение K-полосы в коротковолновую область и понижение её интенсивности.
Приведенные примеры иллюстрирует стерический гипсохромный эффект.
В бимезитиле (6) пространственные трудности, создаваемые четырьмя орто-расположенными CH3‑группами, настолько велики, что восстановление копланарности в возбужденном состоянии невозможно без разрыва биарильной связи.

При этом происходит полное разобщение бензольных -систем и они взаимодействуют со светом независимо друг от друга, как две молекулы мезитилена.

Поэтому положение K-полосы в спектрах бимезитила и мезитилена практически одинаково, а различие выражается лишь в большей интенсивности поглощения в случае бимезитила.
Это объяснение стерического гипсохромного эффекта сделано в рамках метода валентных связей. Оно не совсем корректно, так как противоречит принципу Франка-Кондона. За весьма малое время перехода молекулы в возбужденное состояние и существование в возбужденном состоянии (10-10 с) маловероятно значительное изменение геометрии молекулы, а тем более восстановление её копланарности.
Метод возмущения молекулярных орбиталейрешает эту проблему строже и корректно. Различия в энергиях* электронных переходов, ответственных за появление и положение К-полосы в электронных спектрах соединений (1-5), (см. табл.) свидетельствуют о различиях в условиях формирования единой-электронной системы этих производных бифенила.
Для демонстрации общего подхода реконструируем итоговое взаимное расположение высшей занятой, нижней вакантной и второй вакантной молекулярной орбиталей для плоского флуорена (1) и не плоского 2-метилбифенила (4) путем анализа возмущений граничных-МО двух радикальных фрагментов в процессе их рекомбинации с учетом реально существующего межплоскостного угла в этих молекулах.
В рассматриваемом примере двухцентрового возмущения не будет большой ошибкой предположить, что энергии,*-МО фенильного иорто-толильного радикалов или бирадикалаорто-фенилена и бирадикала из толуола отличаются незначительно.
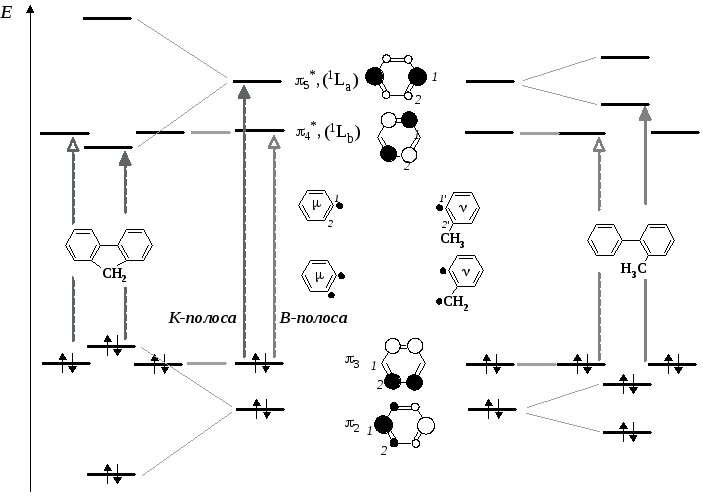
В результате первоначального связывания двух арильных фрагментов -связью становится возможным и изменения в энергии их-электронных систем как следствие перекрывания и смешивания парных3-,4*-МО и2-,5*-МО соответствующих бирадикалов под влиянием возмущений первого порядка. Тогда величины изменения энергии орбиталей на величинуEсоответствующую расщеплениюRможно определить из выражений:
R = kS( E + E ) = ;
E = 2 cicj ;
где ci и cj коэффициенты при АО молекулярных орбиталей арильных фрагментов для связываемых биарильной связью С-атомов 1 и 1'
Из первого уравнения следует, что расщеплениеR, а следовательно и сближение образующихся новых пари*-МО в соответствующих биарилах,пропорционально интегралу перекрыванияS, который призван учитывать степень взаимодействия (смешивания)–системив месте их связывания.
R = f () = f (S)
В свою очередь величина интеграла перекрывания S максимальна только при условии параллельности осей симметрии-облаков, что возможно при копланарном расположении биарильных фрагментов. Отклонение от копланарности приводит к уменьшениюSпропорционально квадрату косинуса межплоскостного угла,
S = Socos2 ,
где cos меняется от 1 до 0, если возрастает от 0 до 90.
Тогда в случае плоского флуорена (1)S=So, то есть будет максимальным, посколькуcos20=1. Для 2-метилбифенила (4), в котором межплоскостной угол равен 50,Sбудет составлять всего 0,4So(cos250= 0,413). Таким образом, наибольшее расщепление взаимодействующих парных3-,4*-МО и2-,5*-МО следует ожидать в молекуле флуорена и заметно меньшее расщепление в молекуле 2-метилбифенила.
Однако, в соответствии со вторым уравнением, итоговое изменение энергий Eи взаимное расположение нового набора МО на энергетической шкале определяется также произведением собственных коэффициентов при АО для атомов, образующих биарильную связь.
Согласно данным квантово-химических расчетов (на диаграмме графически представлены величины собственных коэффициентов) только для пар2-,5*-МО коэффициенты при всех АО составляющих эти МО, в том числе и для С1- и С1-атомов отличны от нуля, что вызывает их результативное расщепление. Напротив, парные3-,4*-МО в результате связывания соответствующих арильных фрагментов войдут в систему-уровней флуорена (1) и 2-метилбифенила (4) с неизменной энергией. Коэффициенты при АО для С1- и С1-атомов, образующих биарильную связь, имеют нулевое значение иEво втором уравнении обращается в ноль.
В результате в флуорене (1) происходит наибольшей сближение граничных орбиталей, причем низшей вакантной орбиталью оказывается МО, произведенная изπ5*-орбитали1La–типа (см. диаграмму и рис.).Возбуждение электрона с ВЗМО на эту орбиталь соответствует поляризации молекулы вдоль длинной оси и порождаетК- (1La-) полосусамую длинноволновую полосу в спектре флуорена, которая перекрывает В-полосу.

В неплоском 2-метилбифениле (4) из-за меньшего расщепления2-,5*-МО орбитали1La–типа становится второй вакантной МО, электронный переход на неё потребует большей энергии и К-полоса сместится гипсохромно по сравнению с её положением в электронном спектре флуорена (см. рис.). В этом случае низшей вакантной орбиталью оказывается, МО произведенная из4*-орбитали1Lb-типа. Теперь электронный переход между граничными орбиталями соответствует поляризации молекулы вдоль короткой оси, а порождаемая таким электронным переходом В- (1Lb-)-полоса проявляется как самая длинноволновая в виде частично перекрытых максимумов на правом склоне, гипсохромно смещенной К-полосы.
-

Электронные спектры поглощения:
1- флуорена (1);

2- 2-метилбифенила (4);

3- бимезитила (6).

В случае бимезитила с ортогональным расположением фенильных ядер, эффективное π,π-взаимодействие между ними невозможно, поскольку величина интеграла перекрыванияSобращается в ноль (cos290= 0). Поэтому в систему электронных уровней бимезитила π,π*-МО фрагментов мезитила в виде двух наборов вырожденных орбиталей. В электронном спектре бимезитила (см. рис.) максимумы поглощения К- и В-полосы располагаются практически при тех же длинах волн, что и в спектре мезитилена, но с примерно вдвое большей интенсивностью.
Аналогичная процедура сравнительной реконструкции π-орбитальной структуры позволяет объяснить обстоятельства ослабления электронного влияния поляризующих ЭД- и ЭА-заместителей на связанные с ними сопряженные системы под влиянием пространственных затруднений, то есть ингибирование p,π- π,π-взаимодействия в сложных сопряженных системах.
Изменение геометрии (конфигурации) сопряженной системы путем нарушения копланарности ее частей широко применяется в практике получения красителей различных цветов и различных технических классов.
Например, на основе п-диметиламино-п'-нитроазобензола получена серия пигментов, цвет которых постепенно повышается от красновато-оранжевого до желтого.

Это достигается введением в о-положение к (CH3)2N-группе объемистых заместителей. При увеличении размера заместителя (переход к Me-, а затем кизо-Pr) возрастающие пространственные трудности выводят диметиламиногруппу из плоскости кольца. Вследствие этого ослабеваетр-взаимодействие неподеленной пары электроновазота с-системой азобензола.Ослабление ЭД-эффекта(CH3)2N-группысопровождается гипсохромным сдвигом максимума поглощенияи уменьшением интенсивности полосы поглощения.
Следующий пример показывает, что нарушение копланарности молекулы красителя может вызвать не только повышение цвета, но и существенно ослабить силы сродства красителя к целлюлозному волокну (межмолекулярное взаимодействие молекул красителя и волокна, закрепляющее краситель на волокне).

В результате разрыва жесткой SO2-связи между бензольными кольцами и введение во,о'-положения бифенила двух объемистых сульфогрупп в оранжевом красителе моноазофрагменты располагаются под углом примерно 60омежду плоскостями.
Неплоская молекула лишается способности прочно взаимодействовать с целлюлозным волокном, оранжевый краситель на основе бензидин-2,2’-дисульфокислоты утрачивает субстантивность и оказывается не прямым, а кислотным красителем.
Иногда ослабление пространственного взаимодействия объемных заместителей недостаточно, чтобы вызвать углубление цвета соединения, однако частичное снятие стерических препятствий сопряжению вызывает рост интенсивности поглощения.

Сопоставление строения красителей Кислотный желтый КиПрямойоранжевыйсветопрочный Упоказывает, что во втором красителе за счет внедрения между бензольными кольцами виниленовой группы расстояние между объемными сульфогруппами увеличивается и пространственные затруднения в молекуле понижаются. Поэтому краситель на основе стильбен-2,2’-дисульфокислоты становится более ярким, приобретает сродство к целлюлозному волокну, что свидетельствует о частичном восстановлении плоскостности его молекулы.
Разобщение отдельных частей сопряженной системы вследствие свободного вращения вокруг простой связи используется для получения эффекта внутримолекулярного смешения цветов. Например, зеленый цвет трис-азокрасителя соответствует смеси желтого моноазокрасителя и темно-синего дис-азокрасителя.

Следовательно, нарушение -взаимодействия действительно происходит на участке бифенильной С-С-связи, вокруг которой свободно вращается азофрагменты.