
- •Загальні правила виконання лабораторних робіт
- •Правила техніки безпеки
- •Перша допомога при нещасних випадках
- •Тема: класи неорганічних сполук
- •Оксиди.
- •Добування:
- •Хімічні властивості
- •Кислоти.
- •Добування:
- •Хімічні властивості
- •Основи.
- •Добування:
- •Хімічні властивості.
- •Амфоліти.
- •Добування:
- •Хімічні властивості.
- •Лабораторна робота № 1 Властивості основних класів неорганічних сполук.
- •Контрольні питання.
- •Тема: еквівалент та молярна маса еквіваленту
- •Лабораторна робота № 2. Визначення молярної маси еквіваленту металу (Mg, Al або Zn) методом витиснення Гідрогену.
- •Контрольні питання
- •Тема: будова атома. Періодичний закон і періодична система д.І.Менделєєва. І. Будова атома.
- •Іі. Періодичний закон та періодична система елементів д.І.Менделєєва.
- •Правило написання електронних формул *.
- •Практична робота № 3 Електронна будова атома та періодична система елементів.
- •Контрольні питання.
- •Тема: хімічний зв’язок і будова молекул.
- •Практичне заняття № 4 Хімічний зв’язок і будова молекул.
- •Результати оформлення роботи
- •Контрольні питання
- •Тема: хімічна термодинаміка та напрямок хімічних реакцій
- •Фактори, що визначають напрямок хімічних реакцій.
- •Лабораторна робота № 5 Визначення теплоти нейтралізації сильної кислоти сильною основою.
- •Контрольні питання
- •Тема: швидкість хімічних реакцій
- •Лабораторна робота № 6 Кінетика хімічних реакцій.
- •Контрольні питання.
- •Тема: Концентрації розчинів. Приготування розчинів.
- •Лабораторна робота № 7 Приготування розчинів.
- •Контрольні питання
- •Тема: замерзання і кипіння розчинів неелектролітів
- •Лабораторна робота № 8 Визначення молекулярної маси глюкози кріоскопічним методом.
- •Ход роботи.
- •Маса глюкози – m, г
- •Контрольні питання
- •Відповідь : 342 г/моль
- •Тема: електролітична дисоціація.
- •Лабораторна робота № 9 Властивості водних розчинів електролітів.
- •Контрольні питання
- •Тема: водневий показник середовища рН
- •Лабораторна робота № 10 вимірювання водневого показника середовища розчину нс1 електрохімічним методом.
- •Ход роботи.
- •Контрольні питання
- •Тема: гідроліз солей
- •Лабораторна робота № 11 Гідроліз водних розчинів солей.
- •Контрольні питання
- •Тема: малорозчинні електроліти. Добуток розчинності.
- •Лабораторна робота № 12 Добуток розчинності
- •Контрольні питання
- •Тема: колоідні розчини
- •Лабораторна робота № 13 Отримання та властивості колоїдних розчинів.
- •Контрольні питання.
- •Задачі.
- •Тема: окисно-відновні реакції.
- •Методи складання рівнянь реакцій окислювання-відновлення.
- •Лабораторна робота № 14 Окисно-відновні реакції.
- •Контрольні питання
- •Тема: гальванічні процеси.
- •Контрольні питання
- •Тема: електроліз.
- •Лабораторна робота № 16 Електроліз водних розчинів електролітів
- •Контрольні питання.
- •Тема: комплексні сполуки
- •Лабораторна робота № 17 Комплексні сполуки та їх властивості.
- •Контрольні питання
Фактори, що визначають напрямок хімічних реакцій.
У природі існує багато екзотермічних процесів: згорання палива, реакція нейтралізації, процеси кристалізації, біохімічні процеси тощо. Звідси виник принцип Бертло–Томсена, відповідно до якого самодовільно (спонтанно) протікають тільки ті процеси, при яких ентальпія системи зменшується.
Але відомо також багато спонтанних процесів: випарювання рідин, розчинність у воді таких речовин як KCl, KNO3, розширення газів, то що. Тому екзотермічність процесу не може бути єдиним фактором, що визначає можливість його протікання: це залежить також від стану внутрішньої структури системи. В самій природі речовини внаслідок руху її електронів, атомних ядер атомів, молекул закладено прагнення до переходу із стану з більшим впорядкуванням до менш впорядкованого стану. Так, при розчиненні твердої речовини відбувається спонтанний перехід від більш впорядкованого стану кристалічної гратки до менш упорядкованого рідкого стану; випаровування рідин теж супроводжується зменшенням упорядкування часток у системі.
Мірою хаосу, невпорядкованості системи є ентропія (S). Вона відображає стан внутрішньої структури речовини у зв’язку з тепловим рухом її часток. Ентропія зростає із збільшенням рухливості часток при нагріванні, випаровуванні, плавленні, розчиненні, розширенні газу, при послабленні або розриві хімічних зв’язків між атомами тощо.
Процеси, що пов’язані з упорядкуванням системи: конденсація, кристалізація, стиснення, зміцнення зв’язків, полімерізація тощо – приводять до зменшення ентропії.
Ентропія – це статистичне поняття і має одиниці розміру енергетичні – Дж/(моль·К) або в ентропійних одиницях (е.о.): 1е.о.= 1 Дж/(моль·К). Ентропію, що визначена для стандартних умов (температура 298К; р = 101,33 кПа) позначають S0298, або S0; називають стандартною ентропією. У відповідності із наслідком із закону Гесса зміну ентропії (ΔS) можна підрахувати за рівнянням:
ΔSХ.Р.
=
 (6)
(6)
Отож на напрямок протікання процесу (в тому числі і хімічного) впливають дві протилежні тенденції, що закладені природою: з одного боку, частинки прямують до упорядкування (що веде до зменшення внутрішньої енергії і ентальпії системи); з другого боку – прямують до більш імовірного, максимально хаотичного стану, тобто до збільшення ентропії. Сумарний ефект цих двох протилежних тенденцій відбивається в термодинамічній функції, що називається ізобарно – ізотермічним потенціалом (або вільною енергією Гібса): позначається ΔG0298 або ΔG0; її розмірність: Дж/моль. Для простих речовин ΔG0 утворення умовно взята за нуль (як і ΔН0).
Взаємозв’язок між вільною енергією Гібса, ентальпією і ентропією системи відбивається у рівнянні:
ΔG = ΔН - Т ΔS = - А MAX (7)
де: ΔG – зміна ізобарного потенціалу системи під час процесу;
ΔН – зміна ентальпії;
ΔS – зміна ентропії;
Т – температура за шкалою Кельвіна;
А MAX – максимальна робота системи під час процесу.
Д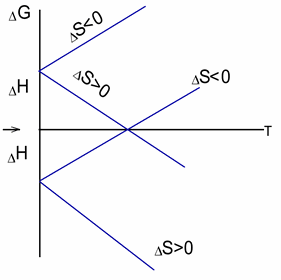 ане
рівняння є найважливішим в хімічній
термодинаміці. З нього визначається з
яких причин імовірна дана реакція: в
одних випадках процесу сприяють і
тепловий ефект і зміна ентропії, в других
– процес йде завдяки екзотермічності
реакції, в третіх – реакція можлива
завдяки збільшенню ентропії. У всіх
випадках, коли процес має місце, ΔG<0.
Якщо ΔS>0, то реакції сприяють великі
температури; в протилежному випадку
(ΔS<0) імовірність реакції зростає при
зниженні температури. Якщо ΔG>0, то
реакція у даних умовах неможлива.
ане
рівняння є найважливішим в хімічній
термодинаміці. З нього визначається з
яких причин імовірна дана реакція: в
одних випадках процесу сприяють і
тепловий ефект і зміна ентропії, в других
– процес йде завдяки екзотермічності
реакції, в третіх – реакція можлива
завдяки збільшенню ентропії. У всіх
випадках, коли процес має місце, ΔG<0.
Якщо ΔS>0, то реакції сприяють великі
температури; в протилежному випадку
(ΔS<0) імовірність реакції зростає при
зниженні температури. Якщо ΔG>0, то
реакція у даних умовах неможлива.
Розрахувати значення ΔG можна як з рівняння (7) так і з наслідку з закону Гесса:
ΔGХ.Р.
=
 (8)
(8)
Відповідні ΔG утворення речовин беруть з довідників.
У випадку, коли ΔG = 0 (це означає, що в рівнянні (7) ׀ΔН׀ =׀Т ΔS׀) система знаходиться у стані термодинамічної рівноваги. Такий стан спостерігається у фазових переходах (при плавленні, кристалізації, випаровуванні, конденсації тощо). З рівняння (7) маємо:
ΔG = ΔН - Т ΔS = 0 ;
ΔН = Т ΔS (9)
ΔS
=
![]() (10)
(10)
Застосовуючи рівняння (10) до фазових перетворень маємо:
ΔS =
=
![]() (11)
(11)
З рівняння (11) видно, що зміну ентропії в умовах фазових перетворень можна підрахувати, якщо визначити теплоту і температуру цих процесів.
Отже розрахунки термодинамічних характеристик системи ΔН, ΔS, ΔG дають можливість визначити імовірність протікання хімічної реакції і вплив на неї температури. Всі означені характеристики є функціями стану системи, тобто не залежать від кількості стадій в даному процесі, а визначаються тільки початковим і кінцевим станом речовин. Тому для їх розрахунків застосовуються однакові за формою рівняння (5), (6), (8).
