
- •Загальні правила виконання лабораторних робіт
- •Правила техніки безпеки
- •Перша допомога при нещасних випадках
- •Тема: класи неорганічних сполук
- •Оксиди.
- •Добування:
- •Хімічні властивості
- •Кислоти.
- •Добування:
- •Хімічні властивості
- •Основи.
- •Добування:
- •Хімічні властивості.
- •Амфоліти.
- •Добування:
- •Хімічні властивості.
- •Лабораторна робота № 1 Властивості основних класів неорганічних сполук.
- •Контрольні питання.
- •Тема: еквівалент та молярна маса еквіваленту
- •Лабораторна робота № 2. Визначення молярної маси еквіваленту металу (Mg, Al або Zn) методом витиснення Гідрогену.
- •Контрольні питання
- •Тема: будова атома. Періодичний закон і періодична система д.І.Менделєєва. І. Будова атома.
- •Іі. Періодичний закон та періодична система елементів д.І.Менделєєва.
- •Правило написання електронних формул *.
- •Практична робота № 3 Електронна будова атома та періодична система елементів.
- •Контрольні питання.
- •Тема: хімічний зв’язок і будова молекул.
- •Практичне заняття № 4 Хімічний зв’язок і будова молекул.
- •Результати оформлення роботи
- •Контрольні питання
- •Тема: хімічна термодинаміка та напрямок хімічних реакцій
- •Фактори, що визначають напрямок хімічних реакцій.
- •Лабораторна робота № 5 Визначення теплоти нейтралізації сильної кислоти сильною основою.
- •Контрольні питання
- •Тема: швидкість хімічних реакцій
- •Лабораторна робота № 6 Кінетика хімічних реакцій.
- •Контрольні питання.
- •Тема: Концентрації розчинів. Приготування розчинів.
- •Лабораторна робота № 7 Приготування розчинів.
- •Контрольні питання
- •Тема: замерзання і кипіння розчинів неелектролітів
- •Лабораторна робота № 8 Визначення молекулярної маси глюкози кріоскопічним методом.
- •Ход роботи.
- •Маса глюкози – m, г
- •Контрольні питання
- •Відповідь : 342 г/моль
- •Тема: електролітична дисоціація.
- •Лабораторна робота № 9 Властивості водних розчинів електролітів.
- •Контрольні питання
- •Тема: водневий показник середовища рН
- •Лабораторна робота № 10 вимірювання водневого показника середовища розчину нс1 електрохімічним методом.
- •Ход роботи.
- •Контрольні питання
- •Тема: гідроліз солей
- •Лабораторна робота № 11 Гідроліз водних розчинів солей.
- •Контрольні питання
- •Тема: малорозчинні електроліти. Добуток розчинності.
- •Лабораторна робота № 12 Добуток розчинності
- •Контрольні питання
- •Тема: колоідні розчини
- •Лабораторна робота № 13 Отримання та властивості колоїдних розчинів.
- •Контрольні питання.
- •Задачі.
- •Тема: окисно-відновні реакції.
- •Методи складання рівнянь реакцій окислювання-відновлення.
- •Лабораторна робота № 14 Окисно-відновні реакції.
- •Контрольні питання
- •Тема: гальванічні процеси.
- •Контрольні питання
- •Тема: електроліз.
- •Лабораторна робота № 16 Електроліз водних розчинів електролітів
- •Контрольні питання.
- •Тема: комплексні сполуки
- •Лабораторна робота № 17 Комплексні сполуки та їх властивості.
- •Контрольні питання
Тема: гальванічні процеси.
Кристалічна решітка металу складається з іонів цього металу та вільних електронів. Якщо покласти метал у вакуум, електрони почнуть виходити з кристалічної решітки. В результаті вакуум біля поверхні металу заряджається негативно, а метал від надлишку іонів – позитивно при цьому на межі метал-вакуум утворюється подвійний електронний шар або стрибок потенціалу.
1. Якщо занурити металічну пластинку у воду, вона починає розчинятися, посилаючи свої гідратовані іони у розчин. Внаслідок цього найближче коло розчину заряджається позитивно. І в цьому випадку також утворюється стрибок потенціалу.
Різниця електростатичних потенціалів на межі „метал-розчин” називається електродним потенціалом.
2. При зануренні металічної пластинки у розчин своєї солі з концентрацією іонів металу в цій солі такий, яку пластинка надавала б при розчиненні, тобто в момент занурення з металу буде виходить стільки ж іонів, скільки і повертатися. В цьому випадку потенціал металу буде дорівнювати нулю.
Електродний потенціал, який відповідає стану рівноваги, при якому швидкість перебігу іонів у розчин дорівнює швидкості зворотного їх осадження, називається рівноважним потенціалом.
3. Якщо занурити металічну пластинку у насичений розчин своєї солі, то при цьому іони металу з розчину будуть “осаджуватися” на пластинку, заряджую її позитивно, а надлишок кислотного залишку зарядить розчин негативно. На межі „метал-розчин” утворюється різниця потенціалів або електродний потенціал.
Величина електродного потенціалу залежить від активності металу, концентрації його іонів у розчині та температури.
Якщо метал занурений у розчин, концентрації якого більш або менш 1г-іон/л, тоді обчислення потенціалу електрода проводиться за формулою Нернста:
![]() ,
,
де Е0 – стандартний електродний потенціал метала;
n – валентність іонів метала у розчині;
С – концентрація іонів металу в розчині (в г-іон/л).
А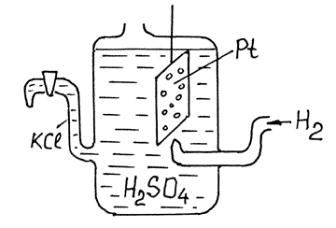 бсолютні
значення потенціалів металів виміряти
не вдається, тому вимірюють їх відносно
водневого електроду (див. рис.).
бсолютні
значення потенціалів металів виміряти
не вдається, тому вимірюють їх відносно
водневого електроду (див. рис.).
Водневий електрод складається з платинової пластини, яка вкрита губчастою платиною. Електрод занурюють у розчин сірчаної кислоти, з концентрацією йонів гідрогену 1 г-йон/л. знизу електрод омивається потоком газоподібного гідрогену під тиском 1 ат. Величину потенціалу такого електроду приймають за нуль.
Різниця потенціалів між металом зануреним у розчин своєї солі з концентрацією йонів металу 1 г-йон/л і водневим електродом, називається стандартним або нормальним електродним потенціалом металу.
При розташуванні металів в ряд за алгебраїчною величиною їх нормальних електродних потенціалів, отримали так званий “ електрохімічний ряд напруг металів”. Ряд напруг металів дає можливість зробити дуже важливі висновки:
-чим менша алгебраїчна величина стандартного електродного потенціалу, тим більша його хімічна активність;
-метали, які мають негативну величину стандартного електродного потенціалу, можуть видаляти гідроген з кислот;
-метал з меншою величиною стандартного електродного потенціалу здатний витискати з розчину солей метал з більшою алгебраїчною величиною стандартного електродного потенціалу;
-у гальванічному елементі анодом зветься більш активний метал, тобто стандартний електродний потенціал якого має меншу алгебраїчну величину.
Гальванічні елементи – це прилади, в яких хімічна енергія окисно-відновної реакції перетворюється в електричну.
Перший такий прилад був створено італійським фізіком-хіміком Вольта, потім вдосконалений російськими вченими Даніелем і Якобі. Їх гальванічний елемент складається з мідної та цинкової пластинок занурених у розчини своїх солей. Розчини розділені напівпроникною перетинкою. Якщо у зовнішній ланцюг увімкнути вольтметр, тоді можливо виміряти різницю електродних потенціалів або електрорушійну силу елемента.
ЕРС = Е0окисл. – Евідновн.
Схематично мідно-цинковий гальванічний елемент можна записати таким чином: (-) Zn / ZnSO4 // CuSO4 /Cu (+).

ЛАБОРАТОРНА РОБОТА № 15
Складання мідно-цинкового гальванічного елементу
та визначення його ЕРС.
МЕТА РОБОТИ – ознайомитися з основними електрохімічними поняттями та процесами роботи гальванічних елементів, визначити електрорушійну силу гальванічного елементу.
Прилади та реактиви: Стаканчики, цинкова, мідна пластинки, войлочний місток, гальванометр. Розчини: сульфату купруму (1М), сульфату цинку (1М).
Хід роботи.
Один із стаканчиків заповнюють 1М розчином сульфату купруму, другий – 1М розчином сульфату цинку. Обидва стаканчики з’єднують за допомогою войлочного містка. Занурюють до розчину сульфату цинку вузьку цинкову пластину, а до сульфату купруму – мідну пластину. Пластини приєднують дротами до гальванометру. Спостерігати відхилення стрілки гальванометра, яке виникає в результаті виникнення електричного струму як наслідок різних значень нормальних електродних потенціалів електродів Zn2+/Zn Cu2+/Cu. Записати показання приладу.
Завдання. Складіть рівняння окислювально-відновних реакцій, які проходять на електродах. В якому напрямку переміщаються електрони у зовнішньому ланцюгу? Які іони і в якому напрямку переміщаються у розчині? Розрахуйте теоретичне значення ЕРС мідно-цинкового гальванічного елементу, порівняйте з експериментальним значенням.
