
- •Содержание
- •Билет №1
- •2. Определение катаболизма. Катаболизм и анаболизм. Стадии катаболизма биомолекул в организме.
- •Билет№2.
- •1.Ферменты. Специфичность ферментов. Активный центр фермента.
- •2.Экзергонические и эндергонические биохимические реакции. Роль атф и других макроэргических фосфатов в сопряжении экзергонических процессов и эндергонических процессов.
- •3.Пути внутриклеточного метаболизма глюкозы. Гликолиз и глюконеогенез. Обратимые и необратимые реакции.
- •Билет №3
- •1.Регуляция активности ферментов. Проферменты. Изоферменты. Ингибиторы ферментов.
- •2.Реакции биологичемкого окисления.Типы реакций( дегидрогеназные, оксидазные, оксигеназные. Их биологическое значение.
- •3 Цитохромы Катализируют окисление веществ путем отдачи электронов Гемовое железо в одном из цитохромов имеется так же атом меди.
- •Билет№4
- •1.Ферментативный катализ
- •2.Митохондриальный транспорт
- •3.Аэробное окисление пирувата (окислительное декарбоксилирование пировиноградной кты).
- •Билет№5
- •1.Кинетика ферментативного катализа. Уравнение Михаэлиса-Ментен. Уравнение Лайнуивера-Берка.
- •2.Окислительное фосфорилирование. Пункты сопряжения окисления и фосфорилирования. Атф-синтетаза митохондрий.
- •3 Субъединицы (γ,δ,ε) способствуют целостности атф-синтазы
- •3.Полное окисление глюкозы. Энергетический баланс
- •Билет№6
- •1.Аллостерические ферменты. Ингибиторы и активаторы аллостерических ферментов. Аллостерические центры.
- •Деградация жирных кислот: β-окисление
- •Билет№7
- •1.Опять ферменты
- •2. Ингибиторы и разъединители транспорта электронов окислительного фосфорилирования
- •3.Глюконеогенез
- •Билет №8
- •1. Витамины
- •2. Микросомальная цепь транспорта электронов
- •3. Глюкозолактонный цикл
- •1. Витамин в2
- •3.Гипергликемия
- •Билет 10
- •Билет 11
- •1. Витамин в6(пиридоксин, пиридоксаль, пиридоксамин)
- •3 Существуют три источника аминокислот в клетке – поступление из крови, распад собственных внутриклеточных белков и синтез заменимых аминокислот.
- •Билет 12
- •1.Биотин
- •2. Нарушение обмена гликогена
- •3. Существуют три источника аминокислот в клетке – поступление из крови, распад собственных внутриклеточных белков и синтез заменимых аминокислот.
- •Билет 13. Фолиевая кислота. Биологическая роль. Пути поступления в организм. Коферментная функция.
- •2.Катаболизм триацилглицеролов. Реакции, механизм регуляции активности триглицеридлипазы. Нейрогуморальная регуляция липолиза (адреналин, глюкагон, инсулин).
- •3.Трансаминирование амк. Аминотрансферазы. Отдельные аминотрансферазы. Реакции. Биохимическое значение трансаминирования амк.
- •Билет 14
- •1.Витамин в12. Биологическая роль. Пути попадания в организм. Коферментная функция.
- •3.Пути превращения аммиака в организме человека. Механизмы обезвреживания аммиака.
- •Билет №15
- •1.Витамин с.
- •2.Окисление пальмитиновой кослоты.
- •3.Биосинтез мочевины.
- •Билет №16
- •1.Витамин а.
- •2.Окисление ненасыщенных жирных кислот.
- •3.Превращение безазотистого скелета ак
- •Билет №17
- •1.Витамин д
- •2. Биосинтез высших жирных кислот.
- •3. Метаболизм ак с разветвленной цепью.
- •Билет №25 Репликация днк
- •Свойства процесса репликации:
- •Желчные кислоты
- •Стероидные гормоны
- •2.Специализированные пути метаболизма цикл. А,к- фенилаланина и тирозина.. Заболевания, связанные с нарушением обмена фенилаланина и тирозина.
- •3.Биосинтез гема
- •Билет 19
- •2.Биосинтез пуриновых нуклеотидов
- •3.Основные закономерности генетического кода. Адапторная гипотеза ф. Крика и её развитие в wobble-гипотезе.
- •Билет №20
- •2. Кинетика ферменативного катализа. График зависимости скорости ферментативной реакции от концентрации субстрата при постоянной концентрации фермента.
- •Билет №21
- •Транскрипционные факторы: Механизмы действия тф , связавающиеся с днк, могут влиять на транскрипцию генов через несколько механизмов:
- •Билет№22
- •Билет 23
- •2. Полное окисление глюкозы. Энергетический баланс полного окисления глюкозы.
- •Билет№24
- •1.Антибиотические вещества, подавляющие синтез белка
- •24.2 Функционирование малат-аспартатного и глицерофосфатного шунта.
- •Билет №26
- •3. Окисление капроновой кислоты
- •Билет №27
- •Репликация
- •Билет 28
- •Билет29
- •29.2.Метаболизм аминокислот
- •Билет №30
- •1.Особенности молекулярной организации и экспрессии генома эукариот (экзоны, интроны, сплайсинг)
- •2.Образование кетоновых тел и их утилизация.
- •3.Цикл трикарбоновых кислот. Реакции
Билет№7
1.Опять ферменты
ЕДИНИЦА АКТИВНОСТИ ФЕРМЕНТА
выражение активности фермента в каталах (кат, kat): 1 кат есть каталитическая активность, способная осуществлять реакцию со скоростью, равной 1 молю в 1 с (1 моль/с).
УДЕЛЬНАЯ АКТИВНОСТЬ ФЕРМЕНТА
Для выражения активности в практической работе с ферментами часто пользуются произвольными понятиями удельной и молярной активности. Удельную активность фермента принято выражать числом единиц ферментативной активности на 1 мг белка (или числом каталов на 1 кг активного белка).
МОЛЯРНАЯ АКТИВНОСТЬ ФЕРМЕНТА
Количество молекул субстрата, подвергающихся превращению одной молекулой фермента в продукт в процессе реакции в единицу времени при полном насыщении фермента субстратом, принято называть числом оборотов фермента, или молярной активностью (молярная каталитическая активность выражается в каталах на 1 г-моль фермента).
2. Ингибиторы и разъединители транспорта электронов окислительного фосфорилирования
Окислительное фосфорилирование — один из важнейших компонентов клеточного дыхания, приводящего к получению энергии в виде АТФ. Субстратами окислительного фосфорилирования служат продукты расщепления органических соединений — белки, жиры и углеводы. Однако чаще всего в качестве субстрата используются углеводы.
Процесс окислительного фосфорилирования осуществляется пятым комплексом дыхательной цепи митохондрий — Протонная АТФ-синтаза, состоящая из 9 субъединиц 5 типов. На внутренней мембране митохондрий также находится переносчик Фосфата из цитоплазмы в митохондрию, но для его работы необходим протон водорода. Такие переносчики называются транслоказами.
Ингибиторы блокируют V комплекс:
- Олигомицин — блокируют протонные каналы АТФ-синтазы.
- Атрактилозид, циклофиллин — блокируют транслоказы.
Разобщители — липофильные вещества, которые способны принимать протоны и переносить их через внутреннюю мембрану митохондрий минуя V комплекс (его протонный канал). Разобщители:
Естественные — продукты перекисного окисления липидов, жирных кислот с длинной цепью; большие дозы тиреоидных гормонов.
Искусственные — динитрофенол, эфир, производные витамина К, анестетики.
3.Глюконеогенез
— процесс образования в печени и отчасти в корковом веществе почек (около 10 %) молекул глюкозы из молекул других органических соединений — источников энергии, например свободных аминокислот, молочной кислоты, глицерина. Свободные жирные кислоты у млекопитающих для глюконеогенеза не используются.
Глюконеогенез : субстраты, ферменты, регуляция и биологическая роль процесса.
Глюконеогенез - процесс синтеза глюкозы из веществ неуглеводной природы. Его основной функцией является поддержание уровня глюкозы в крови в период длительного голодания и интенсивных физических нагрузок. Процесс протекает в основном в печени и менее интенсивно в корковом веществе почек, а также в слизистой оболочке кишечника. Эти ткани могут обеспечивать синтез 80-100 г глюкозы в сутки. На долю мозга при голодании приходится большая часть потребности организма в глюкозе. Это объясняется тем, что клетки мозга не способны, в отличие от других тканей, обеспечивать потребности в энергии за счёт окисления жирных кислот.
Кроме мозга, в глюкозе нуждаются ткани и клетки, в которых аэробный путь распада невозможен или ограничен, например эритроциты (они лишены митохондрий), клетки сетчатки, мозгового слоя надпочечников и др.
Первичные субстраты глюконеогенеза - лактат, аминокислоты и глицерол. Включение этих субстратов в глюконеогенез зависит от физиологического состояния организма.
Лактат - продукт анаэробного гликолиза. Он образуется при любых состояниях организма в эритроцитах и работающих мышцах. Таким образом, лактат используется в глюконеогенезе постоянно.
Глицерол высвобождается при гидролизе жиров в жировой ткани в период голодания или при длительной физической нагрузке.
Аминокислоты образуются в результате распада мышечных белков и включаются в глюконеогенез при длительном голодании или продолжительной мышечной работе.
Большинство реакций глюконеогенеза протекает за счёт обратимых реакций гликолиза и катализируется теми же ферментами. Однако 3 реакции гликолиза термодинамически необратимы. На этих стадиях реакции глюконеогенеза протекают другими путями.
Необходимо отметить, что гликолиз протекает в цитозоле, а часть реакций глюконеогенеза происходит в митохондриях.
1. Образование фосфоенолпирувата
из пирувата - первая из необратимых
стадий глюконеогенеза
Образование фосфоенолпирувата из пирувата происходит в ходе двух реакций, первая из которых протекает в митохондриях. Пируват, образующийся из лактата или из некоторых аминокислот, транспортируется в матрикс митохондрий и там карбоксилируется с образованием оксалоацетата.
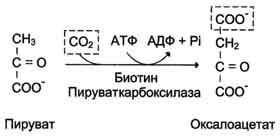
Пируват-карбоксилаза, катализирующая данную реакцию, - митохондриальный фермент, коферментом которого является биотин. Реакция протекает с использованием АТФ.
Дальнейшие превращения оксалоацетата протекают в цитозоле. Следовательно, на этом этапе должна существовать система транспорта оксалоацетата через митохондриальную мембрану, которая для него непроницаема. Оксалоацетат в митохондриальном матриксе восстанавливается с образованием маната
 при
участии NADH (обратная реакция цитратного
цикла). Образовавшийся малат затем
проходит через митохондриальную мембрану
с помощью специальных переносчиков.
Кроме того, оксалоацетат способен
транспортироваться из митохондрий в
цитозоль в виде аспартата в ходе
малат-аспартатного челночного механизма.
при
участии NADH (обратная реакция цитратного
цикла). Образовавшийся малат затем
проходит через митохондриальную мембрану
с помощью специальных переносчиков.
Кроме того, оксалоацетат способен
транспортироваться из митохондрий в
цитозоль в виде аспартата в ходе
малат-аспартатного челночного механизма.
В цитозоле малат вновь превращается в оксалоацетат в ходе реакции окисления с участием кофермента NAD+. Обе реакции: восстановление оксалоацетата и окисление малага катализируют малатдегидрогеназа, но в первом случае это митохондриальный фермент, а во втором - цитозольный. Образованный в цитозоле из ма-лата оксалоацетат затем превращается в фосфоенолпируват в ходе реакции, катализируемой фосфоенолпируваткарбоксикиназой - ГТФ-зависимым ферментом.
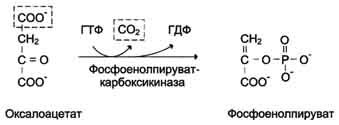
В пересчёте на синтез одной молекулы глюкозы из двух молекул пирувата расход составляет 2 моль АТФ и 2 моль ГТФ или 4 моль АТФ (для удобства рассуждений предлагается считать, что энергозатраты на синтез АТФ и ГТФ равны). После образования фосфоенолпирувата все остальные реакции также протекают в цитозоле вплоть до образования фруктозо-1,6-бисфосфата и катализируются гликолитическими ферментами.
2. Гидролиз фруктозо-1,6-бисфосфата
и глюкоза-6-фосфата
Отщепление фосфатной группы из фруктозо-1,6-бисфосфата и глюкозо-6-фосфата - также необратимые реакции глюконеогенеза. В ходе гликолиза эти реакции катализируют специфические киназы с использованием энергии АТФ. В глюконеогенезе они протекают без участия АТФ и АДФ и ускоряются не киназами, а фосфатазами - ферментами, принадлежащими к классу гидролаз. Ферменты фруктозо-1,6-бисфосфатаза и глюкозо-6-фосфатаза катализируют отщепление фосфатной группы от фруктозо-1,6-бисфосфата и глюкозо-6-фосфата. После чего свободная глюкоза выходит из клетки в кровь.
Итак, в печени существуют 4 фермента, которые принимают участие только в глюконеогенезе и катализируют обходные реакции необратимых стадий гликолиза. Это - пируват-карбоксилаза, фосфоенолпируваткарбоксикиназа, фруктозе-1,6-бисфосфатаза и глюкозо-6-фосфатаза.
Суммарный результат глюконеогенеза из пирувата выражается следующим уравнением:
2 Пируват + 4 АТФ + 2 ГТФ + 2 (NADH + Н+)+ 4 Н20 → Глюкоза + 4 АДФ + 2 ГДФ + 6 H3PO4 + 2 NAD+
СУБСТРАТЫ
РЕАКЦИИ
РЕГУЛЯЦИЯ
