- •Содержание
- •Билет №1
- •2. Определение катаболизма. Катаболизм и анаболизм. Стадии катаболизма биомолекул в организме.
- •Билет№2.
- •1.Ферменты. Специфичность ферментов. Активный центр фермента.
- •2.Экзергонические и эндергонические биохимические реакции. Роль атф и других макроэргических фосфатов в сопряжении экзергонических процессов и эндергонических процессов.
- •3.Пути внутриклеточного метаболизма глюкозы. Гликолиз и глюконеогенез. Обратимые и необратимые реакции.
- •Билет №3
- •1.Регуляция активности ферментов. Проферменты. Изоферменты. Ингибиторы ферментов.
- •2.Реакции биологичемкого окисления.Типы реакций( дегидрогеназные, оксидазные, оксигеназные. Их биологическое значение.
- •3 Цитохромы Катализируют окисление веществ путем отдачи электронов Гемовое железо в одном из цитохромов имеется так же атом меди.
- •Билет№4
- •1.Ферментативный катализ
- •2.Митохондриальный транспорт
- •3.Аэробное окисление пирувата (окислительное декарбоксилирование пировиноградной кты).
- •Билет№5
- •1.Кинетика ферментативного катализа. Уравнение Михаэлиса-Ментен. Уравнение Лайнуивера-Берка.
- •2.Окислительное фосфорилирование. Пункты сопряжения окисления и фосфорилирования. Атф-синтетаза митохондрий.
- •3 Субъединицы (γ,δ,ε) способствуют целостности атф-синтазы
- •3.Полное окисление глюкозы. Энергетический баланс
- •Билет№6
- •1.Аллостерические ферменты. Ингибиторы и активаторы аллостерических ферментов. Аллостерические центры.
- •Деградация жирных кислот: β-окисление
- •Билет№7
- •1.Опять ферменты
- •2. Ингибиторы и разъединители транспорта электронов окислительного фосфорилирования
- •3.Глюконеогенез
- •Билет №8
- •1. Витамины
- •2. Микросомальная цепь транспорта электронов
- •3. Глюкозолактонный цикл
- •1. Витамин в2
- •3.Гипергликемия
- •Билет 10
- •Билет 11
- •1. Витамин в6(пиридоксин, пиридоксаль, пиридоксамин)
- •3 Существуют три источника аминокислот в клетке – поступление из крови, распад собственных внутриклеточных белков и синтез заменимых аминокислот.
- •Билет 12
- •1.Биотин
- •2. Нарушение обмена гликогена
- •3. Существуют три источника аминокислот в клетке – поступление из крови, распад собственных внутриклеточных белков и синтез заменимых аминокислот.
- •Билет 13. Фолиевая кислота. Биологическая роль. Пути поступления в организм. Коферментная функция.
- •2.Катаболизм триацилглицеролов. Реакции, механизм регуляции активности триглицеридлипазы. Нейрогуморальная регуляция липолиза (адреналин, глюкагон, инсулин).
- •3.Трансаминирование амк. Аминотрансферазы. Отдельные аминотрансферазы. Реакции. Биохимическое значение трансаминирования амк.
- •Билет 14
- •1.Витамин в12. Биологическая роль. Пути попадания в организм. Коферментная функция.
- •3.Пути превращения аммиака в организме человека. Механизмы обезвреживания аммиака.
- •Билет №15
- •1.Витамин с.
- •2.Окисление пальмитиновой кослоты.
- •3.Биосинтез мочевины.
- •Билет №16
- •1.Витамин а.
- •2.Окисление ненасыщенных жирных кислот.
- •3.Превращение безазотистого скелета ак
- •Билет №17
- •1.Витамин д
- •2. Биосинтез высших жирных кислот.
- •3. Метаболизм ак с разветвленной цепью.
- •Билет №25 Репликация днк
- •Свойства процесса репликации:
- •Желчные кислоты
- •Стероидные гормоны
- •2.Специализированные пути метаболизма цикл. А,к- фенилаланина и тирозина.. Заболевания, связанные с нарушением обмена фенилаланина и тирозина.
- •3.Биосинтез гема
- •Билет 19
- •2.Биосинтез пуриновых нуклеотидов
- •3.Основные закономерности генетического кода. Адапторная гипотеза ф. Крика и её развитие в wobble-гипотезе.
- •Билет №20
- •2. Кинетика ферменативного катализа. График зависимости скорости ферментативной реакции от концентрации субстрата при постоянной концентрации фермента.
- •Билет №21
- •Транскрипционные факторы: Механизмы действия тф , связавающиеся с днк, могут влиять на транскрипцию генов через несколько механизмов:
- •Билет№22
- •Билет 23
- •2. Полное окисление глюкозы. Энергетический баланс полного окисления глюкозы.
- •Билет№24
- •1.Антибиотические вещества, подавляющие синтез белка
- •24.2 Функционирование малат-аспартатного и глицерофосфатного шунта.
- •Билет №26
- •3. Окисление капроновой кислоты
- •Билет №27
- •Репликация
- •Билет 28
- •Билет29
- •29.2.Метаболизм аминокислот
- •Билет №30
- •1.Особенности молекулярной организации и экспрессии генома эукариот (экзоны, интроны, сплайсинг)
- •2.Образование кетоновых тел и их утилизация.
- •3.Цикл трикарбоновых кислот. Реакции
24.2 Функционирование малат-аспартатного и глицерофосфатного шунта.
Обмен восстановительными эквивалентами между цитозолем и митохондриями может идти в обоих направлениях, определяя пути их переноса между митохондриальным и цитозольным компартментами.
Экспорт НАДН из цитозоля в митохондрии в изолированных гепатоцитах, так же как и в перфузируемой печени, осуществляется помощью трех челночных механизмов — малат-аспартатного и алицерофосфатного шунтов, а также шунта длинноцепочечных жирных кислот, связанного с бета-окислением.
Образуемый в цитозоле гепатоцитов НАДН реоксидируется главным образом во внутренней мембране митохондрий с помощью малат-аспартатного шунта. В результате его активности происходит поступление малата в митохондрии, окисление цитозольного пула НАДН малатдегидрогеназой, трансаминирование внутримитохондриального оксалоацетата аспартатаминотрансферазой, сопровождаемое оттоком аспартата и альфа-кетоглутарата в цитозоль и антипортным поступлением глутамата в митохондрии. Трансаминирование аспартата и альфа-кетоглутарата в цитозоле с регенерацией глутамата и оксалоацетата завершают цикл. Возможности такого механизма обмена восстановительными эквивалентами в гепатоцитах показаны разными исследователями. Ранее считалось, что этот шунт легко обратим за счет того, что трансаминирование, дегидрогенизация и транспорт метаболитов симметричны в двух компартментах клетки. Но тогда трудно объяснить, почему отношение НАДН/НАД+ в митохондриях, водная фаза вторых составляет всего 10% от общего объема клетки, больше, чем в растворимой фазе цитозоля. Это противоречие стало понятным, когда было обнаружено, что аспартат активно транспортируется из митохондрий в обмен на глутамат с сопутствующим переносом одного протона в митохондрии. Движущей силой этого обмена является трансмембранный электрический потенциал, зависящий от функции дыхательной цепи. Это же является причиной того, что поступление аспартата из цитозоля в митохондрии протекает очень медленно, в связи с чем экспорт НАДН из митохондрий в цитозоль с помощью малат-аспартатного шунта практически невозможен.
Вторым существенным механизмом переноса восстановительных эквивалентов в гепатоцитах из цитозоля в митохондрии является альфа-глицерофосфатный шунт. Он не связан с транспортом анионов через плазматическую мембрану, так как роль субстрат-связывающего фактора в этом случае на внешней стороне внутренней мембраны митохондрий выполняет флавиновый фермент альфа-глицерофосфатдегидрогеназа. Его мощность в гепатоцитах составляет примерно 1/3 от мощности малат-аспартатного шунта. Оба эти шунта могут использоваться в гепатоцитах одновременно. Их роль установлена также при инициации глюконеогенеза ксилитолом или сорбитолом в цикле мочевины и при окислении этанола. Во всех этих случаях осуществляется экспорт НАДН из цитозоля в митохондрии.
Импорт НАДН в цитозоль из митохондрий гепатоцитов происходит только в случае глюконеогенеза из пирувата. Он реализуется с помощью малат-пируватного шунта. Оксалоацетат — продукт карбоксилирования пирувата в митохондриях — при физиологических концентрациях транспортируется через митохондриальную мембрану с очень низкой скоростью. Поэтому его отток из митохондрий по кинетическим причинам не может конкурировать со скоростью оттока малата в цитозоль, где из малата снова происходит образование оксалоацетата в малатдегидрогеназной реакции, его последующая конверсия в фосфоенолпируват, а затем в пируват, поступление пирувата в митохондрии и карбоксилирование последнего с восстановлением до малата.
Одно из обязательных звеньев глюконеогенеза — НАД-зависимая реакция. Если предшественником глюконеогенеза является лактат, НАДН в гепатоцитах образуется путем прямой дисмутации лактата в глицеральдегид-3-фосфатдегидрогеназной реакции. Однако в присутствии экзогенного пирувата источником цитозольного АДН является транспорт восстановительных эквивалентов из митохондрий. Малат-аспартатный шунт в таких условиях не может осуществить этот перенос из-за очень низкой скорости транспорта аспартата из цитозоля. Поэтому он реализуется в циклической энергозависимой регенерации пирувата фосфоенолпируваткарбоксилазой и пируваткиназой (на 1 моль образующегося внемитохондриального НАДН потребляется 1 моль АТФ). Если предшественниками глюконеогенеза являются аминокислоты, например аланин, восстановительные эквиваленты не генерируются в цитозоле в дегидрогеназных реакциях. Вместо этого в гепатоцитах осуществляется непрямая их генерация за счет конверсии аспартата в малат в реакции цикла мочевины.
Что касается НАДФН, то в настоящее время достоверно описана лишь одна возможность однонаправленного его экспорта из митохондрий в цитозоль в условиях активации НАДФН-зависимых реакций во внемитохондриальном компартменте при его дефиците в нем (истощение по гликогену, активация системы микросомального окисления). В этом случае используется цитрат-альфа-кетоглутаратный шунт.
Таким образом, регуляция редокс-состояний в двух компартментах осуществляется путем двустороннего обмена НАДФН преимущественно за счет работы челночных механизмов транспорта анионов. Подтверждением этому служат не только ингибиторный анализ и очевидная компартментализация метаболитов, участвующих в работе шунтов, но и высокая способность клетки к перераспределению концентрационных градиентов при изменении направления метаболических потоков.
25 2 Синтез пальмитиновой кислоты Реакции. Мультиферментный комплекс, называемый синтетазой (синтазой) жирных кислот, состоит из 6 ферментов, связанных с так называемым ацилпереносящим белком (АПБ). Этот белок относительно термостабилен, имеет две свободные HS-группы (цистеина и фосфопантетеинового остатка, присоединенного к ОН-группе серина) и вовлекается в процесс синтеза высших жирных кислот практически на всех его этапах. Мол. масса АПБ составляет около 10000. Данный белок в синтетазной системе выполняет роль КоА. Заметим, что в животных тканях не удалось обнаружить свободного АПБ, подобного микробному. Из печени выделен полиэнзимный комплекс, содержащий все энзимы, необходимые для синтеза жирных кислот. Энзимы комплекса настолько прочно связаны друг с другом, что все попытки изолировать их в индивидуальном виде не увенчались успехом. Приводим последовательность реакций, происходящих при синтезе жирных кислот:
Далее цикл реакций повторяется. Допустим, что идет синтез пальмитиновой кислоты (С16). В этом случае образованием бутирил-АПБ завершается лишь первый из 7 циклов, в каждом из которых началом является присоединение молекулы малонил-АПБ к карбоксильному концу растущей цепи жирной кислоты. При этом отщепляется дистальная карбоксильная группа малонил-АПБ в виде СО2. Например, образовавшийся в первом цикле бутирил-АПБ взаимодействует с малонил-АПБ:
Завершается синтез жирной кислоты отщеплением HS-АПБ от ацил-АПБ под влиянием фермента деацилазы. Например:
Суммарное уравнение синтеза пальмитиновой кислоты можно записать так:
Или, учитывая, что на образование одной молекулы малонил-КоА из ацетил-КоА расходуются одна молекула АТФ и одна молекула СО2, которая затем отщепляется, суммарное уравнение можно представить в следующем виде:
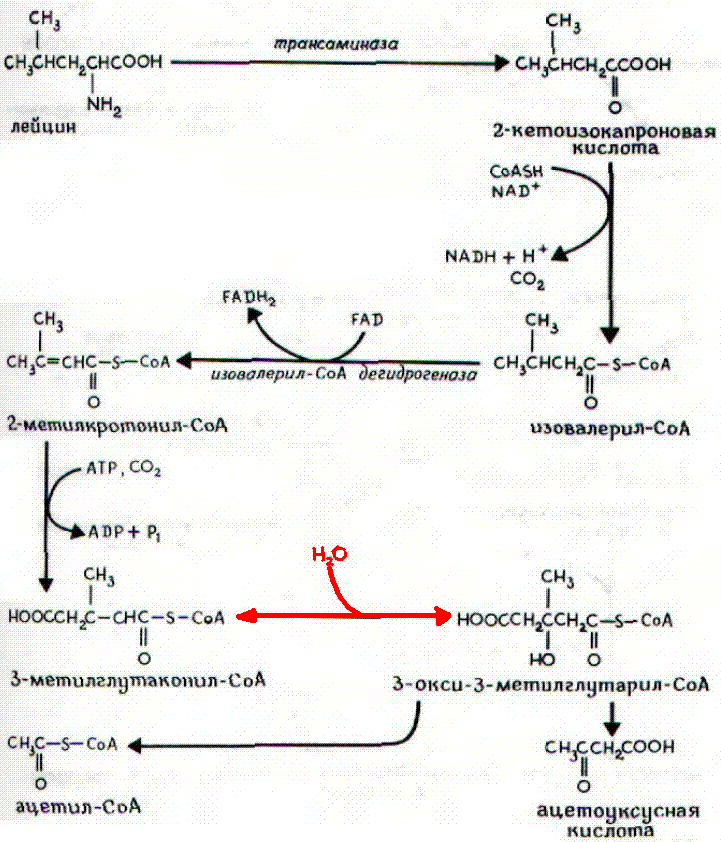
3.Катаболизм аминокислот с разветвленной цепью: лейцина, изолейцина и валина – преимущественно осуществляется не в печени (место распада большинства остальных аминокислот), а в мышечной и жировой тканях, в почках и ткани мозга. Сначала все три аминокислоты подвергаются трансаминированию с α-кетоглутаратом под действием одного общего и специфического фермента – аминотрансферазы аминокислот с разветвленной цепью (КФ 2.6.1.42) (не содержится в печени) с образованием соответствующих α-кетокислот. Последующее окислительное декарбокси-лирование α-кетокислот приводит к образованию ацил-КоА-производных.
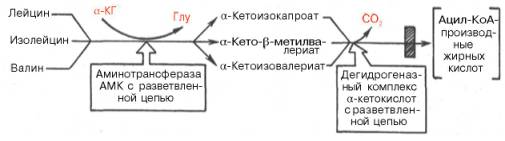
Следует отметить, что фермент, катализирующий окислительное де-карбоксилирование указанных α-кетокислот, высокоспецифичен (по аналогии с пируватдегидрогеназным и α-кетоглутаратдегидрогеназным комплексами) и также нуждается в присутствии всех пяти кофакторов (см. главу 10). Известно наследственное заболевание «болезнь кленового сиропа», при которой нарушено декарбоксилирование указанных α-кетокислот (вследствие синтеза дефектного дегидрогеназного комплекса), что приводит не только к накоплению в крови аминокислот и α-кетокислот, но и к их экскреции с мочой, издающей запах кленового сиропа. Болезнь встречается редко, проявляется обычно в раннем детском возрасте и приводит к нарушению функции мозга и летальному исходу, если не ограничить или полностью не исключить поступление с пищей лейцина, изолейцина и валина.
Пример – лейцин