
- •Содержание
- •Билет №1
- •2. Определение катаболизма. Катаболизм и анаболизм. Стадии катаболизма биомолекул в организме.
- •Билет№2.
- •1.Ферменты. Специфичность ферментов. Активный центр фермента.
- •2.Экзергонические и эндергонические биохимические реакции. Роль атф и других макроэргических фосфатов в сопряжении экзергонических процессов и эндергонических процессов.
- •3.Пути внутриклеточного метаболизма глюкозы. Гликолиз и глюконеогенез. Обратимые и необратимые реакции.
- •Билет №3
- •1.Регуляция активности ферментов. Проферменты. Изоферменты. Ингибиторы ферментов.
- •2.Реакции биологичемкого окисления.Типы реакций( дегидрогеназные, оксидазные, оксигеназные. Их биологическое значение.
- •3 Цитохромы Катализируют окисление веществ путем отдачи электронов Гемовое железо в одном из цитохромов имеется так же атом меди.
- •Билет№4
- •1.Ферментативный катализ
- •2.Митохондриальный транспорт
- •3.Аэробное окисление пирувата (окислительное декарбоксилирование пировиноградной кты).
- •Билет№5
- •1.Кинетика ферментативного катализа. Уравнение Михаэлиса-Ментен. Уравнение Лайнуивера-Берка.
- •2.Окислительное фосфорилирование. Пункты сопряжения окисления и фосфорилирования. Атф-синтетаза митохондрий.
- •3 Субъединицы (γ,δ,ε) способствуют целостности атф-синтазы
- •3.Полное окисление глюкозы. Энергетический баланс
- •Билет№6
- •1.Аллостерические ферменты. Ингибиторы и активаторы аллостерических ферментов. Аллостерические центры.
- •Деградация жирных кислот: β-окисление
- •Билет№7
- •1.Опять ферменты
- •2. Ингибиторы и разъединители транспорта электронов окислительного фосфорилирования
- •3.Глюконеогенез
- •Билет №8
- •1. Витамины
- •2. Микросомальная цепь транспорта электронов
- •3. Глюкозолактонный цикл
- •1. Витамин в2
- •3.Гипергликемия
- •Билет 10
- •Билет 11
- •1. Витамин в6(пиридоксин, пиридоксаль, пиридоксамин)
- •3 Существуют три источника аминокислот в клетке – поступление из крови, распад собственных внутриклеточных белков и синтез заменимых аминокислот.
- •Билет 12
- •1.Биотин
- •2. Нарушение обмена гликогена
- •3. Существуют три источника аминокислот в клетке – поступление из крови, распад собственных внутриклеточных белков и синтез заменимых аминокислот.
- •Билет 13. Фолиевая кислота. Биологическая роль. Пути поступления в организм. Коферментная функция.
- •2.Катаболизм триацилглицеролов. Реакции, механизм регуляции активности триглицеридлипазы. Нейрогуморальная регуляция липолиза (адреналин, глюкагон, инсулин).
- •3.Трансаминирование амк. Аминотрансферазы. Отдельные аминотрансферазы. Реакции. Биохимическое значение трансаминирования амк.
- •Билет 14
- •1.Витамин в12. Биологическая роль. Пути попадания в организм. Коферментная функция.
- •3.Пути превращения аммиака в организме человека. Механизмы обезвреживания аммиака.
- •Билет №15
- •1.Витамин с.
- •2.Окисление пальмитиновой кослоты.
- •3.Биосинтез мочевины.
- •Билет №16
- •1.Витамин а.
- •2.Окисление ненасыщенных жирных кислот.
- •3.Превращение безазотистого скелета ак
- •Билет №17
- •1.Витамин д
- •2. Биосинтез высших жирных кислот.
- •3. Метаболизм ак с разветвленной цепью.
- •Билет №25 Репликация днк
- •Свойства процесса репликации:
- •Желчные кислоты
- •Стероидные гормоны
- •2.Специализированные пути метаболизма цикл. А,к- фенилаланина и тирозина.. Заболевания, связанные с нарушением обмена фенилаланина и тирозина.
- •3.Биосинтез гема
- •Билет 19
- •2.Биосинтез пуриновых нуклеотидов
- •3.Основные закономерности генетического кода. Адапторная гипотеза ф. Крика и её развитие в wobble-гипотезе.
- •Билет №20
- •2. Кинетика ферменативного катализа. График зависимости скорости ферментативной реакции от концентрации субстрата при постоянной концентрации фермента.
- •Билет №21
- •Транскрипционные факторы: Механизмы действия тф , связавающиеся с днк, могут влиять на транскрипцию генов через несколько механизмов:
- •Билет№22
- •Билет 23
- •2. Полное окисление глюкозы. Энергетический баланс полного окисления глюкозы.
- •Билет№24
- •1.Антибиотические вещества, подавляющие синтез белка
- •24.2 Функционирование малат-аспартатного и глицерофосфатного шунта.
- •Билет №26
- •3. Окисление капроновой кислоты
- •Билет №27
- •Репликация
- •Билет 28
- •Билет29
- •29.2.Метаболизм аминокислот
- •Билет №30
- •1.Особенности молекулярной организации и экспрессии генома эукариот (экзоны, интроны, сплайсинг)
- •2.Образование кетоновых тел и их утилизация.
- •3.Цикл трикарбоновых кислот. Реакции
2. Кинетика ферменативного катализа. График зависимости скорости ферментативной реакции от концентрации субстрата при постоянной концентрации фермента.
Кинетика изучает влияние разных факторов на скорость реакции. Скорость ферментативной реакции (У) измеряют по убыли субстрата или приросту продукта за единицу времени.
Влияние концентрации фермента на скорость реакции: если концентрация субстрата постоянна, то скорость реакции пропорциональна концентрации фермента (рис. 2.11, а).
Влияние концентрации субстрата на скорость ферментативной реакции: график зависимости скорости ферментативной реакции от концентрации субстрата имеет вид гиперболы (рис. 2.11, б), как, например, кривая насыщения миоглобина кислородом.
Измеряют скорость реакции почти сразу после начала реакции (начальную скорость) во избежание осложнений зависящих, например, от уменьшения концентрации субстрата, обратимости реакции или образования тормозящих реакцию продуктов.
Интервал времени, в течение которого скорость реакции равна начальной скорости или близка к ней, соответствует прямолинейному участку графика зависимости скорости реакции от времени (рис. 2.12).
При высокой концентрации субстрата, когда все молекулы фермента находятся в форме фермент-субстратного комплекса, достигается полное насыщение активных центров фермента субстратом, а скорость реакции становится максимальной (VMaKC).
При полунасыщении, когда половина молекул фермента находится в форме ES, скорость реакции равна половине максимальной (1/2 VMaKC). Концентрация субстрата, при которой достигается Vi VMaKC, дает численную величину константы Михаэлиса (4. Константа Михаэлиса Км и максимальная скорость реакции VMaKC — важные характеристики скорости при разных концентрациях субстрата, как указано на рис. 2.13.
VMaKC — величина, постоянная для каждого фермента, которая позволяет оценить эффективность его действия.
Км показывает сродство фермента к субстрату; чем меньше ее значение, тем больше сродство.
Изоферменты могут различаться по значению Км (для изоферментов глюкокиназы и гексокиназы значение Км различается в 50 раз, и это объясняет их различную физиологическую функцию; см. рис. 2.16).
Если реакция обратима, то взаимодействие фермента с субстратом прямой реакции характеризуется Км, отличающейся от таковой для субстрата обратной реакции (например, карбангидраза для С02 имеет Км, равную 1,2-10-2 М, а для НСО3-KM больше и равна 2,6-10-2 М).
--------------------------------------------------------------------------------------------------------------------------
Простейшая схема ферментативного катализа включает обратимое образование промежуточного комплекса фермента (E) с реагирующим веществом (субстратом, S) и разрушение этого комплекса с образованием продуктов реакции (P):
Применение квазиравновесного приближения к этой схеме (при условии k2 << k-1) с учетом уравнения материального баланса [E] = [E]0 - [ES] (индекс "0" обозначает начальную концентрацию) позволяет выразить скорость образования продукта через начальную концентрацию фермента и текущую концентрацию субстрата:
где KS = k-1 / k1 = [E]. [S] / [ES] - субстратная константа. При увеличении концентрации субстрата скорость реакции стремится к предельному значению: wmax = k2. [E]0. Скорость реакции связана с максимальной скоростью соотношением:
(7.1)
Обычно в эксперименте измеряют зависимость начальной скорости ферментативной реакции от начальной концентрации субстрата: w0 = f([S]0). Проведение таких измерений для ряда начальных концентраций позволяет определить параметры уравнения (7.1) - KS и wmax.
Чаще всего для анализа кинетических схем ферментативного катализа используют метод стационарных концентраций (k2 >> k1). Применение этого метода к простейшей схеме катализа дает уравнение Михаэлиса-Ментен:
(7.2)
где wmax = k2. [E]0 - максимальная скорость реакции (при бесконечно большой концентрации субстрата),
- константа Михаэлиса. Эта константа равна концентрации субстрата, при которой скорость реакции равна половине максимальной скорости. Типичные значения KM - от 10-6 до 10-1 моль/л. Константу скорости k2 иногда называют числом оборотов фермента. Она может изменяться в пределах от 10 до 108 мин-1.
Для практического определения кинетических параметров этот график неудобен, к тому же требует использования концентраций субстрата, «насыщающих» фермент, что не всегда достижимо при ограниченной растворимости субстрата. Поэтому обычно стремятся преобразовать уравнение Михаэлиса-Ментен в такую форму, чтобы графически оно изображалось прямой линией. Чаще всего для этого используют метод Лайнуивера-Берка, представляя уравнение Михаэлиса-Ментен в виде уравнения прямой линии:
Последнее выражение называют уравнением Лайнуивера-Берка и для расчета кинетических параметров используют график, построенный в координатах: 1/V против 1/S. В результате получается прямая, отсекающая на оси ординат отрезок, равный 1/V, а на продолжении оси абсцисс отрезок, равный - 1/Кга. Однако следует отметить, что при использовании графика Лайнуивера-Берка точки в области высоких концентраций субстрата располагаются слишком густо, а положение прямой линии во многом зависит от точек в области низких концентраций субстрата, где определение скорости менее надежно. Кроме того, реальные экспериментальные данные не всегда адекватно аппроксимируются в виде прямой линии:
3.Дезаминирование аминокислот - реакция отщепления α-аминогруппы от аминокислоты, в результате чего образуется соответствующая α-кетокислота (безазотистый остаток) и выделяется молекула аммиака. Аммиак токсичен для ЦНС, поэтому в организме человека и млекопитающих он превращается в нетоксичное хорошо растворимое соединение - мочевину. В виде мочевины, а также в виде солей аммония аммиак выводится из организма. Безазотистый остаток используется для образования аминокислот в реакциях трансаминирования,
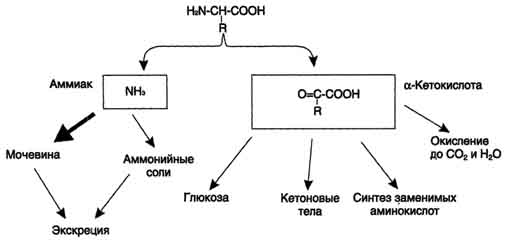
Рис. 9-7. Судьба продуктов дезаминирования аминокислот.
в процессах глюконеогенеза, кето-генеза, в анаплеротических реакциях для восполнения убыли метаболитов ОПК, в реакциях окисления до СО2 и Н2О.
Существует несколько способов дезаминирования аминокислот:
окислительное;
непрямое (трансдезаминирование);
неокислительное;
внутримолекулярное.
Непрямое дезаминирование (трансдезаминирование)
Большинство аминокислот не способно дезаминироваться в одну стадию, подобно Глу. Аминогруппы таких аминокислот в результате трансаминирования переносятся на α-кетоглутарат с образованием глутаминовой кислоты, которая затем подвергается прямому окислительному дезаминированию. Такой механизм дезаминирования аминокислот в 2 стадии получил название трансдезаминирования, или непрямого дезаминирования:
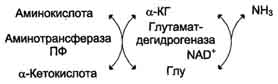
Непрямое дезаминирование аминокислот происходит при участии 2 ферментов: аминотрансферазы (кофермент ПФ) и глутаматдегидрогеназы (кофермент NAD+).
Значение этих реакций в обмене аминокислот очень велико, так как непрямое дезаминирование - основной способ дезаминирования большинства аминокислот. Обе стадии непрямого дезаминирования обратимы (рис. 9-9), что обеспечивает как катаболизм аминокислот (рис. 9-9, А), так и возможность образования практически любой аминокислоты из соответствующей α-кетокислоты (рис. 9-9, Б).
В мышечной ткани активность глутаматдегидрогеназы низка, поэтому в этих клетках при интенсивной физической нагрузке функционирует ещё один путь непрямого дезаминирования с участием цикла ИМФ-АМФ. Вначале происходит перенос аминогруппы аминокислот на аспартат, затем на инозиновую кислоту (ИМФ) и в завершение - дезаминирование АМФ. Представленная схема отражает последовательность реакций непрямого неокислительного дезаминирования:
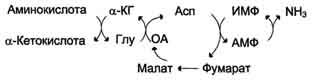
Можно выделить 4 стадии процесса:
трансаминирование с α-кетоглутаратом, образование глутамата;
трансаминирование глутамата с оксалоацета-том (фермент ACT), образование аспартата;
реакция переноса аминогруппы от аспартата на ИМФ (инозинмонофосфат), образование АМФ и фумарата;
гидролитическое дезаминирование АМФ.
Перенос аминогруппы от аспартата и синтез АМФ происходят следующим образом (см. схему А на с. 476).
Реакция дезаминирования адениловой кислоты происходит под действием фермента АМФ дезаминазы(см. схему Б на с. 476).
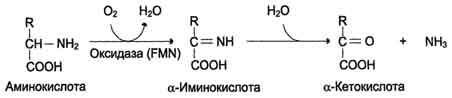
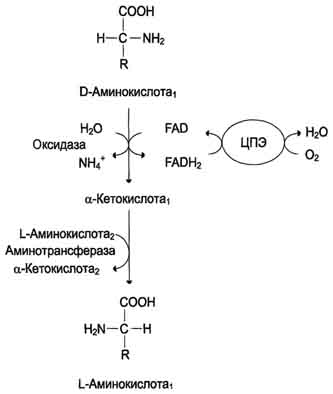
Рис. 9-8. Биологическая роль оксидазы D-аминокислот.
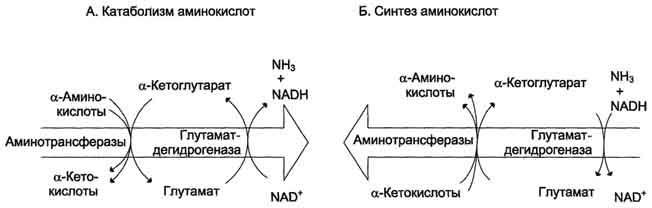
Рис. 9-9. Биологическая роль непрямого дезаминирования. А - при катаболизме почти все природные аминокислоты сначала передают аминогруппу на а-кетоглутарат в реакции трансаминирования с образованием глутамата и соответствующей кетокислоты. Затем глутамат подвергается прямому окислительному дезаминированию под действием глутаматдегидрогена-зы, в результате чего получаются а-кетоглутарат и аммиак; Б - при необходимости синтеза аминокислот и наличии необходимых а-кетокислот обе стадии непрямого дезаминирования протекают в обратном направлении. В результате восстановительного аминирования а-кетоглутарата образуется глутамат, который вступает в трансаминирование с соответствующей а-кетокислотой, что приводит к синтезу новой аминокислоты.
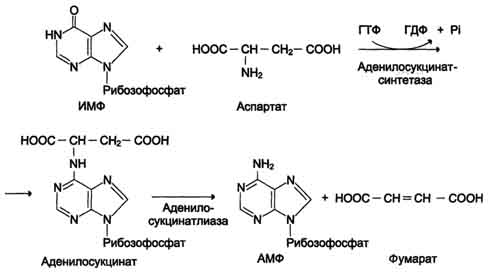
Схема А

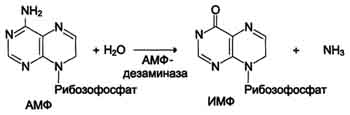
Схема Б.
Этот путь дезаминирования преобладает в мышцах при интенсивной работе, в результате которой накапливается молочная кислота. Выделяющийся аммиак предотвращает закисление среды в клетках, вызванное образованием лактата.
ГЛУТАМАТДЕГИДРОГЕНАЗА,
фермент,
катализирующий взаимопревращение
L-глутаминовой и 2-оксоглутаровой к-т:
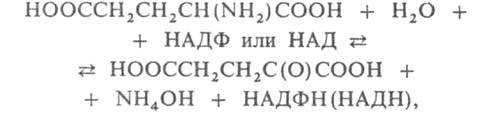
где НАДФ (НАД) и НАДФН (НАДН) соотв. окисленная и восстановленная форма кофермента никотинамидаденин-динуклеотидфосфата (никотинамидадениндинуклеотида) - акцепторы и переносчики электронов и водорода на промежут. стадиях. Относится к классу оксидоредуктаз.
Различают глутаматдегидрогеназы специфичные к НАД, НАД и НАДФ или только к НАДФ. В активном центре содержатся остатки лизина, тирозина и ци-стеина. Глутаматдегидрогеназа содержится в животных, растениях и микроорганизмах. В бактериях и синезеленых водорослях представлена одной формой, в др. организмах - неск. изоферментами.
