
- •Теории химического строения
- •Основные положения теории бутлерова:
- •2. Положение о зависимости свойств от химического строения.
- •3. Положение о взаимном влиянии атомов.
- •6. Классификация органических реакций по механизму
- •Пространственное строение предельных углеводородов
- •Способы получения предельных углеводородов
- •Лабораторные способы получения алканов
- •Физические свойства предельных углеводородов
- •I. Замещение
- •II. Окисление
- •IV. Изомеризация предельных углеводородов
- •Номенклатура
- •Способы получения
- •Химические свойства олефинов
- •1. Реакции присоединения
- •2. Реакции окисления
- •3. Реакции полимеризации
- •4. Реакции аллильного замещения
- •Физические свойства
- •Особенности электронного строения диенов с сопряженными связями
- •1. Реакции присоединения
- •Классификация
- •Способы получения
- •Физические свойства
- •Химические свойства
- •I.Реакции нуклеофильного замещения
- •Реакции отщепления галогена
- •III. Реакции отщепления галогеноводорода
- •Карбонильные соединения
- •Способы получения
- •Отличие химических свойств альдегидов и кетонов
- •Химические свойства
- •III. Реакции окисления и восстановления
- •Реакции восстановления
- •Карбоновые кислоты
- •Номенклатура
- •Способы получения
- •4) Дегидратация кислот
- •Определение
- •Классификация
- •Изомерия
- •Получение
- •Физические свойства
- •Химические свойства
- •Основные признаки ароматичности
- •Ароматические соединения
- •Гомологический ряд, изомерия и номенклатура ароматических углеводородов
- •Названия ароматических радикалов
- •Способы получения ароматических углеводородов
- •Б. Синтетические способы получения ароматических углеводородов
- •Химические свойства
- •Механизм электрофильного замещения
- •Нитрование гомологов бензола
- •Реакции присоединения (нетипичны)
- •Галоидпроизводные ароматических углеводородов Классификация, изомерия, номенклатура
- •Получение
- •Физические свойства галогенопроизводных ароматических углеводородов
- •Химические свойства
- •Нитросоединения ароматического ряда
- •1.Нитросоединения с нитрогруппой в ядре
- •Физические свойства
- •Химические свойства
- •II. Реакции в ядре
- •II. Нитросоединения с группой no2 в боковой цепи
- •Способы получения
- •Химические свойства ароматических нитросоединений с группой no2 в боковой цепи
- •Ароматические сульфокислоты
- •Физические свойства
- •Химические свойства
- •I тип реакций. Реакции, характерные для органических кислот.
- •II тип реакции. Восстановление сульфогруппы
- •III тип реакций. Реакции нуклеофильного замещения сульфогруппы
- •IV тип реакций. Реакции электрофильного замещения в ядре идут в соответствии с правилами замещения
- •27. Ариламины. Ароматические амины Классификация
- •I. По положению аминогруппы относительно ароматического ядра.
- •II. По количеству радикалов, связанных с азотом
- •III. По количеству аминогрупп
- •Получение
- •Физические свойства
- •Химические свойства
- •II. Реакции замещения водорода в аминогруппе
- •IV. Окисление
- •V. Реакции замещения в ароматическом ядре
- •VI. Реакции конденсации ароматических аминов с другими органическими и неорганическими соединениями
- •Диазо- и азосоединения
- •Ароматические диазосоединения
- •1. Реакция диазотирования - -получение солей диазония.
- •Химические свойства солей диазония
- •I. Реакции с выделением азота
- •II. Реакции диазосоединений без выделения азота
- •Азокрасители
- •Связь строения с цветностью
- •Ароматические оксисоединения
- •Классификация
- •Физические свойства фенолов
- •Химически свойства фенолов
- •I. Реакции подвижного водорода в группе он
- •II. Реакции электрофильного замещения в ядре
- •III. Окислительно-восстановительные реакции
- •IV. Конденсация фенолов с другими органическими соединениями
- •Ароматические альдегиды и кетоны
- •Способы получения
- •II. Частные способы получения альдегидов и кетонов
- •Физические свойства
- •Химические свойства
- •Ароматические кислоты
- •Способы получения
- •Физические свойства
- •Химические свойства
- •Полициклические ароматические углеводороды и их производные
- •Ароматические углеводороды с изолированными ядрами
- •Способы получения
- •Физические свойства
- •Химические свойства
- •Наиболее важные группы многоядерных соединений. Группа дифенила
- •Группа трифеиилметана
- •Полициклические ароматические углеводороды с конденсированными ядрами
- •Получение
- •Физические свойства
- •Особенности химических свойств
- •Ароматические моноциклические пятичленные гетероциклы
- •Номенклатура гетероциклических соединений
- •Способы получения
- •Физические свойства
- •34. Шестичленные гетероциклы с одним гетероатомом
- •Получение
Теория химического строения. Классификация органических соединений. Классификация орг-их реакций.
Теории химического строения
попытки понять строение органических соединений.
Теория радикалов. Гей-Люссак и Берцелиус показали, что в органических соединениях существуют устойчивые группировки атомов, радикалы, которые могут переходить при реакциях из одного соединения в другое без изменения.
Теория типов. Лоран и Жерар выявили аналогию в строении и некоторых свойствах органических и простейших неорганических соединении. Например, спирты были отнесены к типу воды, то есть рассматривались как продукты замещения водорода в воде НОН радикалом RОН, амины – к типу аммиака, углеводороды – к типу водорода.
Кекуле сделал вывод о четырехвалентности атома углерода в органических соединениях, а Купер выдвинул положение о наличии углеродных цепей и предложил черточки для обозначения химических связей. Однако одному и тому же веществу в зависимости от типа его реакций приписывались различные формулы..
Теория химического строения, которой мы сейчас пользуемся, разработана А.М.Бутлеровым.
Основные положения теории бутлерова:
1. Положение о химическом строении.
Молекулы органических соединений имеют определенное химическое строение, под которым понимают последовательность соединения атомов друг с другом в соответствии с их валентностью. Химическое строение вещества можно установить, изучая реакции его разложения или синтеза в мягких условиях и выразить его структурной формулой
При составлении структурных формул необходимо учитывать основные особенности атома углерода:
углерод, как правило, четырехвалентен;
атомы углерода могут соединяться друг с другом, образуя цепи: открытые неразветвленные,
открытые разветвленные
циклические
углерод может затратить на соединение с другим атомом одну, две, три единицы валентности, образуя при этом простую связь:
двойную связь:
тройную связь:
углерод может соединяться как с металлами, так и с неметаллами.
2. Положение о зависимости свойств от химического строения.
Свойства органических веществ зависят не только от количества и природы атомов, входящих в его молекулу, но и от того, в каком порядке они соединяются. Это положение позволило дать объяснение явлению изомерии
разновидности структурной изомерии:
а) изомерия углеродной цепи СН3-СН2-СН2-СН3
бутан
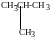
изобутан
б) изомерия положения (кратных связей или заместителей)
СН2=СН-СН2-СН3 |
-бутилен |
СН3-СН2-СН2-ОН |
бутиловый спирт |
СН3-СН=СН-СН3 |
-бутилен |
|
изобутиловый спирт |
в) метамерия (неуглеродные многовалентные атомы соединены с различными радикалами): СН3-О-СН2-СН2-СН3 метилпропиловый эфир СН3-СН2-О-СН2-СН3 диэтиловый эфир
г) таутомерия – динамическое равновесие двух изомерных форм, способных переходить друг в друга за счет внутримолекулярных перегруппировок:
-
Ацетоуксусный эфир
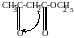

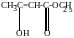
(кетонная форма)
(енольная форма)

