
- •Методические указания занятия № 1 для студентов I курса фармацевтического факультета
- •Целевые задачи:
- •Вопросы для самоподготовки:
- •Контрольные вопросы и задачи
- •Методические указания занятия № 2 для студентов I курса фармацевтического факультета
- •Лабораторная работа Материальное обеспечение:
- •Опыт№ 1. Получение и свойства гидроксида магния
- •Опыт № 2. Свойства солей магния
- •1. Реакции с раствором серной кислоты
- •2. Реакции с карбонатами
- •1. Реакция с гидрофосфатом натрия (фармакопейная)
- •2. Реакция с оксихинолином (с9h6onh)
- •3. Окрашивание пламени (фармакопейная)
- •Методические указания занятия № 3 для студентов I курса фармацевтического факультета
- •Целевые задачи:
- •Лабораторная работа Материальное обеспечение:
- •1. Реакция с раствором гидроксида аммония
- •2. Реакция с пероксидом водорода
- •3. Реакция с персульфатом аммония
- •Методические указания занятия № 4 для студентов I курса фармацевтического факультета
- •Целевые задачи:
- •К занятию повторить:
- •Лабораторная работа
- •1. Реакция с гидроксидом аммония
- •3. Реакция окисления персульфатом аммония (фармакопейная)
- •4. Микрокристаллоскопическая реакция со щавелевой кислотой
- •5. Реакция с пероксидом водорода на ион MnO4- (фармакопейная)
- •Методические указания занятия № 5 для студентов I курса фармацевтического факультета
- •Лабораторная работа
- •1. Реакция с гексацианоферратом (III) калия (фармакопейная)
- •2. Реакция с диметилглиоксимом (реактивом Чугаева)
- •1. Реакция с гексацианоферратом (II) калия (фармакопейная)
- •2. Реакция с тиоцианатом аммония
- •1. Реакция с тиоцианатом аммония
- •2. Реакция с нитрозо-р-солью (фармакопейная)
- •1. Реакция с диметилглиоксимом
- •Методические указания занятия № 6 для студентов I курса фармацевтического факультета
- •Методические указания занятия № 7 для студентов I курса фармацевтического факультета
- •Целевые задачи:
- •Вопросы для самоподготовки:
- •Лабораторная работа Материальное обеспечение:
- •1. Реакция с гидроксидом аммония (фармакопейная)
- •2. Реакция восстановления катиона меди (II) до металлической меди (фармакопейная)
- •3. Реакция с рубеановодородной кислотой
- •Методические указания занятия № 8 для студентов I курса фармацевтического факультета
- •1.Реакция с сульфидом натрия.
- •2.Реакция с тиомочевиной.
- •4.Реакция с иодидом калия.
- •1.Восстановление до металлической ртути хлоридом олова(II).
- •2. Восстановление до металлической ртути медью.
- •3.Реакция с иодидом калия.
- •4.Реакция с хроматом калия.
- •2.Реакция с иодидом калия.
- •3.Реакция восстановления катионов ртути(II) до металлической.
- •4.Реакция с дифенилкарбазидом.
- •Контрольные вопросы и задачи
- •Методические указания занятия № 9 для студентов I курса фармацевтического факультета
- •Лабораторная работа:
- •1. Реакция с ализарином.
- •Аналитические реакции на анион b4o72-
- •1. Реакция с хлоридом бария.
- •2.Окрашивание пламени сложных эфиров борной кислоты (фармакапейная).
- •3.Реакция с куркумином (фармакапейная).
- •Контрольные вопросы
- •Методические указания занятия № 11 для студентов I курса фармацевтического факультета
- •Лабораторная работа
- •Аналитические реакции на ион (co32-):
- •1. Реакция с хлоридом бария.
- •2. Реакция с сильными кислотами (фармакопейная).
- •Аналитические реакции на ион scn-:
- •1. Реакция с нитратом серебра.
- •2. Реакция с солями железа (III).
- •1. Реакция с серной кислотой или растворимыми сульфатами.
- •2. Реакция с хроматом калия.
- •3. Реакция с иодидом калия или натрия (реакция «золотого дождя», фармакопейная).
- •2. Реакция с сульфидом натрия.
- •3. Реакция с водой.
- •Контрольные вопросы:
- •Лабораторная работа
- •Аналитические реакции на ион no2-
- •Аналитические реакции на ион no3-
- •1. Реакция с металлическим цинком или алюминием.
- •2. Реакция с медью и серной кислотой (фармакопейная).
- •3. Реакция с дифениламином (фармакопейная).
- •4. Реакция с хлоридом железа (II).
- •Аналитические реакции на ион no3-
- •1. Реакция разложения солей аммония щелочами (фармакопейная).
- •2. Реакция с реактивом Несслера.
- •Методические указания занятия № 13 для студентов I курса фармацевтического факультета
- •Вопросы для самоподготовки
- •Лабораторная работа
- •Аналитические реакции на анион po43-
- •1. Реакция с нитратом серебра (фармакопейная).
- •2. Реакция с молибдатом аммония.
- •3. Реакция с магнезиальной смесью (фармакопейная).
- •1. Реакция гидролиза.
- •2. Реакция с метиловым фиолетовым.
- •Реакция гидролиза.
- •Методические указания занятия № 14 для студентов I курса фармацевтического факультета
- •Методические указания занятия № 15 для студентов I курса фармацевтического факультета
- •2. Изучить окислительно-восстановительные свойства пероксида водорода.
- •Лабораторная работа
- •2. Реакция с нитратом серебра.
- •3. Реакция с сильными минеральными кислотами.
- •4. Реакция с иодом.
- •Методические указания занятия № 16 для студентов I курса фармацевтического факультета
- •1. Реакция с нитратом серебра (фармакопейная).
- •2. Реакция с сильными окислителями.
- •Список литературы
- •Методические указания занятия № 17 для студентов I курса фармацевтического факультета
1. Реакция с гексацианоферратом (II) калия (фармакопейная)
К 2-3 каплям раствора соли железа (III) прибавляют 2-3 капли разбавленной хлороводородной кислоты и 2-3 капли раствора гексацианоферрата (II) калия K4[Fe(CN)6] (желтая кровяная соль) при взаимодействии в кислой среде с ионами железа (III) образует темно-синий осадок гексацианоферрата (II) железа (III) калия, называемый
«берлинская лазурь».
[Fe(CN)6]4- + Fe3+ → Fe[Fe(CN)6]- (т)
Реакция специфична. Проведению реакции мешают окислители.
2. Реакция с тиоцианатом аммония
В пробирку помещают 2-3 капли раствора соли железа (III), прибавляют 2-3 капли раствора тиоцианата аммония (калия). Наблюдают кроваво-красное окрашивание раствора. Состав, образующегося комплексного иона не постоянен. При недостаточной концентрации тиоцианатионов образуются координационно- ненасыщенные комплексы
[Fe(SCN)]2+, при высокой концентрации тиоцианатионов – координационно-насыщенные комплексы [Fe(SCN)6]3-:
Fe3+ + 6SCN- → [Fe(SCN)6]3-
Реакция проводится в кислой среде. Ионы железа (II) не мешают проведению реакции.
Аналитические реакции на ион Со2+,Со3+
1. Реакция с тиоцианатом аммония
В пробирку помещают 2-3 капли раствора соли кобальта (II), прибавляют 2-3 капли раствора тиоцианата аммония (калия), 5-6 капель смеси эфира с амиловым спиртом и взбалтывают. Наблюдают окрашивание слоя органической фазы в ярко синий цвет.
Co2+ + 4SCN- → [Co(SCN)4]2-.
Проведению реакции мешают катионы Cu2+, Fe3+, Bi3+.
2. Реакция с нитрозо-р-солью (фармакопейная)
К 3-4 каплям раствора соли кобальта прибавляют 3-4 капли 2 моль/л раствора хлороводородной кислоты и нагревают до кипения, затем добавляют 3-4 капли свежеприготовленного раствора нитрозо-Р-соли в 50% уксусной кислоте и снова нагревают до кипения. Наблюдают красное окрашивание раствора.
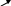

 N
– OH N –
O---- Co /3
N
– OH N –
O---- Co /3


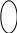
 O
O
O
O
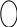
C o2+
→ Co3+
+ 3 →
o2+
→ Co3+
+ 3 →
HO3S SO3H HO3S SO3H
Аналитические реакции на ион Ni2+
1. Реакция с диметилглиоксимом
В пробирку вносят 4 капли раствора соли никеля (II), 3-4 капли раствора аммиака до растворения осадка Ni(OH)2 и несколько капель раствора диметилглиоксима. Раствор окрашивается в интенсивно розовый цвет, а затем образуется красный осадок комплексной соли диметилглиоксимата никеля. Ионы Fe2+, Cu2+, Co2+ мешают обнаружению ионов Ni2+.
КОНТРОЛЬНЫЕ ВОПРОСЫ И ЗАДАЧИ
1. Назовите минералы железа, кобальта, никеля.
2. Охарактеризуйте отношение железа, кобальта, никеля к минеральным кислотам. Напишите уравнения реакций.
3. Какие степени окисления характерны для элементов семейства железа?
4. Составьте химические формулы и дайте названия циано-, аква-, аммино-комплексным соединениям железа (III), никеля (II), кобальта (II). С позиции метода валентных связей или теории кристаллического поля объясните наличие окраски составленных вами комплексных соединений.
5. Каковы продукты взаимодействия карбоната натрия с водным раствором сульфата железа (III)? Напишите уравнение реакции.
6. Допишите уравнения реакций, расставьте коэффициенты:
а) FeSO4 + KMnO4 + H2SO4 →
б) Fe(OH)3 + CI2 + NaOH →
в) [Fe(H2O)6]CI2 + NaOH →
г) [Fe(H2O)6]CI3 + KCN →
7. В растворе одновременно присутствуют ионы Fe3+, Fe2+ и Mn2+. Предложите способы их разделения и качественного определения.
8. Сколько мл раствора тиоцианата аммония с молярной концентрацией 0,5 моль/л нужно добавить к 200 г раствора хлорида кобальта (II) с массовой долей 10 %, чтобы полностью перевести его в тетратиоцианокобальтат (II) аммония?
9. Сколько мл раствора хлорида железа (III) с массовой долей 10 % (пл. 1,06 г/мл) нужно добавить к 200 г раствора тиоцианата калия с массовой долей 6 %, чтобы полностью перевести его в гексацианоферрат (III) калия?
10. Приведите формулы соединений, имеющих следующие рациональные названия:
железный колчедан, красный железняк, соль Мора, железоаммонийные квасцы, желтая кровяная соль, красная кровяная соль, берлинская лазурь, турнбулева синь.
