
- •Методические указания занятия № 1 для студентов I курса фармацевтического факультета
- •Целевые задачи:
- •Вопросы для самоподготовки:
- •Контрольные вопросы и задачи
- •Методические указания занятия № 2 для студентов I курса фармацевтического факультета
- •Лабораторная работа Материальное обеспечение:
- •Опыт№ 1. Получение и свойства гидроксида магния
- •Опыт № 2. Свойства солей магния
- •1. Реакции с раствором серной кислоты
- •2. Реакции с карбонатами
- •1. Реакция с гидрофосфатом натрия (фармакопейная)
- •2. Реакция с оксихинолином (с9h6onh)
- •3. Окрашивание пламени (фармакопейная)
- •Методические указания занятия № 3 для студентов I курса фармацевтического факультета
- •Целевые задачи:
- •Лабораторная работа Материальное обеспечение:
- •1. Реакция с раствором гидроксида аммония
- •2. Реакция с пероксидом водорода
- •3. Реакция с персульфатом аммония
- •Методические указания занятия № 4 для студентов I курса фармацевтического факультета
- •Целевые задачи:
- •К занятию повторить:
- •Лабораторная работа
- •1. Реакция с гидроксидом аммония
- •3. Реакция окисления персульфатом аммония (фармакопейная)
- •4. Микрокристаллоскопическая реакция со щавелевой кислотой
- •5. Реакция с пероксидом водорода на ион MnO4- (фармакопейная)
- •Методические указания занятия № 5 для студентов I курса фармацевтического факультета
- •Лабораторная работа
- •1. Реакция с гексацианоферратом (III) калия (фармакопейная)
- •2. Реакция с диметилглиоксимом (реактивом Чугаева)
- •1. Реакция с гексацианоферратом (II) калия (фармакопейная)
- •2. Реакция с тиоцианатом аммония
- •1. Реакция с тиоцианатом аммония
- •2. Реакция с нитрозо-р-солью (фармакопейная)
- •1. Реакция с диметилглиоксимом
- •Методические указания занятия № 6 для студентов I курса фармацевтического факультета
- •Методические указания занятия № 7 для студентов I курса фармацевтического факультета
- •Целевые задачи:
- •Вопросы для самоподготовки:
- •Лабораторная работа Материальное обеспечение:
- •1. Реакция с гидроксидом аммония (фармакопейная)
- •2. Реакция восстановления катиона меди (II) до металлической меди (фармакопейная)
- •3. Реакция с рубеановодородной кислотой
- •Методические указания занятия № 8 для студентов I курса фармацевтического факультета
- •1.Реакция с сульфидом натрия.
- •2.Реакция с тиомочевиной.
- •4.Реакция с иодидом калия.
- •1.Восстановление до металлической ртути хлоридом олова(II).
- •2. Восстановление до металлической ртути медью.
- •3.Реакция с иодидом калия.
- •4.Реакция с хроматом калия.
- •2.Реакция с иодидом калия.
- •3.Реакция восстановления катионов ртути(II) до металлической.
- •4.Реакция с дифенилкарбазидом.
- •Контрольные вопросы и задачи
- •Методические указания занятия № 9 для студентов I курса фармацевтического факультета
- •Лабораторная работа:
- •1. Реакция с ализарином.
- •Аналитические реакции на анион b4o72-
- •1. Реакция с хлоридом бария.
- •2.Окрашивание пламени сложных эфиров борной кислоты (фармакапейная).
- •3.Реакция с куркумином (фармакапейная).
- •Контрольные вопросы
- •Методические указания занятия № 11 для студентов I курса фармацевтического факультета
- •Лабораторная работа
- •Аналитические реакции на ион (co32-):
- •1. Реакция с хлоридом бария.
- •2. Реакция с сильными кислотами (фармакопейная).
- •Аналитические реакции на ион scn-:
- •1. Реакция с нитратом серебра.
- •2. Реакция с солями железа (III).
- •1. Реакция с серной кислотой или растворимыми сульфатами.
- •2. Реакция с хроматом калия.
- •3. Реакция с иодидом калия или натрия (реакция «золотого дождя», фармакопейная).
- •2. Реакция с сульфидом натрия.
- •3. Реакция с водой.
- •Контрольные вопросы:
- •Лабораторная работа
- •Аналитические реакции на ион no2-
- •Аналитические реакции на ион no3-
- •1. Реакция с металлическим цинком или алюминием.
- •2. Реакция с медью и серной кислотой (фармакопейная).
- •3. Реакция с дифениламином (фармакопейная).
- •4. Реакция с хлоридом железа (II).
- •Аналитические реакции на ион no3-
- •1. Реакция разложения солей аммония щелочами (фармакопейная).
- •2. Реакция с реактивом Несслера.
- •Методические указания занятия № 13 для студентов I курса фармацевтического факультета
- •Вопросы для самоподготовки
- •Лабораторная работа
- •Аналитические реакции на анион po43-
- •1. Реакция с нитратом серебра (фармакопейная).
- •2. Реакция с молибдатом аммония.
- •3. Реакция с магнезиальной смесью (фармакопейная).
- •1. Реакция гидролиза.
- •2. Реакция с метиловым фиолетовым.
- •Реакция гидролиза.
- •Методические указания занятия № 14 для студентов I курса фармацевтического факультета
- •Методические указания занятия № 15 для студентов I курса фармацевтического факультета
- •2. Изучить окислительно-восстановительные свойства пероксида водорода.
- •Лабораторная работа
- •2. Реакция с нитратом серебра.
- •3. Реакция с сильными минеральными кислотами.
- •4. Реакция с иодом.
- •Методические указания занятия № 16 для студентов I курса фармацевтического факультета
- •1. Реакция с нитратом серебра (фармакопейная).
- •2. Реакция с сильными окислителями.
- •Список литературы
- •Методические указания занятия № 17 для студентов I курса фармацевтического факультета
Лабораторная работа
Материальное обеспечение:
Оборудование: штатив с пробирками, пробиркодержатель, спиртовка, пипетки, стеклянные палочки, резиновые груши.
Реактивы: растворы солей железа (II), железа (III), кобальта (II) , никеля (II), растворы кислот и щелочей, растворы: гексацианоферрата (II) калия, гексацианоферрата (III) калия, тиоцианата аммония, диметилглиоксима, нитрозо-Р-соли.
ОПЫТ № 1. Получение и свойства гидроксида железа (II)
К раствору сульфата железа (II) прилейте раствор гидроксида натрия. Отметьте цвет осадка в момент его образования и наблюдайте постепенное его изменение. Испытайте отношение полученного гидроксида железа (II) к действию кислот и щелочей. Напишите уравнения реакций. Сделайте соответствующие выводы.
ОПЫТ № 2. Получение и свойства гидроксида железа (III)
К раствору хлорида железа (III) прилейте раствор гидроксида натрия. Отметьте цвет осадка. Испытайте отношение гидроксида железа (III) к действию кислоты и избытку концентрированной щелочи. Напишите уравнения реакций. Сделайте вывод о химической природе гидроксида железа (III).
ОПЫТ № 3. Изучение восстановительных свойств соединений железа (II)
1-2 мл раствора сульфата железа (II) подкислите раствором серной кислоты и добавьте раствор перманганата калия. Отметьте изменение окраски раствора. Убедитесь в присутствии в растворе ионов Fe3+ , проведя реакцию с KSCN . Запишите уравнения реакций. Сделайте вывод об окислительно-восстановительных свойствах соединений железа (II).
ОПЫТ № 4. Получение и свойства гидроксида никеля (II)
К 1 мл раствора соли никеля прилейте раствор щелочи. Отметьте цвет полученного осадка. Испытайте отношение полученного осадка к действию кислоты, щелочи и концентрированному раствору гидроксида аммония. Напишите уравнения реакций. Сделайте соответствующие выводы.
ОПЫТ № 5. Получение и свойства гидроксида кобальта (II)
К 1 мл раствора соли кобальта прилейте раствор щелочи. Обратите внимание на цвет осадка полученной основной соли. Прилейте к осадку избыток щелочи и нагрейте смесь до кипения. Изменился ли цвет осадка? Напишите уравнения реакций. Сделайте выводы.
ОПЫТ№ 6
Аналитические реакции на ион Fe2+
1. Реакция с гексацианоферратом (III) калия (фармакопейная)
К 2-3 каплям раствора соли железа (II) прибавляют 3-4 капли разбавленной хлороводородной кислоты и 2-3 капли раствора гексацианоферрата (III) калия. K3[Fe(CN)6] (красная кровяная соль) при взаимодействии в кислой среде с ионами железа(II) образует синий осадок гексацианоферрата (III) железа (II) калия, называемый «турнбулева синь».
[Fe(CN)6]3- + Fe2+ → Fe[Fe(CN)6]-.(т )
Осадок не растворяется в кислотах, но разлагается щелочами. Чувствительность реакции 0,05 мкг.
2. Реакция с диметилглиоксимом (реактивом Чугаева)
К 2-3 каплям раствора соли железа (II) прибавляют 3-4 капли раствора аммиака и 2-3 капли раствора диметилглиоксима. Наблюдают появление карминово-красного окрашивания раствора.


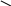
 H3C-C=
N-OH
H3C-C=
N-O . . .
HO-N=C-C3H
H3C-C=
N-OH
H3C-C=
N-O . . .
HO-N=C-C3H
2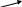
 + Fe2+
→ Fe
+ 2 Н+
+ Fe2+
→ Fe
+ 2 Н+
H3C-C= N-OH H3C-C= N-OH . . . O-N=C-C3H
Определению ионов железа (II) мешают катионы никеля (II). Чувствительность реакции 0,4 мкг.
Аналитические реакции на ион Fe3+
