
- •Методические указания занятия № 1 для студентов I курса фармацевтического факультета
- •Целевые задачи:
- •Вопросы для самоподготовки:
- •Контрольные вопросы и задачи
- •Методические указания занятия № 2 для студентов I курса фармацевтического факультета
- •Лабораторная работа Материальное обеспечение:
- •Опыт№ 1. Получение и свойства гидроксида магния
- •Опыт № 2. Свойства солей магния
- •1. Реакции с раствором серной кислоты
- •2. Реакции с карбонатами
- •1. Реакция с гидрофосфатом натрия (фармакопейная)
- •2. Реакция с оксихинолином (с9h6onh)
- •3. Окрашивание пламени (фармакопейная)
- •Методические указания занятия № 3 для студентов I курса фармацевтического факультета
- •Целевые задачи:
- •Лабораторная работа Материальное обеспечение:
- •1. Реакция с раствором гидроксида аммония
- •2. Реакция с пероксидом водорода
- •3. Реакция с персульфатом аммония
- •Методические указания занятия № 4 для студентов I курса фармацевтического факультета
- •Целевые задачи:
- •К занятию повторить:
- •Лабораторная работа
- •1. Реакция с гидроксидом аммония
- •3. Реакция окисления персульфатом аммония (фармакопейная)
- •4. Микрокристаллоскопическая реакция со щавелевой кислотой
- •5. Реакция с пероксидом водорода на ион MnO4- (фармакопейная)
- •Методические указания занятия № 5 для студентов I курса фармацевтического факультета
- •Лабораторная работа
- •1. Реакция с гексацианоферратом (III) калия (фармакопейная)
- •2. Реакция с диметилглиоксимом (реактивом Чугаева)
- •1. Реакция с гексацианоферратом (II) калия (фармакопейная)
- •2. Реакция с тиоцианатом аммония
- •1. Реакция с тиоцианатом аммония
- •2. Реакция с нитрозо-р-солью (фармакопейная)
- •1. Реакция с диметилглиоксимом
- •Методические указания занятия № 6 для студентов I курса фармацевтического факультета
- •Методические указания занятия № 7 для студентов I курса фармацевтического факультета
- •Целевые задачи:
- •Вопросы для самоподготовки:
- •Лабораторная работа Материальное обеспечение:
- •1. Реакция с гидроксидом аммония (фармакопейная)
- •2. Реакция восстановления катиона меди (II) до металлической меди (фармакопейная)
- •3. Реакция с рубеановодородной кислотой
- •Методические указания занятия № 8 для студентов I курса фармацевтического факультета
- •1.Реакция с сульфидом натрия.
- •2.Реакция с тиомочевиной.
- •4.Реакция с иодидом калия.
- •1.Восстановление до металлической ртути хлоридом олова(II).
- •2. Восстановление до металлической ртути медью.
- •3.Реакция с иодидом калия.
- •4.Реакция с хроматом калия.
- •2.Реакция с иодидом калия.
- •3.Реакция восстановления катионов ртути(II) до металлической.
- •4.Реакция с дифенилкарбазидом.
- •Контрольные вопросы и задачи
- •Методические указания занятия № 9 для студентов I курса фармацевтического факультета
- •Лабораторная работа:
- •1. Реакция с ализарином.
- •Аналитические реакции на анион b4o72-
- •1. Реакция с хлоридом бария.
- •2.Окрашивание пламени сложных эфиров борной кислоты (фармакапейная).
- •3.Реакция с куркумином (фармакапейная).
- •Контрольные вопросы
- •Методические указания занятия № 11 для студентов I курса фармацевтического факультета
- •Лабораторная работа
- •Аналитические реакции на ион (co32-):
- •1. Реакция с хлоридом бария.
- •2. Реакция с сильными кислотами (фармакопейная).
- •Аналитические реакции на ион scn-:
- •1. Реакция с нитратом серебра.
- •2. Реакция с солями железа (III).
- •1. Реакция с серной кислотой или растворимыми сульфатами.
- •2. Реакция с хроматом калия.
- •3. Реакция с иодидом калия или натрия (реакция «золотого дождя», фармакопейная).
- •2. Реакция с сульфидом натрия.
- •3. Реакция с водой.
- •Контрольные вопросы:
- •Лабораторная работа
- •Аналитические реакции на ион no2-
- •Аналитические реакции на ион no3-
- •1. Реакция с металлическим цинком или алюминием.
- •2. Реакция с медью и серной кислотой (фармакопейная).
- •3. Реакция с дифениламином (фармакопейная).
- •4. Реакция с хлоридом железа (II).
- •Аналитические реакции на ион no3-
- •1. Реакция разложения солей аммония щелочами (фармакопейная).
- •2. Реакция с реактивом Несслера.
- •Методические указания занятия № 13 для студентов I курса фармацевтического факультета
- •Вопросы для самоподготовки
- •Лабораторная работа
- •Аналитические реакции на анион po43-
- •1. Реакция с нитратом серебра (фармакопейная).
- •2. Реакция с молибдатом аммония.
- •3. Реакция с магнезиальной смесью (фармакопейная).
- •1. Реакция гидролиза.
- •2. Реакция с метиловым фиолетовым.
- •Реакция гидролиза.
- •Методические указания занятия № 14 для студентов I курса фармацевтического факультета
- •Методические указания занятия № 15 для студентов I курса фармацевтического факультета
- •2. Изучить окислительно-восстановительные свойства пероксида водорода.
- •Лабораторная работа
- •2. Реакция с нитратом серебра.
- •3. Реакция с сильными минеральными кислотами.
- •4. Реакция с иодом.
- •Методические указания занятия № 16 для студентов I курса фармацевтического факультета
- •1. Реакция с нитратом серебра (фармакопейная).
- •2. Реакция с сильными окислителями.
- •Список литературы
- •Методические указания занятия № 17 для студентов I курса фармацевтического факультета
3. Реакция с дифениламином (фармакопейная).
Методика:
К 2-3 каплям раствора нитрата прибавляют 3-5 капель дифениламина. Появляется синее окрашивание. _
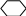 NO3
NO3;H2SO4(конц
.)
NO3
NO3;H2SO4(конц
.)
2
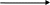


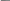













 NH
NH NH
NH
NH NH
дифенилбензидин
 + _
+ _



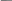



 N N
+ HSO4
N N
+ HSO4

H
4. Реакция с хлоридом железа (II).
Методика:
В 2-3 капли раствора нитрата натрия на предметном стекле помещают кристалл сульфата железа (II) FeSO4 . H2O и серной кислоты. Вокруг кристалла появляется бурое кольцо
[Fe(NO)SO4].
2NO3- + 6Fe2++ 8H+→ 6Fe3+ + 2NO + 4H2O
NO + FeSO4 → [Fe(NO)SO4]
Аналитические реакции на ион no3-
1. Реакция разложения солей аммония щелочами (фармакопейная).
Методика:
В пробирку помещают 8-10 капель раствора соли аммония, добавляют такой же объем раствора щелочи и слегка нагревают на водяной бане. Обращают внимание на запах выделяющегося газа. Выделяющиеся пары аммиака изменяют окраску влажной розовой лакмусовой бумаги в синий цвет. Лакмусовую бумагу осторожно держат над раствором, не касаясь стенок пробирки. Вместо лакмусовой бумаги можно использовать бумагу, смоченную раствором фенолфталеина. В этом случае бумага окрашивается в малиновый цвет. Реакция специфична.
NH4+ + OH- → NH3 + H2O
2. Реакция с реактивом Несслера.
Методика:
В пробирку помещают 2-3 капли раствора соли аммония. Прибавляют 4-6 капель реактива Несслера. Наблюдают выпадение аморфного красно-бурого осадка.
NH4+ + 2[HgI4]2- + 4OH- → [Hg 2 О NH2]I↓ + 7I- + 3H2O
КОНТРОЛЬНЫЕ ВОПРОСЫ:
1. Как обнаружить в составе соли ион аммония?
2. Напишите уравнение реакции термического разложения следующих солей: (NH4)2CO3, NH4NO3, (NH4)2SO4, NH4Cl, , (NH4)2Cr2O7, NH4NO2.
3. Какова реакция среды в растворах NaNO3, NH4NO3, NaNO2, NH4NO2? Какие из перечисленных соединений взаимодействуют в подкисленном серной кислотой растворе: а) с иодидом калия; б) с перманганатом калия: Напишите уравнения реакций.
4. Напишите уравнение реакции диспропорционирования азотистой кислоты:
5. Что представляет собой бурый газ, выделяющийся при действии концентрированной азотной кислоты на металлы?
6. Что называют «царской водкой»? Какими свойствами она обладает? Напишите уравнение реакции взаимодействия ее с золотом.
7. Напишите с точки зрения протолитической теории реакции гидролиза сульфида, карбоната и цианида аммония. Укажите, как можно сместить равновесие: усилить и подавить гидролиз.
8. Почему концентрированная азотная кислота имеет желтовато-бурую окраску?
Методические указания занятия № 13 для студентов I курса фармацевтического факультета
Тема: Свойства соединений фосфора и элементов подгруппы мышьяка.
Цель: На основании положений элементов в периодической системе Д.И.Менделеева и знаний теоретического материала по теме изучить свойства фосфора, мышьяка, сурьмы, висмута и их соединений.
Целевые задачи:
1. Получить и определить свойства гидроксидов сурьмы (III) и висмута (III).
2. Определить условия реакций гидролиза солей сурьмы (III) и висмута(III) .
3. Определить окислительные свойства солей висмута (III).
