
- •Методические указания занятия № 1 для студентов I курса фармацевтического факультета
- •Целевые задачи:
- •Вопросы для самоподготовки:
- •Контрольные вопросы и задачи
- •Методические указания занятия № 2 для студентов I курса фармацевтического факультета
- •Лабораторная работа Материальное обеспечение:
- •Опыт№ 1. Получение и свойства гидроксида магния
- •Опыт № 2. Свойства солей магния
- •1. Реакции с раствором серной кислоты
- •2. Реакции с карбонатами
- •1. Реакция с гидрофосфатом натрия (фармакопейная)
- •2. Реакция с оксихинолином (с9h6onh)
- •3. Окрашивание пламени (фармакопейная)
- •Методические указания занятия № 3 для студентов I курса фармацевтического факультета
- •Целевые задачи:
- •Лабораторная работа Материальное обеспечение:
- •1. Реакция с раствором гидроксида аммония
- •2. Реакция с пероксидом водорода
- •3. Реакция с персульфатом аммония
- •Методические указания занятия № 4 для студентов I курса фармацевтического факультета
- •Целевые задачи:
- •К занятию повторить:
- •Лабораторная работа
- •1. Реакция с гидроксидом аммония
- •3. Реакция окисления персульфатом аммония (фармакопейная)
- •4. Микрокристаллоскопическая реакция со щавелевой кислотой
- •5. Реакция с пероксидом водорода на ион MnO4- (фармакопейная)
- •Методические указания занятия № 5 для студентов I курса фармацевтического факультета
- •Лабораторная работа
- •1. Реакция с гексацианоферратом (III) калия (фармакопейная)
- •2. Реакция с диметилглиоксимом (реактивом Чугаева)
- •1. Реакция с гексацианоферратом (II) калия (фармакопейная)
- •2. Реакция с тиоцианатом аммония
- •1. Реакция с тиоцианатом аммония
- •2. Реакция с нитрозо-р-солью (фармакопейная)
- •1. Реакция с диметилглиоксимом
- •Методические указания занятия № 6 для студентов I курса фармацевтического факультета
- •Методические указания занятия № 7 для студентов I курса фармацевтического факультета
- •Целевые задачи:
- •Вопросы для самоподготовки:
- •Лабораторная работа Материальное обеспечение:
- •1. Реакция с гидроксидом аммония (фармакопейная)
- •2. Реакция восстановления катиона меди (II) до металлической меди (фармакопейная)
- •3. Реакция с рубеановодородной кислотой
- •Методические указания занятия № 8 для студентов I курса фармацевтического факультета
- •1.Реакция с сульфидом натрия.
- •2.Реакция с тиомочевиной.
- •4.Реакция с иодидом калия.
- •1.Восстановление до металлической ртути хлоридом олова(II).
- •2. Восстановление до металлической ртути медью.
- •3.Реакция с иодидом калия.
- •4.Реакция с хроматом калия.
- •2.Реакция с иодидом калия.
- •3.Реакция восстановления катионов ртути(II) до металлической.
- •4.Реакция с дифенилкарбазидом.
- •Контрольные вопросы и задачи
- •Методические указания занятия № 9 для студентов I курса фармацевтического факультета
- •Лабораторная работа:
- •1. Реакция с ализарином.
- •Аналитические реакции на анион b4o72-
- •1. Реакция с хлоридом бария.
- •2.Окрашивание пламени сложных эфиров борной кислоты (фармакапейная).
- •3.Реакция с куркумином (фармакапейная).
- •Контрольные вопросы
- •Методические указания занятия № 11 для студентов I курса фармацевтического факультета
- •Лабораторная работа
- •Аналитические реакции на ион (co32-):
- •1. Реакция с хлоридом бария.
- •2. Реакция с сильными кислотами (фармакопейная).
- •Аналитические реакции на ион scn-:
- •1. Реакция с нитратом серебра.
- •2. Реакция с солями железа (III).
- •1. Реакция с серной кислотой или растворимыми сульфатами.
- •2. Реакция с хроматом калия.
- •3. Реакция с иодидом калия или натрия (реакция «золотого дождя», фармакопейная).
- •2. Реакция с сульфидом натрия.
- •3. Реакция с водой.
- •Контрольные вопросы:
- •Лабораторная работа
- •Аналитические реакции на ион no2-
- •Аналитические реакции на ион no3-
- •1. Реакция с металлическим цинком или алюминием.
- •2. Реакция с медью и серной кислотой (фармакопейная).
- •3. Реакция с дифениламином (фармакопейная).
- •4. Реакция с хлоридом железа (II).
- •Аналитические реакции на ион no3-
- •1. Реакция разложения солей аммония щелочами (фармакопейная).
- •2. Реакция с реактивом Несслера.
- •Методические указания занятия № 13 для студентов I курса фармацевтического факультета
- •Вопросы для самоподготовки
- •Лабораторная работа
- •Аналитические реакции на анион po43-
- •1. Реакция с нитратом серебра (фармакопейная).
- •2. Реакция с молибдатом аммония.
- •3. Реакция с магнезиальной смесью (фармакопейная).
- •1. Реакция гидролиза.
- •2. Реакция с метиловым фиолетовым.
- •Реакция гидролиза.
- •Методические указания занятия № 14 для студентов I курса фармацевтического факультета
- •Методические указания занятия № 15 для студентов I курса фармацевтического факультета
- •2. Изучить окислительно-восстановительные свойства пероксида водорода.
- •Лабораторная работа
- •2. Реакция с нитратом серебра.
- •3. Реакция с сильными минеральными кислотами.
- •4. Реакция с иодом.
- •Методические указания занятия № 16 для студентов I курса фармацевтического факультета
- •1. Реакция с нитратом серебра (фармакопейная).
- •2. Реакция с сильными окислителями.
- •Список литературы
- •Методические указания занятия № 17 для студентов I курса фармацевтического факультета
1. Реакция с гидроксидом аммония (фармакопейная)
В фарфоровую чашку помещают 5-6 капель соли меди (II), осторожно выпаривают досуха, охлаждают и на периферическую часть наносят каплю конц. р-ра аммиака. Появление сине-фиолетовой окраски говорит о присутствии катиона меди (II).
CuSO4 + 4NH3 → [ Cu(NH3)4]SO4
Эта реакция позволяет открыть катион меди(II) в присутствии всех катионов.
2. Реакция восстановления катиона меди (II) до металлической меди (фармакопейная)
На металлическую пластинку (алюминиевую, железную или цинковую) наносят каплю раствора соли меди, подкисленного серной кислотой. Через некоторое время наблюдают образование красного пятна металлической меди.
Cu2+ + Zn → Cu + Zn2+
3. Реакция с рубеановодородной кислотой
Каплю исследуемого раствора, подкисленного уксусной кислотой, помещают на бумагу, смоченную 0,5% раствором рубеановодородной кислоты. На фильтровальной бумаге образуются две зоны: образование черного пятна в центральной зоне указывает на присутствие Cu2+, Co2+ и Ni2+ - ионы образуют окрашенные соединения с рубеановодородной кислотой вне центрального круга.
HN=C----C=NH HN=C----C=NH
 Cu2+ +
Cu2+ +
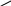 S S
S
S
S S
S
S

 Cu
Cu
4. Реакция с гексацианоферратом (II) калия.
К 2-3 каплям раствора соли меди прибавляют 3-4 капли раствора гексацианоферрат(II) калия. Выпадает красно-бурый осадок, не растворимый в щелочах и гидроксиде аммония.
2 Cu2+ + [ Fe(CN)6]4- → Cu2 [ Fe(CN)6] (т)
Аналитические реакции на ион Ag+.
1. Реакция с иодидом калия.
В пробирку помещают 2-3 капли раствора нитрата серебра, добавляют 2-3 капли раствора иодида калия. Наблюдают образование желтого осадка.
Ag+ + I- → AgI (т)
Осадок не растворим в концентрированном растворе аммиака.
2. Реакция с бромидом калия.
Помещают в пробирку 2-3 капли раствора нитрата серебра, добавляют 2-3 капли бромида калия. Наблюдают образование осадка бледно-желтого цвета.
Ag+ + Br - → AgBr (т)
Осадок частично растворим в концентрированном растворе аммиака.
3. Реакция с хроматом калия
В пробирку помещают 2-3 капли раствора нитрата серебра, добавляют 2-3 капли раствора хромата калия. Наблюдают образование осадка кирпично-красного цвета.
2 Ag+ + CrO42- → Ag2CrO4 (т)
Осадок растворим в концентрированном растворе аммиака, в аммиачной, сильнокислой среде осадок не образуется. Ионы Pb2+, Ba2+ и другие ионы, дающие осадки с хромат-ионом, мешают проведению реакции.
КОНТРОЛЬНЫЕ ВОПРОСЫ И ЗАДАЧИ
1. Напишите уравнения реакций взаимодействия меди с разбавленной и концентрированной азотной кислотой. Почему медь не растворяется в хлороводородной кислоте?
2. Смесь карбоната и нитрата меди прокалили. Что останется в реакционном сосуде после прокаливания?
3. Напишите уравнение реакции гидролиза хлорида меди с протолитической точки зрения. Какова реакция среды? Определите условия усиления и подавления гидролиза.
4. Почти все нерастворимые в воде соли меди легко растворяются в растворах гидроксида аммония и цианидов щелочных металлов с образованием комплексных соединений. Напишите уравнения реакций растворения хлорида меди (I) и фосфата меди (II) в растворах аммиака и цианида калия. Назовите образующиеся комплексные соединения.
5. В каком из соединений - KCI или AgCI химическая связь имеет более ковалентный характер? Чем это можно объяснить?
6. Используя теорию кристаллического поля, объясните, почему комплексный ион [CuCI2]- в водном растворе бесцветен, а [Cu(H2O)2CI4]2- - окрашен в зеленый цвет.
7. Какую массу нитрата серебра нужно взять, чтобы приготовить 500 мл раствора с молярной концентрацией 0,1 моль/л? (Ответ: 2,87 г)
8. Сколько мл 10% раствора гидроксида аммония (пл. 1,06 г/мл) необходимо добавить к 50 г 20% раствора сульфата меди, чтобы полностью перевести его в сульфаттетрааммин меди(II)? (Ответ: 82,8 мл)
9. Образуется ли осадок сульфата серебра (Кs =2 х 10-5) , если к 0,02 моль/л раствору нитрата серебра добавить равный объем раствора серной кислоты с молярной концентрацией эквивалента 1 моль/л? (Ответ: да)
