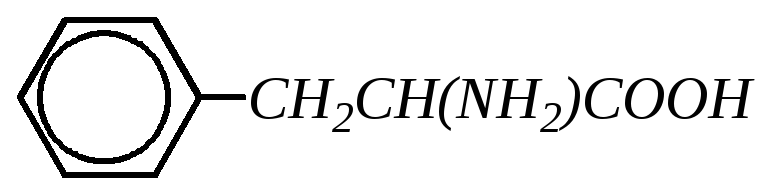- •Глава 6. Алифатические альдегиды, кетоны и карбоновые кислоты
- •6.1. Насыщенные альдегиды и кетоны
- •6.1.1. Изомерия, номенклатура
- •6.1.2. Строение карбонильной группы
- •6.1.3. Физические свойства
- •6.1.4. Химические свойства
- •6.1.5. Способы получения
- •6.1.6. Физиологическая роль
- •6.1.7. Важнейшие представители
- •6.2. Непредельные альдегиды и кетоны
- •6.2.1. Кетен
- •6.2.2. Непредельные карбонильные соединения
- •Примерами соединений с сопряжёнными -связями являются
- •6.2.3. Важнейшие представители
- •6.3. Дикарбонильные соединения
- •6.3.3. Важнейшие представители
- •6.4. Насыщенные монокарбоновые кислоты и их производные
- •6.4.1. Номенклатура
- •6.4.2. Строение функциональной группы
- •6.4.3. Физические свойства
- •6.4.4. Химические свойства
- •6.4.5. Способы получения
- •6.4.6. Пероксикарбоновые кислоты и ацилпероксиды
- •6.4.7. Физиологическая роль и Важнейшие представители
- •6.5. Непредельные монокарбоновые кислоты
- •6.5.1. Номенклатура, изомерия
- •6.5.2. Строение
- •6.5.3. Химические свойства
- •6.5.4. Способы получения
- •6.5.5. Физиологическая роль и Важнейшие представители
- •6.5.6. Омыляемые липиды
- •6.6. Дикарбоновые кислоты и их производные
- •6.6.1. Особенности химического поведения
- •6.6.2. Малоновый эфир и синтезы на его основе
- •2 H5c2ooc-ch2-cooc2h5
- •2 H5c2ooc-ch2-cooc2h5
- •6.6.3. Способы получения
- •2 Rooc-(ch2)n-сoo¯ 2 rooc-(ch2)n-сoo rooc-(ch2)2n-coor hooc-(ch2)2n-cooh
- •6.6.4. Важнейшие представители
- •6.7. Гидроксикислоты
- •6.7.1. Классификация, номенклатура, изомерия
- •6.7.2. Химические свойства
- •6.7.3. Способы получения
- •6.7.4. Физиологическая роль и Важнейшие представители
- •6.8. Оксокислоты
- •6.8.1. Особенности химического поведения
- •6.8.2. Ацетоуксусный эфир и синтезы на его основе
- •6.8.3. Способы получения
- •6.8.4. Важнейшие представители
- •6.9. Аминокарбоновые кислоты. Пептиды
- •6.9.1. Классификация, номенклатура, изомерия аминокислот
- •6.9.2. Строение, физические и Химические свойства
- •6.9.3. Способы получения аминокислот
- •6.9.4. Важнейшие представители аминокислот
- •6.9.5. Пептиды
- •Вопросы и упражнения
6.8.3. Способы получения
1. -Оксокислоты получают либо гидролизом ,-дигалогенозамещённых карбоновых кислот (механизм реакции — гл. 3.2.4), либо гидролизом -оксонитрилов (механизм реакции — гл. 6.4.4.7), а пировиноградную кислоту — пиролизом винных кислот в присутствии KHSO4:
R–CCl2–COOH
![]() R–CO–COOH
R–CO–COOH

HOOC-CHOH-CHOH-COOH
![]() HOOC-CH=COH-COOH
HOOC-CH=COH-COOH
HOOC-CH2-CO-COOH
![]() CH3-CO-COOH
CH3-CO-COOH
2. Одним из удобных способов получения -оксокислот (в частности, ацетоуксусной кислоты) является конденсация Кляйзена (гл. 6.4.4.3).
3. Возможны способы получения оксокислот из ацетоуксусного эфира (гл. 6.8.2), окислением соответствующих гидроксикислот; многие из оксокислот получают специфическими реакциями.
6.8.4. Важнейшие представители
Пировиноградная кислота — бесцветная жидкость с запахом уксусной кислоты; температура кипения 438 К (с разложением); растворима в воде.
Пировиноградная кислота участвует в различных биохимических процессах и потому имеет важное биологическое значение; является промежуточным продуктом в процессах молочнокислого и спиртового брожения, в биосинтезе аминокислот.
Получают пиролизом винной кислоты.
Ацетоуксусный эфир — бесцветная жидкость с приятным запахом; температура кипения 454 К.
Кетоформа ацетоуксусного эфира в чистом виде представляет собой кристаллы с температурой плавления 234 К.
Промышленным способом получения является сложноэфирная конденсация (Кляйзена) этилацетата.
Ацетоуксусный эфир широко применяют в тонком органическом синтезе (в частности, в фармацевтической промышленности, в производстве красителей).
6.9. Аминокарбоновые кислоты. Пептиды
Аминокарбоновые кислоты (или более общее название аминокислоты) можно определить как производные углеводородов, которые содержат в составе молекул карбоксильные и аминогруппы. Простейшим представителем являетсяNH2-CH2-COOH аминоэтановая кислота. (Хотя существует ещё более простой примеркарбаминовая кислотаNH2-COOH, но из-за больших отличий в её химическом поведении от прочих аминокислот карбаминовая кислота здесь не рассматривается).
Среди аминокарбоновых кислот наиболее распространёнными и биологически значимыми являются -аминокислоты (см. далее, в классификации) с общей формулойR-CH(NH2)-СOOH. Они представляют собой структурные элементы многих природных соединений, главным образом пептидов и белков. В настоящее время известно свыше 100 природных-аминокислот, из которых только около 26 обнаружены в белках (табл. 6.7), а 20 аминокислот входят практически во все белковые молекулы.
6.9.1. Классификация, номенклатура, изомерия аминокислот
Молекулы аминокарбоновых кислот могут содержать одну или несколько карбоксильных групп –COOН и, соответственно, одну или несколько аминогрупп–NН2. Поэтому среди аминокислот можно выделить:
а) моноаминомонокарбоновые кислоты, например:
|
H2N-CH2-СOOH |
|
|
|
|
б) моноаминодикарбоновые кислоты, например:
|
|
|
|
|
|
в) диаминомонокарбоновые кислоты, например,
|
|
|
г) диаминодикарбоновые кислоты и т.д.
Моноаминомонокарбоновые кислоты также классифицируют на -аминокислоты,-аминокислоты и т.д. в зависимости от взаимного расположения карбоксильной и аминогрупп:

-аминопропионовая кислота -аминопропионовая кислота
Помимо структурных видов изомерии, в том числе изомерии положения NН2-группы относительно карбоксильной (иллюстрацией тому служит существование -аминокислот, -аминокислот и т.д.), важной для понимания строения, свойств и биологической роли аминокислот является стереоизомерия.
По аналогии с гидроксикислотами молекулы всех -аминокислот, кроме глицина, содержат асимметрический атом углерода, поэтому возможно наличие оптических изомеров, описываемых данной структурной формулой. Эти соединения могут быть причислены к R- или S-ряду, исходя из определения их абсолютной конфигурации (гл. 1.7.1). Однако часто для различия оптических изомеров аминокислот определяют их относительную конфигурацию, то есть отнесение к D- или L-ряду. Для классификации оптических изомеров гидроксикислот используют совпадение пространственного расположения заместителей у асимметрического атома углерода с расположением заместителей в D- или L-изомере глицеринового альдегида. Почти все природные -аминокислоты принадлежат к L-ряду (D-аминокислоты встречаются только в составе белков микроорганизмов):

,D-аминокислота ,L-аминокислота
Важнейшие природные ,L-аминокислоты приведены в табл. 6.7. Всем L-аминокислотам, за исключением цистеина, соответствует S-конфигурация асимметрического центра.
Таблица 6.7
Важнейшие природные ,L-аминокислоты и их изоэлектрические точки
|
Тривиальное название |
Формула |
Сокращённое обозначение* |
pI |
|
Глицин |
NH2CH2COOH |
Gly (G) |
5.97 |
|
Аланин |
CH3CH(NH2)COOH |
Ala (A) |
6.00 |
|
Аминомасляная |
CH3CH2CH(NH2)COOH |
Abu |
5.98 |
|
Валин |
(CH3)2CHCH(NH2)COOH |
Val (V) |
5.96 |
|
Норвалин |
CH3CH2CH2CH(NH2)COOH |
Nva |
5.97 |
|
Лейцин |
(CH3)2CHCH2CH(NH2)COOH |
Leu (L) |
5.98 |
|
Норлейцин |
CH3CH2CH2CH2CH(NH2)COOH |
Nle |
5.97 |
|
Изолейцин |
CH3CH2(CH3)CHCH(NH2)COOH |
Ile (I) |
5.94 |
|
Фенилаланин |
|
Phe (F) |
5.48 |
|
Серин |
HOCH2CH(NH2)COOH |
Ser (S) |
5.68 |
|
Треонин |
HO(CH 3)CHCH(NH2)COOH |
Thr (T) |
5.64 |
|
Тирозин |
|
Tyr (Y) |
5.66 |
|
Цистеин |
HSCH2CH(NH2)COOH |
Cys (C) |
5.02 |
|
Цистин |
|
(Cys)2 |
5.03 |
|
Метионин |
CH3SCH2CH2CH(NH2)COOH |
Met (M) |
5.74 |
|
Лизин |
NH2-(CH2)4-CH(NH2)COOH |
Lys (K) |
9.59 |
|
Орнитин |
NH2-(CH2)3-CH(NH2)COOH |
Orn |
9.70 |
|
Аргинин |
|
Arg (R) |
11.15 |
|
Аспарагиновая |
HOOC-CH2CH(NH2)COOH |
Asp (D) |
2.77 |
|
Аспарагин |
H2N-CO-CH2CH(NH2)COOH |
Asn (N) |
5.41 |
|
Глутаминовая |
HOOC-CH2CH2CH(NH2)COOH |
Glu (E) |
3.22 |
|
Глутамин |
H2N-CO-CH2CH2CH(NH2)COOH |
Gln (Q) |
5.65 |
|
Гистидин |
|
His (H) |
7.47 |
|
Триптофан |
|
Trp (W) |
5.89 |
|
Пролин |
|
Pro (P) |
6.30 |
|
Гидроксипролин |
|
Hyp |
5.74 |
* В скобках даётся однобуквенное обозначение, рекомендуемое ИЮПАК.
Изолейцин, треонин и гидроксипролин имеют два асимметрических атома и могут быть представлены в виде четырёх оптических изомеров:

изолейцин треонин гидроксипролин
В водном растворе часть L-аминокислот вращает плоскополяризованный свет влево, часть вправо. При этом в кислом растворе большинство L-аминокислот являются правовращающими, т. е. некоторые аминокислоты при переходе в область значений рН << 7 из левовращающих становятся правовращающими.