
- •Львівський національний медичний університет
- •Основні навчальні завдання модулю
- •Класифікація неонатальної енцефалопатії
- •Брадикардія;
- •Чинники ризику, пов’язані з потребою реанімації новонароджених
- •Передбачити можливість:
- •Необхідні додаткові обстеження новонародженого з підозрою на асфіксію
- •5. Матеріали методичного забезпечення заняття
- •5.1. Питання для самоконтролю
- •5.2. Тестові завдання
- •5.3. Інструктивні матеріали для відпрацювання професійних навиків і умінь
- •5.4. Відповіді
- •6. Рекомендована література:
- •5. Матеріали методичного забезпечення заняття
- •5.1. Питання для самоконтролю
- •5.2. Тестові завдання
- •5.3. Інструктивні матеріали для відпрацювання професійних навиків і умінь
- •5.4. Відповіді
- •Задача 1
- •Задача 2
- •6. Рекомендована література:
- •Клінічне оцінювання важкості др за шкалою Downes (1970)
- •Класифікація важкості др (вооз, 2003)
- •Обстеження новонародженого з др
- •Фізіологічні потреби у рідині протягом першого місяця життя дитини*
- •Показання до переливання еритромаси у новонароджених дітей з др
- •Прийнятні показники газового складу крові і кислотно-лужного стану в новонароджених
- •Порівняльна характеристика основних методів оксигенотерапії, що застосовують у новонароджених дітей
- •5. Матеріали методичного забезпечення заняття
- •5.1. Питання для самоконтролю
- •5.2. Тестові завдання
- •5.3. Інструктивні матеріали для відпрацювання професійних навиків і умінь
- •5.4. Відповіді
- •Задача 1
- •Задача 2
- •Сучасні визначення, діагностичні критерії і класифікація блд
- •5. Матеріали методичного забезпечення заняття
- •5.1. Питання для самоконтролю
- •5.2. Тестові завдання
- •5.3. Інструктивні матеріали для відпрацювання професійних навиків і умінь
- •5.4. Відповіді
- •Задача 1
- •Задача 2
- •6. Рекомендована література
- •2. Навчальні завдання
- •3. Міжпредметна інтеграція
- •4. Матеріали доаудиторної самостійної роботи
- •Алгоритм диференціальної діагностики неонатальних жовтяниць
- •Показання до замінного переливання крові в доношених новонароджених з гхн
- •Нормальні показники скринінгових коагуляцій них тестів у новонароджених
- •Диференціальний діагноз геморагічної хвороби новонароджених
- •I стадія - гіперкоагуляція
- •II стадія – коагулопатія споживання
- •III стадія – патологічний фібриноліз
- •5. Матеріали методичного забезпечення заняття
- •5.1. Питання для самоконтролю
- •5.2. Тестові завдання
- •5.3. Інструктивні матеріали для відпрацювання професійних навиків і умінь
- •Задача 2
- •5.4. Відповіді
Класифікація неонатальної енцефалопатії
|
Ознака |
Стадія 1 (легка) |
Стадія 2 (середньої важкості) |
Стадія 3 (важка) |
|
Свідомість Тонус
Смоктання Фізіологічні рефлекси Судоми Стовбурові рефлекси Дихання |
збудливість1 або2 Незначно порушений (гіпо-/ гіпер-)
або2 Порушене Підсилені
Немає Норма
Тахіпное |
Пригнічення Помірно порушений (гіпотонія або дистонія) Пригнічене Пригнічені
Наявні Норма
Періодичні апное |
Кома Значно порушений (гіпотонія)
Відсутнє Відсутні
Наявні Порушені
Важкі апное |
1 – наявність симптомів, виділених жирним шрифтом, є обов’язковою для діагностики певної стадії енцефалопатії;
2 – необхідна наявність однієї із зазначених двох ознак на додаток до симптомів підвищеної збудливості, щоб діагностувати 1 стадію енцефалопатії (енцефалопатію легкого ступеня).
Внутрішньоутробна гіпоксія
Діагноз «внутрішньоутробна гіпоксія» не повинен виставлятись новонародженій дитині.
Такі ознаки можливої внутрішньоутробної (інтранатальної) гіпоксії, як порушення серцевого ритму плода, нереактивний нестресовий тест, низькі показники біофізичного профілю плода, затримка внутрішньоутробного розвитку плода, меконіальне забруднення навколоплодових вод тощо, свідчать на користь діагнозу «асфіксія» лише за наявності діагностичних критеріїв, зазначених у пп. 4.1.1 і 4.1.2.
Таким самим чином слід інтерпретувати наявність в анамнезі матері анте- й інтранатальних чинників ризику, пов’язаних з розвитком внутрішньоутробної (інтранатальної) гіпоксії і необхідністю реанімації новонародженого
Етіологія перинатальної асфіксії
1. Порушення пуповинного кровоплину (компресія пуповини).
2. Порушення плацентарного газообміну (відшарування, передлежання, недостатність).
3. Неадекватна перфузія материнської частини плаценти (АТ, АТ, порушення скоротливої діяльності матки).
4. Порушена оксигенація материнської крові (хвороби серця, анемія).
5. Неспроможність плода здійснити перехід від фетального до постнатального дихання та кровообігу.
Патофізіологія перинатальної асфіксії
Механізми, що запобігають шкідливій дії гіпоксії у плода
Внутрішньочеревна адаптація плода до гіпоксії
Підвищена спорідненість фетального гемоглобіну до О2
Підвищена здатність тканин плода до екстракції О2
Підвищена здатність тканин функціонувати в умовах ацидозу
Фетальні захисні механізми від шкідливої дії гіпоксії
Брадикардія;
перерозподіл кровообігу;
кровопостачання: мозок, надниркові залози, серце;
кровопостачання: легені, кишки, печінка, селезінка, нирки, кістки та м’язи;
зменшене споживання кисню (додатковий ефект аденозину, гаммааміномасляної кислоти, опіатів, які вивільняються у мозковій тканині плода під дією гіпоксії);
інтенсивності метаболічних процесів і кількість глікогену допомагають плодові перенести триваліший період гіпоксії;
анаеробний гліколіз.
Реакція плода (новонародженого) на дію гіпоксії
Початковою реакцією є артеріальна гіпертензія і тахіпное, за якими виникають первинне апное (зупинка дихання) з брадикардією, а потім - судомні спроби дихати (нерегулярні дихальні рухи - дихання типу ґаспінґ).
З первинного апное плід (новонароджений) може вийти самостійно або за допомогою лише незначних зовнішніх стимулів.
Гіпоксія, що триває, призводить до виникнення вторинного апное, зростання брадикардії і розвитку шоку. Якщо плід (новонароджений) перебуває у стані вторинного апное, відновити самостійне дихання можна лише за допомогою штучної вентиляції легень. Отже, якщо вторинне апное виникло внутрішньоутробно або під час пологів і плід ще не загинув, можуть допомогти лише два втручання – негайні народження і реанімація.
Циркуляційні й інші патогенетичні ефекти
Загалом церебральне ураження відбувається тоді, коли гіпоксія спричинює порушення мозкового кровоплину (виникає ішемія).
Основною причиною цього вважається зменшення серцевого викиду (внаслідок значного ацидозу) й артеріальна гіпотензія.
Спочатку клітинне ушкодження й енергетична недостатність (дефіцит АТФ в умовах анаеробного гліколізу) є зворотними, і лише достатньо тривалий період ішемії або значна (критична) ішемія призводять до незворотних змін. Порушення окисного фосфорилювання можуть відбутися безпосередньо під час первинного гіпоксично-ішемічного інсульту або ж під час епізоду вторинної енергетичної недостатності, який виникає через 6-24 год. після інсульту. Саме зі вторинною енергетичною недостатністю значною мірою пов’язане вторинне ураження мозку (див. далі).
Розвиток декомпенсованої енергетичної недостатності блокує роботу клітинних протонних помп і спричинює надходження іонів Na+ у клітини з подальшим розвитком внутрішньоклітинного (цитотоксичного або раннього) набряку мозку.
Цей набряк зумовлює прогресивне зменшення перфузії тканин мозку. Зменшений церебральний кровоплин і гіпоксія мозкової тканини спричинюють ураження судин. Ураження мозкових судин є однією з найважливіших причин виникнення вторинного набряку мозку.
pаО2 (гіпоксемія) і pаСО2 (гіперкапнія) стимулюють церебральну вазодилятацію і разом з ацидозом спричинюють спазм легеневих судин. Збільшення просвіту судин мозку забезпечує зростання мозкового кровоплину, підвищене надходження глюкози у тканини і накопичення лактату в умовах анаеробного гліколізу. Таким чином підсилюється метаболічний ацидоз.
Ацидоз уважається основною причиною порушення скоротливої здатності міокарда ( серцевий викид) і втрати мозкової авторегуляції кровоплину (мозковий кровоплин стає залежним від системного кровообігу). Отже, з розвитком системної артеріальної гіпотензії прогресує церебральна ішемія.
Найбільш чутливими до ішемії ділянками кори вважаються зони термінальних судинних розгалужень, зокрема, парасагітальні ділянки.
На відміну від доношених немовлят, у яких переважно ушкоджується кора, в передчасно народжених дітей частіше уражується біла речовина перивентрикулярних ділянок з наступним формуванням перивентрикулярної лейкомаляції (ПВЛ).
Механізми ушкодження
Незворотне ушкодження клітин – виникає після періоду тривалої гіпоксії > 30 хв.; деякі клітини не відновлюються.
Тривала часткова гіпоксія (відшарування плаценти) спричинює дифузне ураження кори (некрози); гостра повна асфіксія (перетиснення пуповини) уважається причиною ураження стовбурових структур.
Відновлення кровоплину («реперфузія») – це період підвищеної перфузії тканин мозку після відновлення системного кровообігу на тлі реоксигенації (реанімація) після перенесеної гіпоксії/ішемії. Реперфузія «ішемічних» тканин може спричинити їх ураження, оскільки стимулює значну місцеву продукцію вільних кисневих радикалів (супероксид, пероксид водню, гідроксил, синглетний кисень тощо). Внаслідок цього можливе ушкодження клітинних ліпідів, білків і нуклеїнових кислот, а також порушення цілості гематоенцефалічного бар’єру. Це створює передумови для потрапляння у тканини мозку активованих нейтрофілів, які разом з мікроглією продукують прозапальні цитокіни (інтерлейкін 1-β [IL-1-β], фактор некрозу пухлин α [TNF-α] тощо) і спричинюють запальне ураження.
Ранній внутрішньоклітинний набряк (проходить через годину) може блокувати реперфузію (збільшені в об’ємі клітини перешкоджають відновленню кровоплину у термінальному судинному руслі).
Вторинний набряк розвивається через декілька годин після первинного інсульту внаслідок капілярної проникності і відповідно об'єму рідини у позаклітинному просторі.
Інші можливі механізми ушкодження включають обструкцію судин, спричинену:
агрегацією клітин,
судинним спазмом унаслідок дії іонів кальцію і простаноїдів,
набряком астроцитів та ендотеліоцитів.
Вторинне ураження мозку внаслідок дефіциту АТФ і деполяризації клітинних мембран з вивільненням нейротрансміттерів (активовані амінокислоти, зокрема, глутамат), активацією NMDA-рецепторів, відкриттям іонних (Na+, Cl-) каналів, а також активацією Са2+-залежних каналів з наступним інтенсивним надходженням іонів Са2+ до клітин.
Зростання внутрішньоклітинної концентрації Са2+ призводить до сповільненої клітинної смерті внаслідок:
активації Са2+-залежних фосфоліпаз, протеаз, ендонуклеаз, ксантиноксидази, NO-синтетази тощо;
порушення мітохондріального електронного транспорту (активація каспаз, вивільнення фактора індукції апоптозу);
генерації вільних кисневих радикалів, лейкотрієнів, цитокінів, оксиду нітрогену;
кінцевого виснаження клітинних енергетичних ресурсів.
Вільні кисневі радикали
у значній кількості утворюються під час реперфузії (гіпоксантинксантин оксидантна система), а також за рахунок інших механізмів;
можуть спричиняти гіпоперфузію фетального мозку через стимуляцію продукції лейкотрієнів й утворення лейкоцитарних тромбів;
уражують клітинні мембрани і спричинюють клітинну дезінтеграцію.
Смерть клітин може бути негайною або сповільненою за участі некротичних або апоптичних процесів.
негайну смерть нейронів спричинює осмотичне перевантаження Na+ і Ca2+ внаслідок активації NMDA-рецепторів глутаматом;
причиною сповільненої смерті клітин є неконтрольована активація ферментів й енергетичний дефіцит (див. вище);
апоптоз має більше значення у новонароджених порівняно з дітьми старшого віку і дорослими, пов’язаний з неважким інсультом; важкий інсульт частіше спричинює некротичні зміни;
активовані амінокислоти можуть також стимулювати АМРА-рецептори, що призводить до загибелі клітинних попередників олігодендроцитів.
Можливі морфологічні наслідки включають:
Вогнищеві або численні кортикальні некрози кістозна енцефаломаляція
Інфаркти сполучних зон ПВЛ
Селективні нейронні некрози, включаючи некрози таламічних і базальних гангліїв (найбільш поширена форма ураження)
Додаткові чинники, що впливають на віддалені наслідки
Метаболічні
рівень глюкози;
важкість лактоацидозу;
Гестаційний вік
для передчасно народжених немовлят характерний розвиток ПВЛ;
для доношених – ураження парасагітальної кори > плечовий пояс > кінцівки
Компресія пуповини: повна компресія пуповини тривалістю довше 10 хв. незворотно ушкоджує мозок.
Повторне ушкодження – періодичні повторні компресії пуповини в умовах маловоддя – дитячий церебральний параліч (ДЦП).
Затримка внутрішньоутробного розвитку – знижена здатність компенсувати шкідливі ефекти асфіксії внаслідок обмежених резервів і відповідно вищий ризик значного ураження мозку.
Діагностика перинатальної асфіксії
Оцінка стану плода під час вагітності
Своєчасне визначення ризику виникнення асфіксії – чинники ризику
Особливості перебігу вагітності Дані анамнезу
Артеріальна гіпертензія Медичні проблеми
Багатоплідна вагітність Народження дітей з малою Пізнє взяття на облік масою
Затримка розвитку плода Мертвонародження
Зменшення рухової активності плода Токсикоз
Червоний вовчак (антикоагулянт) Відшарування, передлежан- Активні медичні проблеми ня плаценти
> 42 тиж гестації Забруднення вод меконієм
Холестаз Діабет
Низький рівень материнського Пієлонефрит
-фетопротеїну у сироватці крові Наркоманія
Відшарування, передлежання плаценти
Травма, недіагностовані маткові кровотечі
Ізоімунізація
Оцінка вагітною рухів плода (має значення явна зміна звичайної рухової активності плода).
Оцінка фізичного розвитку плода (гравідограма, УЗО).
Нестресовий тест (НСТ)
Рутинне використання не покращує результатів перинатальної допомоги
Активність плода викликає рефлекторне прискорення серцевих скорочень (акцелерації)
Потрібний мінімальний рівень зрілості плода – 32 тиж гестації
Паралельний моніторинг ЧСС плода і скоротливої активності матки
Критерії реактивного тесту:
ЧСС плода між 110 та 160;
нормальна варіабельність серцевого ритму (5 ударів за хв.);
2 епізоди прискорення щонайменше на 15 скорочень/хв., що тривають мінімум 15 с. кожен, протягом 20 хв.
нереактивним тест уважається за умови невідповідності його результатів зазначеним 3 критеріям;
неадекватним тест вважається за умови неотримання чіткої кривої ЧСС плода.
Біофізичний профіль (БП) – дихальні і фізичні рухи плода, м’язовий тонус, НСТ, об’єм амніотичної рідини, стан плаценти)
Прогностична цінність вища, ніж у НСТ, однак, так само, не рекомендується для рутинного використання (тільки ситуації високого ризику)
Модифікований профіль за 2 компонентами (НСТ + об’єм амніотичної рідини) так само ефективний, як і 5- або 6-компонентний
Максимальна оцінка – 10-12 балів (норма)
БП і НСТ характеризуються високою прогностичною цінністю від’ємного результату (якщо результат тесту нормальний, імовірність порушення стану плода і виникнення проблем з новонародженим наближається до нуля)
Доплерографія/ доплерометрія (ефективність доведена для плодів з діагностованою затримкою внутрішньоутробного розвитку)
Оцінка стану плода під час пологів
Аускультація
Після перейми
Протягом 60 с
Кожні 15-30 хв. в першому періоді пологів
Не рідше, ніж кожні 5 хв. у другому періоді
Електронний моніторинг ЧСС плода (кардіотокографія, КТГ)
Рутинно не рекомендується, оскільки не покращує результатів перинатальної допомоги
Показання (ситуації високого ризику)
З боку матері
З боку плода
Інтранатальні стани
Кесарський розтин в анамнезі
Прееклампсія
Переношена вагітність (> 42 тиж)
Безводний період > 24 год.
Індукція пологів
Діабет
Допологова кровотеча
ЗВУР
Недоношеність
Маловоддя
Порушені показники доплерометрії
Багатопліддя
Меконій у амніотичній рідині
Тазове передлягання
Стимуляція окситоцином
Епідуральна анестезія
Вагінальна кровотеча під час пологів
Лихоманка у матері
Щільні частинки меконію у навколоплідних водах («свіжий меконій»)
Класифікація результатів КТГ
«Нормальна» – всі 4 параметри (див. нижче) у межах норми
«Підозріла» – 1 параметр у «загрозливій» категорії, всі інші – норма
«Патологічна» – 2 або більше параметрів у «загрозливій» категорії або 1 чи більше параметрів у «патологічній» категорії; цей тип КТГ є показанням для визначення газового складу крові плода; за відсутності такої можливості – прискорити пологи
Параметри класифікації порушень ЧСС плода
|
Категорії |
Базальний ритм (уд./хв.) |
Варіабельність (уд./хв.) |
Децелерації |
Акцелерації |
|
Норма |
110-160 |
≥5 |
Немає |
Є |
|
Загрозливий характер ритму |
100-109 161-180 |
<5 за ≥40, але <90 хв. |
Ранні децелерації Варіабельні децелерації Пролонговані децелерації до 3 хв. |
Відсутність акцелерацій з нормальною КТГ має сумнівне значення |
|
Патологічний характер ритму
|
<100 >180 Синусоїдальний ритм за ≥ 10 хв. |
<5 за ≥90 хв. |
Атипові варіабельні децелерації Пізні децелерації Поодинокі пролонговані децелерації > 3 хв. |
|
Визначення рН крові з передлеглої частини плода/ кордоцентез (рідко використовується у даний час – ризик ВІЛ-інфікування)
Нормальні pH і парціальний тиск газів у пуповинній крові плода
|
Судина |
pO2 (мм рт. ст.) |
pH |
pCO2 (мм рт. ст.) |
|
Артерія Вена |
10-20 25-35 |
7,20 - 7,28 7,28 - 7,36 |
45-55 35-45 |
ЕКГ плода/ аналіз ST – комплексу
NIRS (інфрачервона спектроскопія)
Ефективність 2 останніх методів діагностики продовжує вивчатись, і вони поки що не використовуються рутинно.
Адаптація плода до гіпоксії і біофізичні методи діагностики
|
Механізм |
Метод діагностики |
|
|
Клінічні ознаки асфіксії новонародженого
Потреба реанімації відразу після народження
Оцінка за Апґар < 7 балів протягом перших 5 хв. життя
Поява клінічних ознак гіпоксично-ішемічної енцефалопатії (ГІЕ) в перші 72 год. життя
Оцінка важкості ГІЕ дозволяє прогнозувати віддалені наслідки: якщо ГІЕ є важкою, неврологічні наслідки виявлятимуться у всіх (100 %) дітей, які виживуть; у випадку ГІЕ середньої важкості віддалених наслідків слід очікувати приблизно у половини немовлят; і значні наслідки, як правило, не виявляються у дітей з симптомами I стадії енцефалопатії
Наслідком гіпоксично-ішемічного ураження ЦНС може бути синдром невідповідної секреції антидіуретичного гормону
Гіпоксично-ішемічне ураження внутрішніх органів
Дихальна система: легенева гіпертензія, ушкодження сурфактантної системи (РДС), аспірація меконію, легенева кровотеча.
Сечовидільна система: протеїнурія, гематурія, олігурія, гостра ниркова недостатність.
Серцево-судинна система: недостатність тристулкового клапана, некроз міокарда, лівошлуночкова дисфункція, синусова брадикардія, ригідний серцевий ритм, артеріальна гіпотензія і шок.
Метаболічні порушення: метаболічний ацидоз, гіпоглікемія, гіпокальціємія, гіпонатріємія, гіперкаліємія.
Травна система: некротичний ентероколіт, печінкова дисфункція, шлункова або кишкова кровотеча, знижена толерантність до ентерального харчування.
Система крові: тромбоцитопенія, ДВЗ-синдром, поліцитемія.
Результати додаткових методів обстеження
Лабораторні дані
Як вже зазначалось, найбільш суттєве діагностичне значення має наявність метаболічного або змішаного ацидозу у крові, отриманій відразу після народження дитини (оптимально, – з артерії пуповини): ацидоз (метаболічний або змішаний): pH < 7,15; BE (-15 мекв/л; норма - 6,0 - 10,0 мекв/л)
Теоретично можуть також мати діагностичне значення вміст лактату в крові та лікворі (ураження мозку), вміст b-2 мікроглобуліну, креатиніну і сечовини у крові, гематурія (ураження нирок), активність креатинінфосфокінази -BB і -МВ (ураження мозку і міокарда), рівень білірубіну й активність трансаміназ у крові (ураження печінки). Більшість з цих досліджень рідко використовуються у вітчизняній медичній практиці.
Новонародженій дитині, в якої підозрюють наявність важкої асфіксії або асфіксії середньої важкості, призначають також інші додаткові обстеження, щоб об’єктивніше контролювати стан і оптимізувати лікування (див. розділ «Післяреанімаційна допомога»).
Інструментальні обстеження
Найбільш інформативним візуальним методом діагностики є магніторезонансна томографія (МРТ [MRI]) і спектроскопія (МРС, MRS), які дозволяють виявити ураження мозку в перші години після народження дитини (рис. 1). Однак, існують технічні труднощі у проведенні такого обстеження новонароджених у важкому стані (особливо тих, хто перебуває на ШВЛ)
Меншу точність мають комп’ютерна томографія (КТ) і нейросонографія (НСГ), результати яких в більшості випадків можуть бути інформативними лише після 7 дня життя
Прогностично важливими також можуть бути результати електроенцефалографії (сучасна модифікація цього методу – амплітудоінтегрована ЕЕГ – аЕЕГ).
Пов’язані з добрим прогнозом
Помірна (або незначна) депресія на 1 день
Нормалізація фонової активності до 7-го дня
Пов’язані з віддаленими наслідками
Спалахи низькоамплітудної активності у будь-якому віці
Iзоелектричні ділянки у будь-якому віці
Помірна (або значна) депресія після 12 дня
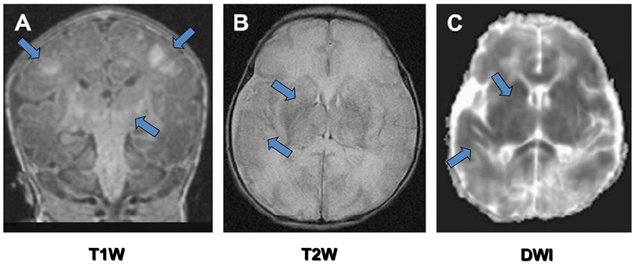
Рис. 1. МРТ (MRI): дифузне ураження нейронів (звичайні – Т1W, Т2W, і дифузна – DW, томограми).
ЕКГ і ЕхоКГ можуть виявляти зміни з боку серця, пов’язані з перенесеною ішемією.
Реанімаційна допомога новонародженому
Від своєчасності й якості виконання реанімаційних заходів значною мірою залежить результат порушеної ранньої постнатальної адаптації новонародженої дитини. Це впливає не лише на виживання немовлят в перші дні життя, але і на їхні розвиток і показники здоров’я в наступні вікові періоди. Надання адекватної реанімаційної допомоги новонародженим дозволяє знизити їх смертність і /або захворюваність на 5-40 %, і відповідний ефект може бути тим більшим, чим вищий рівень неонатальної смертності у країні або регіоні. Водночас, загальні принципи і протокол реанімації новонароджених дітей застосовують не лише безпосередньо після народження, але і протягом усього неонатального періоду.
Приблизно 5-10 % усіх новонароджених можуть потребувати принаймні часткової медичної допомоги в перші хвилини життя, а близько 1 % – повної реанімації, що включає непрямий масаж серця, інтубацію трахеї і введення ліків. В анамнезі майже половини дітей, які вимагають реанімаційної допомоги після народження, відсутні будь-які чинники ризику, що вказували б на можливість потреби в реанімації.
Водночас, за наявності таких чинників, приготування до надання медичної допомоги новонародженому передбачають залучення додаткового персоналу, насамперед, з добрими навичками інтубації трахеї (вища ймовірність повної реанімації) і використання додаткового обладнання (засоби для профілактики охолодження, газовий змішувач, обладнання для транспортування тощо).
