
- •Вопрос 1.Основные понятия термодинамики.
- •Вопрос 2. Первое начало термодинамики.
- •Вопрос 3. Второе начало термодинамики.
- •Вопрос 4. Термодинамические условия равновесия.
- •Вопрос 6. Предмет и основные понятия химической кинетики.
- •Вопрос 7. Зависимость скорости реакции от концентрации.
- •Вопрос 8. Зависимость скорости химической реакции от температуры.
- •Вопрос 9. Катализ.
- •Вопрос 10. Кислоты и основания.
- •Вопрос 12. Коллигативные свойства разбавленных растворов неэлектролитов и электролитов.
- •Второй закон Рауля
- •Вопрос 13. Элементы теории растворов электролитов.
- •Вопрос 14. Электрическая проводимость растворов.
- •Вопрос 15. Кондуктометрия. Использование кондуктометрических измерений в медицине и биологии.
- •Вопрос 16. Осмос.
- •Вопрос 17. Растворимость газов в жидкостях и ее зависимость от различных факторов.
- •Вопрос 21. Буферные системы крови: гидрокарбонатная, фосфатная, гемоглобиновая, протеиновая.
- •Белковая буферная система. В сравнении с другими буферными системами имеет меньшее значение для поддержания кислотно-основного равновесия.
- •Гемоглобиновая буферная система.
- •Вопрос 22. Гетерогенные реакции в растворах электролитов.
- •Вопрос 23. Механизм функционирования кальций-фосфатного буфера.
- •Вопрос 24. Строение комплексных соединений.
- •Вопрос 25. Константа нестойкости комплексного иона.
- •Вопрос 26. Представление о строении металлферментов и других биокомплексных соединений.
- •Вопрос 27. Окислительно-восстановительные реакции.
- •Вопрос 28. Константа окислительно-восстановительного процесса.
- •Вопрос 29. Адсорбционные равновесия и процессы на подвижных границах раздела.
- •Вопрос 30. Адсорбционные равновесия на неподвижных границах раздела фаз.
- •Вопрос 31. Классификация дисперсных систем.
- •Вопрос 32. Лигандные, гетерогенные и протолитические равновесия с участием важнейших биогенных элементов (примеры).
- •Вопрос 33. Устойчивость дисперсных систем.
- •Вопрос 34. Свойства растворов вмс.
- •Вопрос 35. Осмотическое давление растворов биополимеров.
- •Вопрос 36. Устойчивость растворов биополимеров.
- •Вопрос 37. Титриметрический анализ.
- •Вопрос 38. Окислительно-восстановительное титрование.
- •Вопрос 39. Комплексонометрическое титрование: комплексонометрия.
- •Вопрос 40. Потенциометрия.
Вопрос 15. Кондуктометрия. Использование кондуктометрических измерений в медицине и биологии.
Кондуктометрией называется физико-химический метод исследования различных систем, основанный на измерении их электрической проводимости.
Достоинства кондуктометрии: высокая чувствительность (ниж. граница определяемых концентраций ~10-4-10-5 М), достаточно высокая точность (относит, погрешность определения 0,1-2%), простота методик, доступность аппаратуры, возможность исследования окрашенных и мутных растворов, а также автоматизации анализа. Методы кондуктометрии бывают постояннотоковые и переменнотоковые, последние могут быть низкочастотными (частота тока <105 Гц) или высокочастотными (>105 Гц). Различают контактную и бесконтактную кондуктометрию в зависимости от наличия или отсутствия контакта между электролитом и входными цепями измерительного прибора. Наиболее распространены контактный низкочастотный и бесконтактный высокочастотный методы.
Использование в медицине:
Этот метод используют для определения общего содержания и состояния электролитов в различных биологических объектах: плазме и сыворотке крови, желудочном соке, моче, тканевой жидкости, а также в водах минеральных источников и в продуктах питания. Кондуктометрию применяют для изучения проницаемости мембран, для определения суммарного объема клеток (например, объема эритроцитов в крови), для количественного измерения потоотделения.
Вопрос 16. Осмос.
Осмосомназывают преимущественно одностороннее проникновение молекул растворителя (диффузию) через полупроницаемую мембрану из растворителя в раствор или из раствора с меньшей концентрацией в раствор с большей концентрацией.
Необходимым условием возникновения осмоса является наличие раствора и растворителя или двух раствор различной концентрации, разделенных полупроницаемой мембраной.
Осмотическим давлениемназывают величину, измеряемую минимальным гидравлическим давлением, которое нужно приложить к раствору, чтобы осмос прекратился.
Вант-Гоффа законопределяетдавлениемолекулрастворённоговеществана полупроницаемую перепонку, отделяющуюрастворот чистогорастворителяи непроницаемую для растворённоговещества.
π=с(Х)RT
π – осмотическое давление, с(Х) – молярная концентрация (моль/л), R – универсальная газовая постоянная ( 8,31 кПа, л/моль*К), T– абсолютная температура.
Растворы, имеющие одинаковое осмотическое давление, называют изотоническими. Изотонические растворы имеют одинаковое количество осмотически активных частиц.
Гипертоническийраствор — раствор с более высокой концентрацией растворенных веществ (более высоким осмотическим давлением) по сравнению с др. раствором
Гипотонический раствор — раствор, имеющий меньшее осмотическое давление по отношению к другому, то есть обладающий меньшей концентрацией вещества, не проникающего через мембрану.
Количество осмотически активных частиц в растворе выражается через осмомоляльность. Эта величина определяется концентрацией всех содержащихся в растворителе осмотически активных частиц (моль/кг).
Осмолярность– сумма концентраций всех осмотически активных частиц в 1л. раствора. Она выражается в осмолях на литр (осм/л).
Д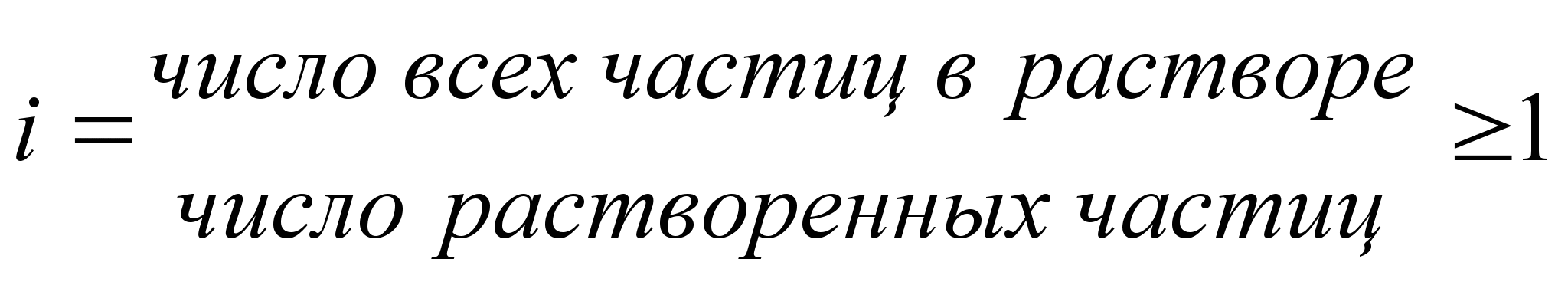 ля
описания коллигативных свойств растворов
электролитов используютизотонический
коэффициент:. (1.5)
ля
описания коллигативных свойств растворов
электролитов используютизотонический
коэффициент:. (1.5)
Изотонический коэффициент показывает, во сколько раз суммарная эффективная концентрация недиссоциированных молекул и ионов в растворе больше по сравнению с начальной концентрацией недиссоциированных молекул. С ростом концентрации коэффициентI уменьшается.
Изоосмия- относительное постоянствоосмотического давленияв жидких средах и тканях организма, обусловленное поддержанием на данном уровне концентраций содержащихся в них веществ: электролитов, белков и т. д.
Роль осмоса в биологических системах:
Явление осмоса играет важную роль во многих биологических системах. Благодаря осмосу регулируется поступление воды в клетки и межклеточные структуры. Упругость клеток, обеспечивающая эластичность тканей и сохранение определенной формы органов, обусловлена осмотическим давлением.
При помещении клеток в гипотонический раствор вода из менее концентрированного раствора переходит внутрь клеток, что приводит к их набуханию, а затем к разрыву оболочек и вытеканию клеточного содержимого. Такое разрушение – лизис.
При перемещении клеток в гипертонический раствор вода из клеток уходит в более концентрированный раствор и наблюдается сморщивание клеток. Это явление – плазмолиз.
Цитолиз — процесс разрушения клеток эукариот, выражающийся в виде их полного или частичного растворения под действием лизосомальных ферментов.
