
- •Вопрос 1.Основные понятия термодинамики.
- •Вопрос 2. Первое начало термодинамики.
- •Вопрос 3. Второе начало термодинамики.
- •Вопрос 4. Термодинамические условия равновесия.
- •Вопрос 6. Предмет и основные понятия химической кинетики.
- •Вопрос 7. Зависимость скорости реакции от концентрации.
- •Вопрос 8. Зависимость скорости химической реакции от температуры.
- •Вопрос 9. Катализ.
- •Вопрос 10. Кислоты и основания.
- •Вопрос 12. Коллигативные свойства разбавленных растворов неэлектролитов и электролитов.
- •Второй закон Рауля
- •Вопрос 13. Элементы теории растворов электролитов.
- •Вопрос 14. Электрическая проводимость растворов.
- •Вопрос 15. Кондуктометрия. Использование кондуктометрических измерений в медицине и биологии.
- •Вопрос 16. Осмос.
- •Вопрос 17. Растворимость газов в жидкостях и ее зависимость от различных факторов.
- •Вопрос 21. Буферные системы крови: гидрокарбонатная, фосфатная, гемоглобиновая, протеиновая.
- •Белковая буферная система. В сравнении с другими буферными системами имеет меньшее значение для поддержания кислотно-основного равновесия.
- •Гемоглобиновая буферная система.
- •Вопрос 22. Гетерогенные реакции в растворах электролитов.
- •Вопрос 23. Механизм функционирования кальций-фосфатного буфера.
- •Вопрос 24. Строение комплексных соединений.
- •Вопрос 25. Константа нестойкости комплексного иона.
- •Вопрос 26. Представление о строении металлферментов и других биокомплексных соединений.
- •Вопрос 27. Окислительно-восстановительные реакции.
- •Вопрос 28. Константа окислительно-восстановительного процесса.
- •Вопрос 29. Адсорбционные равновесия и процессы на подвижных границах раздела.
- •Вопрос 30. Адсорбционные равновесия на неподвижных границах раздела фаз.
- •Вопрос 31. Классификация дисперсных систем.
- •Вопрос 32. Лигандные, гетерогенные и протолитические равновесия с участием важнейших биогенных элементов (примеры).
- •Вопрос 33. Устойчивость дисперсных систем.
- •Вопрос 34. Свойства растворов вмс.
- •Вопрос 35. Осмотическое давление растворов биополимеров.
- •Вопрос 36. Устойчивость растворов биополимеров.
- •Вопрос 37. Титриметрический анализ.
- •Вопрос 38. Окислительно-восстановительное титрование.
- •Вопрос 39. Комплексонометрическое титрование: комплексонометрия.
- •Вопрос 40. Потенциометрия.
Вопрос 22. Гетерогенные реакции в растворах электролитов.
Гетерогенные реакции – химические реакции с участием веществ, находящихся в различных фазах и составляющих в совокупности гетерогенную систему.
Типичные гетерогенные реакции: термическое разложение солей с образованием газообразных и твердых продуктов, восстановление оксидов металлов водородом или углеродом, растворение Ме в кислотах и т.д.
Константа растворимости:
характеризует растворимость электролита при постоянной температуре в отсутствие посторонних веществ.
Константа растворимости (ПР, Ksp) — произведение концентрации ионов малорастворимого электролита в его насыщенном растворе при постоянной температуре и давлении. Произведение растворимости — величина постоянная.
При постоянной температуре в насыщенных водных растворах малорастворимых электролитов устанавливается равновесие между твердым веществом и ионами, образующими это вещество. Например, в случае для CaCO3 это равновесие можно записать в виде:
![]()
Константа
этого равновесия рассчитывается по
уравнению:
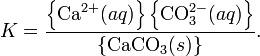
В общем виде, произведение растворимости для вещества с формулой AmBn, которое диссоциирует на m ионов An+ и n ионов Bm-, рассчитывается по уравнению:
![]()
где [An+] и [Bm-] — равновесные молярные концентрации ионов, образующихся при электролитической диссоциации.
![]() Данное
уравнение не учитывает коэффициенты
активности,
то есть степень влияния ионных сил. Для
растворов с концентрациями большими,
чем 1×10−4 моль/л
необходимо использовать произведение
активностей:
Данное
уравнение не учитывает коэффициенты
активности,
то есть степень влияния ионных сил. Для
растворов с концентрациями большими,
чем 1×10−4 моль/л
необходимо использовать произведение
активностей:
где аA и аB — активности ионов A и B.
Произведение активностей ионов для насыщенных растворов малорастворимых электролитов при данной температуре постоянная величина. Она зависит от температуры и природы растворителя.
Произведение растворимости связано с растворимостью следующим соотношением:
г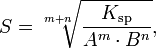 де:m+n —
суммарное количество молей катионов и
анионов
де:m+n —
суммарное количество молей катионов и
анионов
m —количество молей катиона
n — количество молей аниона
Ksp — произведение растворимости
S — растворимость вещества (моль/л)
Образование осадкапроисходит, если:
Это достигается прибавлением избытка электролита, содержащего одноименный ион K+или A-.
Н![]() апример,
если в раствор малорастворимого
электролита СаСО3внести
хорошо растворимый сильный электролитNа2СО3,
то повысится концентрация иона
СО32-и
понизится концентрация ионаCa2+и
следовательно, снизится растворимость
СаСО3, таким путем можно осаждать
малорастворимые соединения.
апример,
если в раствор малорастворимого
электролита СаСО3внести
хорошо растворимый сильный электролитNа2СО3,
то повысится концентрация иона
СО32-и
понизится концентрация ионаCa2+и
следовательно, снизится растворимость
СаСО3, таким путем можно осаждать
малорастворимые соединения.
Р![]() астворение
осадкапроисходит,
если:
астворение
осадкапроисходит,
если:
Это происходит, если связывается один из ионов, посылаемых осадком в раствор.
Например, растворение электролитаFeS происходит при добавлении раствора соляной кислотыHCl. Ионы водорода связывают ионыS2-в молекулыH2S, которые удаляются в виде газа. Произведение концентрации ионовFe2+ иS2- становится меньше произведения растворимости сульфида железа, и осадок растворяется.
Зная величину ПР, можно регулировать образование или растворение осадка, также оценить выпадает ли в данных условиях осадок. Для этого концентрацию ионов подставляют в выражение:
и![]() полученную величину сравнивают со
справочной. Осадок выпадет, если
полученная величина ПР превышает
табличную.
полученную величину сравнивают со
справочной. Осадок выпадет, если
полученная величина ПР превышает
табличную.
