
- •Вопрос 1.Основные понятия термодинамики.
- •Вопрос 2. Первое начало термодинамики.
- •Вопрос 3. Второе начало термодинамики.
- •Вопрос 4. Термодинамические условия равновесия.
- •Вопрос 6. Предмет и основные понятия химической кинетики.
- •Вопрос 7. Зависимость скорости реакции от концентрации.
- •Вопрос 8. Зависимость скорости химической реакции от температуры.
- •Вопрос 9. Катализ.
- •Вопрос 10. Кислоты и основания.
- •Вопрос 12. Коллигативные свойства разбавленных растворов неэлектролитов и электролитов.
- •Второй закон Рауля
- •Вопрос 13. Элементы теории растворов электролитов.
- •Вопрос 14. Электрическая проводимость растворов.
- •Вопрос 15. Кондуктометрия. Использование кондуктометрических измерений в медицине и биологии.
- •Вопрос 16. Осмос.
- •Вопрос 17. Растворимость газов в жидкостях и ее зависимость от различных факторов.
- •Вопрос 21. Буферные системы крови: гидрокарбонатная, фосфатная, гемоглобиновая, протеиновая.
- •Белковая буферная система. В сравнении с другими буферными системами имеет меньшее значение для поддержания кислотно-основного равновесия.
- •Гемоглобиновая буферная система.
- •Вопрос 22. Гетерогенные реакции в растворах электролитов.
- •Вопрос 23. Механизм функционирования кальций-фосфатного буфера.
- •Вопрос 24. Строение комплексных соединений.
- •Вопрос 25. Константа нестойкости комплексного иона.
- •Вопрос 26. Представление о строении металлферментов и других биокомплексных соединений.
- •Вопрос 27. Окислительно-восстановительные реакции.
- •Вопрос 28. Константа окислительно-восстановительного процесса.
- •Вопрос 29. Адсорбционные равновесия и процессы на подвижных границах раздела.
- •Вопрос 30. Адсорбционные равновесия на неподвижных границах раздела фаз.
- •Вопрос 31. Классификация дисперсных систем.
- •Вопрос 32. Лигандные, гетерогенные и протолитические равновесия с участием важнейших биогенных элементов (примеры).
- •Вопрос 33. Устойчивость дисперсных систем.
- •Вопрос 34. Свойства растворов вмс.
- •Вопрос 35. Осмотическое давление растворов биополимеров.
- •Вопрос 36. Устойчивость растворов биополимеров.
- •Вопрос 37. Титриметрический анализ.
- •Вопрос 38. Окислительно-восстановительное титрование.
- •Вопрос 39. Комплексонометрическое титрование: комплексонометрия.
- •Вопрос 40. Потенциометрия.
Вопрос 25. Константа нестойкости комплексного иона.
Характеристикой прочности комплексных соединений является константа нестойкости:
a(Mz+)a(Lx-)
Kнест = --------------------------.
a([MLn]z-nx)
Чем меньше константа нестойкости комплексного соединения, тем оно прочнее; однако такая закономерность применима только к однотипным комплексам, т.е. имеющим одинаковое число лигандов во внутренней сфере. Комплексные частицы, имеющие в составе несколько лигандов, диссоциируют ступенчато, подобно многоосновным кислотам. Например:
[Ag(NH3)2]+ = [Ag(NH3)]+ + NH3
[Ag(NH3)]+ = Ag+ + NH3
Каждая из ступеней может быть охарактеризована константой нестойкости:
a([Ag(NH3)]+)a(NH3)
Kнест,1 =-----------------------------------------;
a([Ag(NH3)2]+)
Как и в большинстве других случаев, для приближенных расчетов вместо активностей обычно используют концентрации.
Общая константа нестойкости комплекса равна произведению констант нестойкости по степеням, как следует из термодинамики.
Реакции замещения лигандов.
Общий вид реакции замещения для комплекса выглядит так:
![]()
Лигандное замещение трактуют как реакцию нуклеофильного замещения, такая интерпретация подтверждается опытами и существенно облегчила изучение кинетики подобных реакций.
Реакции замещения лигандов могут протекать по трем различным механизмам: ассоциативным, диссоциативным и механизмом взаимного обмена соответственно.
Ассоциативный механизм можно описать простой схемой:
![]()
Как видно, реакция сопровождается образованием промежуточного комплекса с большим координационным числом, от которого затем отщепляется исходный лиганд.
Диссоциативный механизм также легко описать соответствующей схемой:
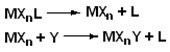
Реакция сопровождается образованием комплекса с меньшим координационным числом.
Реакции I механизма отличаются от предыдущих тем, что протекают в одну стадию:
![]()
Промежуточные соединения можно выделить для A и D механизмов, но невозможно для I механизма. Граница между A и I механизмом чрезвычайно размытая. Это объясняется тем, что довольно часто промежуточные продукты выделить очень трудно и реакцию ошибочно описывают A механизмом
Вопрос 26. Представление о строении металлферментов и других биокомплексных соединений.
Металлоферменты, или металлоэнзимы — общее собирательное название класса ферментов, для функционирования которых необходимо присутствие катионов тех или иных металлов. В подобном ферменте могут присутствовать несколько различных ионов металла. Катион металла при этом обеспечивает правильную пространственную конфигурацию активного центра металлофермента. Примерами металлоферментов являются селен-зависимая монодейодиназа, конвертирующая тироксин в трийодтиронин, или железо-зависимые тканевые дыхательные ферменты. Помимо принадлежности к классу ферментов, металлоферменты принадлежат также к обширному классу металлопротеидов — белков (не обязательно ферментов), в состав которых входят катионы металлов.
Промежуточное положение между специфическими и неспецифическими ферментами занимают некоторые металлоферменты. Ионы металлов выполняют функцию кофактора. Повышение прочности биокомплекса фермента повышает специфичность его биологического действия. На эффективность ферментативного действия иона металла фермента оказывает влияние его степень окисления. По интенсивности влияния микроэлементы расположены в следующий ряд:
Ti4+®Fe3+®Cu2+®Fe2+®Mg2+®Mn2+. Ион Мn3+ в отличии от иона Мn2+, очень прочно связан с белками, причем преимущественно с кислородосодержащими группами совместно Fe3+ входит в состав металлопротеинов.
Микроэлементы в комплексонатной форме выступают в организме в качестве фактора, определяющего, по-видимому, высокую чувствительность клеток к микроэлементам путем их участия в создании высокого градиента концентрации. Значения атомных и ионных радиусов, энергий ионизации, координационных чисел, склонность к образованию связей с одними и теми же элементами в молекулах биолигандов обусловливают эффекты, наблюдаемые при взаимном замещении ионов: может происходить с усилением (синергизм), так и с угнетением ихбиологической активности (антагонизм) замещаемого элемента. Ионы d-элементов в степени окисления +2 (Mn, Fe, Co, Ni, Zn) имеют сходные физико-химические характеристики атомов (электронную структуру внешнего уровня, близкие радиусы ионов, тип гибридизации орбиталей, близкие значения констант устойчивости с биолигандами). Сходство физико-химических характеристик комплексообразователя определяет близость их биологического действия и взаимозаменяемость. Указанные выше переходные элементы стимулируют процессы кроветворения, усиливают процессы обмена веществ. Синергизм элементов в процессах кроветворения связан возможно с участием ионов этих элементов в различных этапах процесса синтеза форменных элементов крови человека.
