
- •Вопрос 1.Основные понятия термодинамики.
- •Вопрос 2. Первое начало термодинамики.
- •Вопрос 3. Второе начало термодинамики.
- •Вопрос 4. Термодинамические условия равновесия.
- •Вопрос 6. Предмет и основные понятия химической кинетики.
- •Вопрос 7. Зависимость скорости реакции от концентрации.
- •Вопрос 8. Зависимость скорости химической реакции от температуры.
- •Вопрос 9. Катализ.
- •Вопрос 10. Кислоты и основания.
- •Вопрос 12. Коллигативные свойства разбавленных растворов неэлектролитов и электролитов.
- •Второй закон Рауля
- •Вопрос 13. Элементы теории растворов электролитов.
- •Вопрос 14. Электрическая проводимость растворов.
- •Вопрос 15. Кондуктометрия. Использование кондуктометрических измерений в медицине и биологии.
- •Вопрос 16. Осмос.
- •Вопрос 17. Растворимость газов в жидкостях и ее зависимость от различных факторов.
- •Вопрос 21. Буферные системы крови: гидрокарбонатная, фосфатная, гемоглобиновая, протеиновая.
- •Белковая буферная система. В сравнении с другими буферными системами имеет меньшее значение для поддержания кислотно-основного равновесия.
- •Гемоглобиновая буферная система.
- •Вопрос 22. Гетерогенные реакции в растворах электролитов.
- •Вопрос 23. Механизм функционирования кальций-фосфатного буфера.
- •Вопрос 24. Строение комплексных соединений.
- •Вопрос 25. Константа нестойкости комплексного иона.
- •Вопрос 26. Представление о строении металлферментов и других биокомплексных соединений.
- •Вопрос 27. Окислительно-восстановительные реакции.
- •Вопрос 28. Константа окислительно-восстановительного процесса.
- •Вопрос 29. Адсорбционные равновесия и процессы на подвижных границах раздела.
- •Вопрос 30. Адсорбционные равновесия на неподвижных границах раздела фаз.
- •Вопрос 31. Классификация дисперсных систем.
- •Вопрос 32. Лигандные, гетерогенные и протолитические равновесия с участием важнейших биогенных элементов (примеры).
- •Вопрос 33. Устойчивость дисперсных систем.
- •Вопрос 34. Свойства растворов вмс.
- •Вопрос 35. Осмотическое давление растворов биополимеров.
- •Вопрос 36. Устойчивость растворов биополимеров.
- •Вопрос 37. Титриметрический анализ.
- •Вопрос 38. Окислительно-восстановительное титрование.
- •Вопрос 39. Комплексонометрическое титрование: комплексонометрия.
- •Вопрос 40. Потенциометрия.
Вопрос 21. Буферные системы крови: гидрокарбонатная, фосфатная, гемоглобиновая, протеиновая.
Большое значение буферные системы имеют в поддержании кислотно-основного равновесия организмов. Внутриклеточные и внеклеточные жидкости всех живых организмов. Как правило, характеризуются постоянным значением рН, которое поддерживается с помощью различных буферных систем. Значение рН большей части внутриклеточных жидкостей находится в интервале от 6,8 до 7,8.
Гидрокарбонатная система. Мощнейшая и вместе с тем самая управляемая система внеклеточной жидкости и крови, на долю которой приходится около 10 % всей буферной ёмкости крови. Представляет собой сопряжённую кислотно-основную пару, состоящую из молекулы угольной кислоты H2CO3, являющейся источником протона, и бикарбонат-аниона HCO3−, выполняющего роль акцептора протона:
H2CO3 ↔ H+ + HCO3−.
Фосфатная буферная система. В крови емкость фосфатной буферной системы невелика (составляет не более 1% общей буферной емкости), в связи с низким содержанием фосфатов в крови. Фосфатный буфер выполняет значительную роль в поддержании физиологических значений рН во внутриклеточных жидкостях и моче.
Буфер образован неорганическими фосфатами. Роль кислоты в этой системе выполняет однозамещённый фосфат (NaH2PО4). А роль сопряженного основания — двузамещённый фосфат (Na2HPО4).
При рН = 7,4 соотношение [Н2РО4-/ НРО42-] равняется 1:4.
Буферные свойства системы при увеличении в крови содержания водородных ионов реализуются за счет их связывания с ионами НРО42- с образованием Н2РО4- (Н+ + НРО42- → Н2РО4-), а при избытке ионов ОН- — за счет связывания их с ионами Н2Р04- (ОН- + Н2РО4- → НРО4-2 + Н2О).
Фосфатная буферная
система крови тесно взаимосвязана с
гидрокарбонатной буферной системой.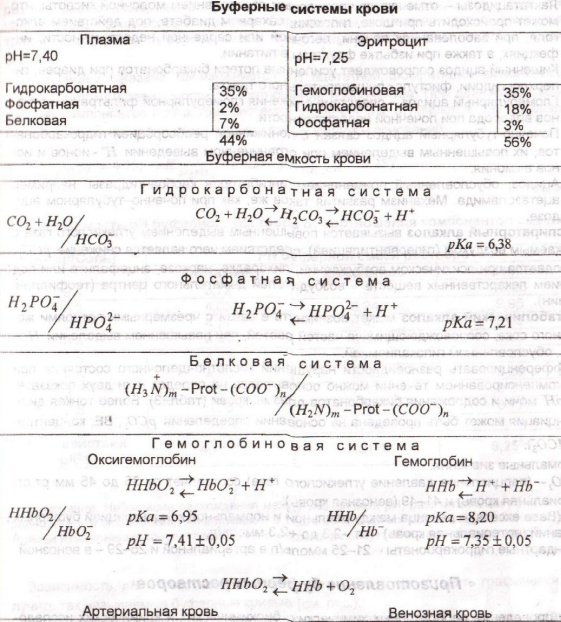
Белковая буферная система. В сравнении с другими буферными системами имеет меньшее значение для поддержания кислотно-основного равновесия.
Белки́ плазмы крови благодаря наличию кислотно-основных групп в молекулах белков (белок—H+ — кислота, источник протонов и белок− — сопряжённое основание, акцептор протонов) образуют буферную систему, наиболее эффективную в диапазоне pH 7,2—7,4.
Гемоглобиновая буферная система.
Самая мощная буферная система крови (в 9 раз мощнее гидрокарбонатной), на долю которой приходится 75 % всей буферной ёмкости крови. [H+]=K*[HHbO2]/[KHb].
Гидрокарбонат натрия применяют в качестве антацидного средства при повышенной кислотности желудочного сока, язвенной болезни желудка и 12-типерстной кишки. При приеме внутрь пищевая сода быстро нейтрализует соляную кислоту желудочного сока и оказывает выраженный антацидный эффект.
Трисамин. При в/в введении снижает концентрацию ионов водорода и повышает щелочной резерв крови, устраняет ацидоз. В отличие от натрия гидрокарбоната, не повышает концентрацию CO2 в крови. Проникая через клеточные мембраны, способен устранять внутриклеточный ацидоз, оказывает гипогликемическое и осмотическое диуретическое действие. При приеме внутрь не всасывается, действует как солевое слабительное.
Пероксид магния. В фармакологии используют препарат «Перекись магния», порошок, содержащий магния окиси 85% и магния перекиси 15%. Применяют при расстройствах пищеварения, брожении в желудке и кишечнике, поносе.
