
- •Вопрос 1.Основные понятия термодинамики.
- •Вопрос 2. Первое начало термодинамики.
- •Вопрос 3. Второе начало термодинамики.
- •Вопрос 4. Термодинамические условия равновесия.
- •Вопрос 6. Предмет и основные понятия химической кинетики.
- •Вопрос 7. Зависимость скорости реакции от концентрации.
- •Вопрос 8. Зависимость скорости химической реакции от температуры.
- •Вопрос 9. Катализ.
- •Вопрос 10. Кислоты и основания.
- •Вопрос 12. Коллигативные свойства разбавленных растворов неэлектролитов и электролитов.
- •Второй закон Рауля
- •Вопрос 13. Элементы теории растворов электролитов.
- •Вопрос 14. Электрическая проводимость растворов.
- •Вопрос 15. Кондуктометрия. Использование кондуктометрических измерений в медицине и биологии.
- •Вопрос 16. Осмос.
- •Вопрос 17. Растворимость газов в жидкостях и ее зависимость от различных факторов.
- •Вопрос 21. Буферные системы крови: гидрокарбонатная, фосфатная, гемоглобиновая, протеиновая.
- •Белковая буферная система. В сравнении с другими буферными системами имеет меньшее значение для поддержания кислотно-основного равновесия.
- •Гемоглобиновая буферная система.
- •Вопрос 22. Гетерогенные реакции в растворах электролитов.
- •Вопрос 23. Механизм функционирования кальций-фосфатного буфера.
- •Вопрос 24. Строение комплексных соединений.
- •Вопрос 25. Константа нестойкости комплексного иона.
- •Вопрос 26. Представление о строении металлферментов и других биокомплексных соединений.
- •Вопрос 27. Окислительно-восстановительные реакции.
- •Вопрос 28. Константа окислительно-восстановительного процесса.
- •Вопрос 29. Адсорбционные равновесия и процессы на подвижных границах раздела.
- •Вопрос 30. Адсорбционные равновесия на неподвижных границах раздела фаз.
- •Вопрос 31. Классификация дисперсных систем.
- •Вопрос 32. Лигандные, гетерогенные и протолитические равновесия с участием важнейших биогенных элементов (примеры).
- •Вопрос 33. Устойчивость дисперсных систем.
- •Вопрос 34. Свойства растворов вмс.
- •Вопрос 35. Осмотическое давление растворов биополимеров.
- •Вопрос 36. Устойчивость растворов биополимеров.
- •Вопрос 37. Титриметрический анализ.
- •Вопрос 38. Окислительно-восстановительное титрование.
- •Вопрос 39. Комплексонометрическое титрование: комплексонометрия.
- •Вопрос 40. Потенциометрия.
Вопрос 13. Элементы теории растворов электролитов.
Электролиты – это вещества с ионными или сильнополярными ковалентными связями в водных
растворах, подвергающиеся электролитической диссоциации, в результат чего образуются катионы и
анионы.
Сильные электролиты – вещества, способные диссоциировать нацело. К ним относится большинство
солей, а так же некоторые вещества молекулярного строения (HCl).
Слабые электролиты диссоциируют в незначительно степени, и преобладающей формой их является
молекулярная (H2S, органические кислоты).
Активность иона – это его эффективная концентрация.
Активность связана с молярной концентрацией следующим образом:
a=f*c,
где f – коэффициент активности выражает отклонение раствора с концентрацией c от поведения раствора при бесконечном разведении, т.е. в отсутствии межионных взаимодействий.
Электролиты в организме: Na и Cl участвуют в поддержании кислотно-щелочного баланса,
осмотического равновесия в организме. Са играет большую роль в построении костной ткани и зубов, в
регулировании кислотности крови и ее свертывании, в возбудимости мышечной и нервной ткани. К
находится преимущественно в жидкостях тела и мягких тканях, где является необходимым элементом
для поддержания осмотического давления, регуляции рН крови. Mg является кофактором многих
ферментативных реакций, необходим на всех этапах синтеза белка. В живых организмах Fe является
важным микроэлементом, катализирующим процессы обмена кислородом. Сo входит в состав
витамина В12, задействован при кроветворении, функциях нервной системы и печени, ферментативных
реакциях. Zn необходим для метаболизма витамина E, участвует в синтезе разных анаболических
гормонов в организме, включая инсулин, тестостерон и гормон роста. Mn оказывает влияние на рост,
образование крови и функции половых желёз.
Вопрос 14. Электрическая проводимость растворов.
Электрический ток есть упорядоченное перемещение заряженных частиц. Растворы электролитов обладают ионной проводимостью (являются т.н. проводниками второго рода), т.е. электропроводность растворов электролитов обусловлена перемещением ионов в электрическом поле (в отличие от электронной проводимости проводников первого рода).
Всякий проводник, по которому течет ток, представляет для него определенное сопротивление R, которое, согласно закону Ома, прямо пропорционально длине проводника l и обратно пропорционально площади сечения S; коэффициентом пропорциональности является удельное сопротивление материала ρ – сопротивление проводника, имеющего длину 1 см и сечение 1 см2:
![]() ,
Ом
,
Ом
В качестве количественной меры способности раствора электролита проводить электрический ток используют обычно удельную электропроводность κ (каппа) – величину, обратную удельному сопротивлению (т.е. величину, обратную сопротивлению столба раствора между электродами площадью 1 см2, находящимися на расстоянии 1 см):
![]() ,
Ом-1см-1
,
Ом-1см-1
Величина удельной электропроводности электролита зависит от ряда факторов: природы электролита, температуры, концентрации раствора. Удельная электропроводность растворов электролитов (в отличие от электропроводности проводников первого рода) с увеличением температуры возрастает, что вызвано увеличением скорости движения ионов за счет понижения вязкости раствора и уменьшения сольватированности ионов. Зависимость удельной электропроводности от концентрации раствора представлена на рис. 3.9.
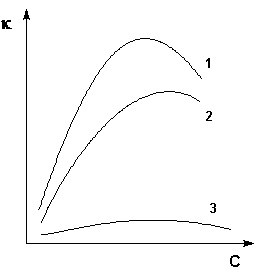
Рис. 3.9 Зависимость удельной электропроводности электролитов от концентрации (1 – H2SO4, 2 – KOH, 3 – CH3COOH)
Как видно из рисунка, с увеличением концентрации удельная электропроводность растворов сначала возрастает, достигая некоторого максимального значения, затем начинает уменьшаться. Эта зависимость очень чётко выражена для сильных электролитов и значительно хуже для слабых. Наличие максимума на кривых объясняется тем, что в разбавленных растворах сильных электролитов скорость движения ионов мало зависит от концентрации, и κ сначала растет почти прямо пропорционально числу ионов; с ростом концентрации усиливается взаимодействие ионов, что уменьшает скорость их движения. Для слабых электролитов наличие максимума на кривой обусловлено тем, что с ростом концентрации уменьшается степень диссоциации, и при достижении определенной концентрации число ионов в растворе начинает увеличиваться медленнее, чем концентрация. Для учета влияния на электрическую проводимость растворов электролитов их концентрации и взаимодействия между ионами введено понятие молярной электропроводности раствора.
Молярная электропроводность раствора λ есть величина, обратная сопротивлению раствора, содержащего 1 моль растворенного вещества и помещенного между электродами, расположенными на расстоянии 1 см друг от друга. С удельной электропроводностью κ и молярной концентрацией раствора С молярная электропроводность связана следующим соотношением:
![]() ,
Ом-1см2моль-1
(III.34)
,
Ом-1см2моль-1
(III.34)
Молярная электропроводность как сильных, так и слабых электролитов увеличивается с уменьшением концентрации (т.е. увеличением разведения раствора V = 1/С), достигая некоторого предельного значения λo, называемого молярной электропроводностью при бесконечном разведении (рис. 3.10 – 3.11).
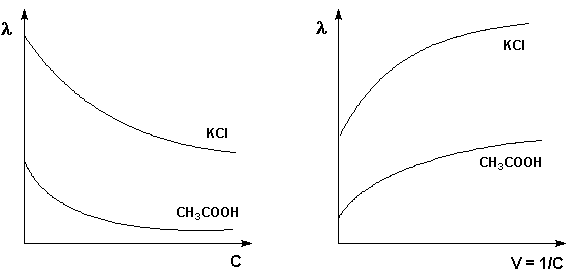
Рис. 3.10 Зависимость молярной Рис. 3.11 Зависимость молярной электропроводности от концентрации. электропроводности от разведения
Для слабого электролита такая зависимость молярной электропроводности от концентрации обусловлена в основном увеличением степени диссоциации с разбавлением раствора. В случае сильного электролита с уменьшением концентрации ослабляется взаимодействие ионов между собой, что увеличивает скорость их движения и, следовательно, молярную электропроводность раствора. Последнюю связывает с абсолютными скоростями движения катионов и анионов U+ и U– уравнение Аррениуса (III.35):
![]() (III.35)
(III.35)
Ф. Кольрауш показал, что в молярную электропроводность бесконечно разбавленных растворов электролитов каждый из ионов вносит свой независимый вклад, и λo является суммой молярных электропроводностей катиона и аниона λ+ и λ– (т.н. подвижностей ионов), и сформулировал закон независимости движения ионов:
Молярная электропроводность при бесконечном разведении равна сумме электролитических подвижностей катиона и аниона данного электролита.
![]() (III.36)
(III.36)
Подставив в это выражение уравнение Аррениуса, и приняв, что при бесконечном разведении степень диссоциации α равна единице, получим:
![]()
Отсюда
![]() ;
;
![]()
Электролитическая подвижность является важнейшей характеристикой иона, отражающей его участие в электропроводности раствора.
Электрическая
подвижность иона
![]() —
это скорость движенияi-иона
vi
в электрическом поле с напряженностью
—
это скорость движенияi-иона
vi
в электрическом поле с напряженностью
![]() В/м,
В/м,
![]() ,
,
где U — напряжение, поданное на электроды, l — расстояние между электродами, ui — подвижность i-иона, м2× В–1 · с–1; vi — скорость движения i-иона, м/с.
