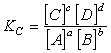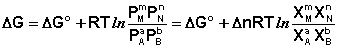- •Вопрос 1.Основные понятия термодинамики.
- •Вопрос 2. Первое начало термодинамики.
- •Вопрос 3. Второе начало термодинамики.
- •Вопрос 4. Термодинамические условия равновесия.
- •Вопрос 6. Предмет и основные понятия химической кинетики.
- •Вопрос 7. Зависимость скорости реакции от концентрации.
- •Вопрос 8. Зависимость скорости химической реакции от температуры.
- •Вопрос 9. Катализ.
- •Вопрос 10. Кислоты и основания.
- •Вопрос 12. Коллигативные свойства разбавленных растворов неэлектролитов и электролитов.
- •Второй закон Рауля
- •Вопрос 13. Элементы теории растворов электролитов.
- •Вопрос 14. Электрическая проводимость растворов.
- •Вопрос 15. Кондуктометрия. Использование кондуктометрических измерений в медицине и биологии.
- •Вопрос 16. Осмос.
- •Вопрос 17. Растворимость газов в жидкостях и ее зависимость от различных факторов.
- •Вопрос 21. Буферные системы крови: гидрокарбонатная, фосфатная, гемоглобиновая, протеиновая.
- •Белковая буферная система. В сравнении с другими буферными системами имеет меньшее значение для поддержания кислотно-основного равновесия.
- •Гемоглобиновая буферная система.
- •Вопрос 22. Гетерогенные реакции в растворах электролитов.
- •Вопрос 23. Механизм функционирования кальций-фосфатного буфера.
- •Вопрос 24. Строение комплексных соединений.
- •Вопрос 25. Константа нестойкости комплексного иона.
- •Вопрос 26. Представление о строении металлферментов и других биокомплексных соединений.
- •Вопрос 27. Окислительно-восстановительные реакции.
- •Вопрос 28. Константа окислительно-восстановительного процесса.
- •Вопрос 29. Адсорбционные равновесия и процессы на подвижных границах раздела.
- •Вопрос 30. Адсорбционные равновесия на неподвижных границах раздела фаз.
- •Вопрос 31. Классификация дисперсных систем.
- •Вопрос 32. Лигандные, гетерогенные и протолитические равновесия с участием важнейших биогенных элементов (примеры).
- •Вопрос 33. Устойчивость дисперсных систем.
- •Вопрос 34. Свойства растворов вмс.
- •Вопрос 35. Осмотическое давление растворов биополимеров.
- •Вопрос 36. Устойчивость растворов биополимеров.
- •Вопрос 37. Титриметрический анализ.
- •Вопрос 38. Окислительно-восстановительное титрование.
- •Вопрос 39. Комплексонометрическое титрование: комплексонометрия.
- •Вопрос 40. Потенциометрия.
Вопрос 4. Термодинамические условия равновесия.
|
ТЕРМОДИНАМИЧЕСКОЕ РАВНОВЕСИЕ - состояние термодинамической. системы, не изменяющееся во времени и не сопровождающееся переносом через систему вещества или энергии. Изолированная система, не обменивающаяся со средой веществом и энергией, со временем всегда приходит к термодинамическому равновесию и не может самопроизвольно из него выйти. Постепенный переход системы из неравновесного состояния, вызванного внешним воздействием, в состояние термодинамического равновесия называется релаксацией.
Термодинамическое равновесие включает: термическое равновесие - постоянство температуры в объеме системы, отсутствие градиентов температуры; механическое равновесие, при котором невозможны никакие макроскопические перемещения частей системы, т. е. имеется равенство давления в объеме системы; допустимы, однако, движения системы как целого – поступательное движение в поле действия внешних сил и вращение. В случае гетерогенной системы сосуществование термодинамически равновесных фаз называется фазовым равновесием. Если между компонентами системы происходят химические реакции, в состоянии термодинамического равновесия скорости прямых и обратных процессов равны между собой. При термодинамическом равновесии в системе прекращаются все необратимые процессы переноса (теплопроводность, диффузия, вязкое течение и т.п.). В системе не наблюдается изменение концентраций реагирующих веществ, для закрытой системы характерно равновесное распределение компонентов между составляющими систему фазами. Параметры состояния, определяющие термодинамическое равновесие, строго говоря, не являются постоянными, а флуктуируют около некоторых статистических средних значений; обычно эти флуктуации пренебрежимо малы. Термодинамические условия равновесия: ΔG=0 ΔH=TΔS
Под стандартной энергией Гиббса образованияΔG°, понимают изменение энергии Гиббса при реакции образования 1 моль вещества, находящегося в стандартном состоянии. Это определение подразумевает, что стандартная энергия Гиббса образования простого вещества, устойчивого в стандартных условиях, равна нулю. Изменение энергии Гиббса не зависит от пути процесса, следовательно, можно получать разные неизвестные значения энергий Гиббса образования из уравнений, в которых с одной стороны записаны суммы энергий продуктов реакции, а с другой - суммы энергий исходных веществ. При пользовании значениями стандартной энергии Гиббса критерием принципиальной возможности процесса в нестандартных условиях принимается условие ΔG° <0, а критерием принципиальной невозможности — условие ΔG°> 0. В то же время, если стандартная энергия Гиббса равна нулю, это не означает, что в реальных условиях (отличных от стандартных) система будет в равновесии. Примеры экзэргонических и эндэргонических процессов, протекающих в организме. Термические реакции, при протекании которых происходит уменьшение энергии Гиббса (dG<0) и совершается работа называются ЭКЗЕРГОНИЧЕСКИМИ(окисление глюкозы дикислородом- C6H12O6+6O2=6CO2+6H2O, dG=-2880 кДж/моль! Реакции в результате которых энергия Гиббса возрастает (dG>0) и над системой совершается работа, называются ЭНДЕРГОНИЧЕСКИМИ!
Вопрос 5. Химическое равновесие.
Химическое равновесие - состояние системы, в котором скорость прямой реакции равна скорости обратной реакции. Обратимые и необратимые реакции. Все химическое реакции можно подразделить на 2 группы: обратимые и необратимые. Необратимые – это реакции, которые идут до конца в одном направлении. Обратимыми – называются реакции, которые могут протекать в рассматриваемых условиях как в прямом, так и обратном направлениях. Реакция, протекающая слева направо, называется прямой, а справа налево – обратной. Константа химического равновесия - величина, определяющая для данной хим. реакции соотношение между термодинамическими активностями исходных в-в и продуктов в состоянии хим. равновесия.
Для реакции:
Константа равновесия выражается равенством:
Термодинамические условия равновесия: ΔG=0 ΔH=TΔS
Зависимость константы равновесия реакции от температуры может быть описана уравнением изобары химической реакции (изобарыВант-Гоффа):
Уравнение изотермы химической реакции. Уравнение изотермы химической реакции позволяет рассчитать величину энергии Гиббса ΔG (ΔF) при переходе из любого состояния системы в равновесное, т.е. ответить на вопрос, будет ли химическая реакция протекать самопроизвольно при данных концентрациях Сi (давлениях Рi) реагентов:
При изменении равновесных концентраций исходных веществ и продуктов реакции путем воздействия на систему происходит смещение химического равновесия. Характер смещения равновесия можно прогнозировать, применяя принцип Ле Шателье:
Общий принцип, позволяющий прогнозировать смещение равновесия: Воздействие какого-либо фактора на равновесную систему стимулирует смещение равновесия в таком направлении, которое способствует восстановлению первоначальных характеристик смещения. Гомеостаз - совокупность сложных приспособительных реакций организма животного и человека, направленных на устранение или максимальное ограничение действия различных факторов внешней или внутренней среды организма. Способность организма сохранять постоянство своего внутреннего состояния. Стационарное состояние- это типичное состояние живых объектов. Оно характеризуется постоянным уровнем энергии, а изменение энтропии стремиться к нулю. Все основные физиологические процессы реализуются при стационарном состоянии системы. |